氨茶碱、地塞米松对哮喘患者CD4+CD25+T调节细胞抑制功能的影响
张 妍,周文英,邬伟明,黄 瑾△
(中山大学附属第五医院:1.呼吸科;2.中心实验室,广东珠海519000)
支气管哮喘的发病与Th1/Th2系统失衡和 Th2细胞优势分化相关,Th2型细胞因子IL-4可促进IgE的产生,IL-5可促进嗜酸性粒细胞的分化,IL-13可促进黏液的分泌和诱导气道高反应性,从而介导哮喘气道炎症和气道重塑过程。而Th1型细胞因子IFN-γ可抑制Th2型细胞的分化,被认为对过敏性疾病的发生具有保护作用。但Th1/Th2理论并不能充分解释哮喘的发病机制[1]。自CD4+CD25+T调节细胞被首次报道以来,这类具有独特免疫调节作用的专职调节细胞在自身免疫性疾病、移植排斥反应和过敏性疾病中的作用越来越受到重视。糖皮质激素类药物和茶碱类药物均是目前治疗哮喘的一线用药。激素类能有效控制气道炎症,茶碱类能抑制磷酸二酯酶活性,使细胞内cAMP增高从而引起支气管扩张,但有证据显示茶碱在其血药浓度尚未达到影响支气管平滑肌张力时就可发挥免疫调节和抗炎作用[2]。本实验观察哮喘患者及健康对照者CD4+CD25+T调节细胞对Th1/Th2型细胞因子产生的影响及激素类药物地塞米松和小剂量氨茶碱对 CD4+CD25+T调节细胞作用的影响,旨在进一步探讨哮喘患者CD4+CD25+T调节细胞的作用是否存在缺陷及不同药物对其作用的影响,从而为哮喘的更有效控制提供依据。
1 临床资料
1.1 研究对象 哮喘患者12例,男 7例,女 5例,平均年龄(33±11)岁。按《支气管哮喘防治指南》[3]明确诊断,为本院门诊及住院患者,均未使用茶碱类药物、糖皮质激素类药物或停药2周以上。健康成年人9例,平均年龄(28±12)岁,男5例,女4例,为本院健康志愿者。
1.2 主要试剂与仪器 完全培养基包括RPM I-1640培养基(Gibco公司)、10%小牛血清(杭州四季清公司)、2mmol/L L-谷氨酰胺、10mmol/L HEPES、100u/mL青霉素、100u/mL链霉素等。氨茶碱、地塞米松购自Sigma公司。淋巴细胞分离液(1.073g/mL)购自上海恒信化学试剂有限公司。鼠抗人CD8纯化抗体、鼠抗人CD25-纯化抗体、羊抗鼠IgG免疫磁珠以及荧光抗体包括鼠抗人CD4-FITC、鼠抗人CD25-PE及鼠抗人IgG1-FITC/IgG1-PE购自美国BD Pharmingen公司。抗CD3纯化抗体、抗CD28纯化抗体购自北京晶美科技有限公司。人IL-5、IL-13、IFN-γELISA试剂盒购自深圳达科为生物科技有限公司。FACS Calibur型流式细胞仪购自美国Becton Dickinson公司。酶标仪购自INSTRUMENTS.INC公司。
1.3 实验方法
1.3.1 外周血CD4+CD25+T调节细胞的分离[4]采集哮喘患者及健康对照者外周静脉血30mL,分离、洗涤外周血单核细胞,并用尼龙棉柱分离出T淋巴细胞。按2μ g/107个细胞加入鼠抗人CD8纯化抗体,37℃下孵育30min,1 000r/min离心5min,弃上清液中未结合的抗体,按 120μ g/107个细胞加入羊抗鼠IgG免疫磁珠,在37℃下反应30min,间隔 10min轻轻晃动反应管。接着加入3mL完全培养基重悬细胞,用磁分离器分离8min,收集未被免疫磁珠结合的细胞悬液至另一干净管中,所得即为CD4+T淋巴细胞。取分离后的CD4+T淋巴细胞,按前分离方法及添加比例依次加入鼠抗人CD25纯化抗体、羊抗鼠IgG免疫磁珠,用磁分离器分离,收集未被磁珠结合的细胞即为CD4+CD25-T淋巴细胞,被磁珠结合的细胞即为CD4+CD25+T调节细胞。取105个CD4+CD25+T调节细胞加入抗CD4-FITC及抗CD25-PE标记,用流式细胞仪检测[4]双阳性细胞的纯度为81.3%~89.8%,可用于下一步实验。
1.3.2 CD4+CD25+T调节细胞与CD4+CD25-T淋巴细胞的体外培养及药物干预 以1640完全培养基调整细胞浓度,置96孔板培养,设CD4+CD25+T调节细胞组(2.5×104/孔)、CD4+CD25-T淋巴细胞组(105/孔)及CD4+CD25+T调节细胞联合CD4+CD25-T覆水难收细胞组(2.5×104+105/孔),第3组又分为氨茶碱干预组(5mg/L)、地塞米松干预组(10-5mol/L)及空白对照组,各组均设3个复孔,每孔另外添加抗CD3纯化抗体(10μ g/mL)及抗 CD28纯化抗体(10μ g/mL),调整每孔体积为200μ L。为避免添加药物对CD4+CD25-T淋巴细胞产生影响,参照Dao Nguyen和 Robinson[5]的处理方法,先予氨茶碱、地塞米松及平衡液预处理CD4+CD25+T调节细胞,置 37℃、5%CO2培养箱内 12h后,以 1640完全培养基离心洗涤CD4+CD25+T调节细胞以去除干预药物对后续培养的影响。细胞接种后培养72h,取培养上清液100μL,-20℃保存,用于细胞因子的检测。
1.3.3 IL-5、IL-13及IFN-γ水平的检测 严格按照试剂盒说明书操作,测吸光度(A450nm)值,通过标准曲线计算培养上清液中各细胞因子的含量,结果以pg/mL表示。
1.4 统计学方法 采用SPSS 13.0统计软件分析,数据以表示,采用独立样本t检验及配对样本t检验,以 P<0.05为差异有统计学意义。
2 结 果
2.1 分离得的CD4+CD25+T调节细胞纯度检测 CD4+CD25+T调节细胞纯度为81.3%~89.8%,检测结果见图1。

图1 流式细胞仪检测分离得的CD4+CD25+T调节细胞纯度
2.2 哮喘患者细胞培养上清液中 IFN-γ、IL-5、IL-13水平测定 详见表1。哮喘患者CD4+CD25+T调节细胞能有效抑制CD4+CD25-T淋巴细胞生成 IFN-γ、IL-5(P<0.01),对IL-13的合成无显著抑制作用;采用地塞米松预处理CD4+CD25+T调节细胞后,CD4+CD25+T调节细胞抑制IL-5、IL-13生成能力增强(P<0.01);采用氨茶碱预处理后,CD4+CD25+T调节细胞抑制IL-5生成的能力增强(P<0.01)。
表1 哮喘患者细胞培养上清液中IFN-γ、IL-5、IL-13水平测定(n=12pg/mL)
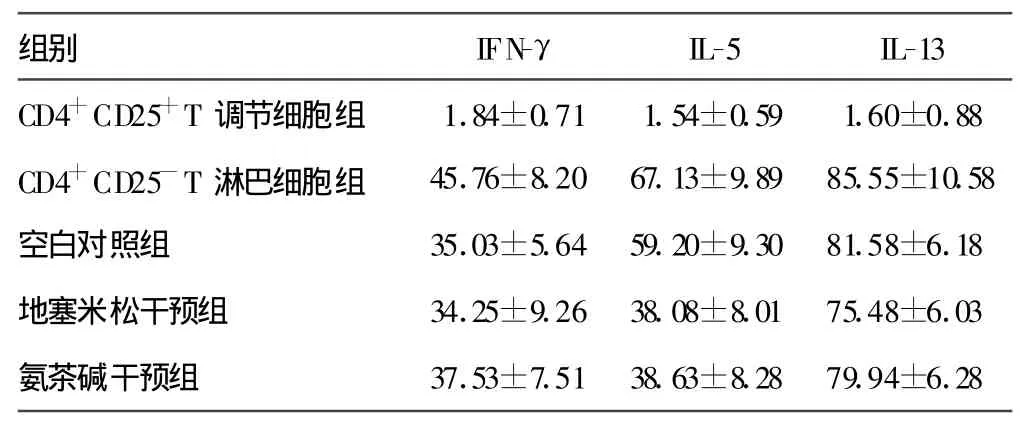
表1 哮喘患者细胞培养上清液中IFN-γ、IL-5、IL-13水平测定(n=12pg/mL)
组别 IFN-γ IL-5 IL-13 CD4+CD25+T调节细胞组 1.84±0.71 1.54±0.59 1.60±0.88 CD4+CD25-T淋巴细胞组 45.76±8.20 67.13±9.89 85.55±10.58空白对照组 35.03±5.64 59.20±9.30 81.58±6.18地塞米松干预组 34.25±9.26 38.08±8.01 75.48±6.03氨茶碱干预组 37.53±7.51 38.63±8.28 79.94±6.28
表2 健康对照者细胞培养上清液中IFN-γ、IL-5、IL-13水平测定(n=9,pg/mL)

表2 健康对照者细胞培养上清液中IFN-γ、IL-5、IL-13水平测定(n=9,pg/mL)
与空白组比较,*:P<0.05,▲:P<0.01;CD4+CD25+T细胞组未参与比较。
组别 IFN-γ IL-5 IL-13 CD4+CD25+T调节细胞组 1.64±0.41 1.46±0.60 1.30±0.48 CD4+CD25-T淋巴细胞组 48.00±7.96▲ 53.81±6.92▲ 79.90±6.21▲空白对照组 35.31±3.77 42.71±5.17 55.01±10.75地塞米松干预组 31.01±5.24* 29.96±2.81▲ 45.71±6.27▲氨茶碱干预组 38.96±5.32 31.78±4.39▲ 46.79±6.64*
2.3 健康对照者细胞培养上清液中IFN-γ、IL-5、IL-13水平测定 详见表2。健康对照者CD4+CD25+T调节细胞能有效抑制CD4+CD25-T淋巴细胞生成 IFN-γ、IL-5及IL-13(P<0.01);采用地塞米松预处理后,CD4+CD25+T调节细胞抑制IFN-γ(P<0.05)、IL-5(P<0.01)及 IL-13(P<0.01)生成的能力显著增强;采用氨茶碱预处理后,CD4+CD25+T调节细胞抑制IL-5(P<0.01)、IL-13(P<0.05)生成的能力亦显著增强。
3 讨 论
目前大量研究提示CD4+CD25+T调节细胞在哮喘的发病机制中起着重要的作用。Kearley等[6]证实:CD4+CD25+T调节细胞可以抑制气道嗜酸性粒细胞的聚集及Th2型细胞因子的产生。Ling等[7]研究发现,枯草热患者体内分离的CD4+CD25+T调节细胞抑制细胞增殖的能力在非花粉传授季节是降低的,在花粉传授季节更低。而Grindebacke等[8]发现虽然来自过敏症者和非过敏症者的CD4+CD25+T调节细胞在花粉传授季节均可以有效地抑制T细胞的增殖,但是过敏症者的CD4+CD25+T调节细胞不能有效抑制花粉诱导的Th2型细胞因子的产生,但可抑制 Th1型细胞因子(IFN-γ)的产生。推测CD4+CD25+T调节细胞可通过抑制CD4+CD25-T淋巴细胞过度增殖、抑制Th2型细胞因子过度产生,在哮喘的发病机制中起重要作用。而哮喘患者体内CD4+CD25+T调节细胞存在功能缺陷,从而介导哮喘发病。但也有相反的观点,Shi等[9]将CD4+CD25-T淋巴细胞与CD4+CD25+T调节细胞共同培养时,发现健康者和哮喘患者提供的细胞均被抑制,来自健康者和哮喘患者的CD4+CD25+T调节细胞之间的抑制功能没有差别。本试验发现,哮喘患者外周血分离的 CD4+CD25+T调节细胞可有效抑制Th1型细胞因子(IFN-γ)的分泌,并可有效抑制 Th2型细胞因子(IL-5)的分泌,而对IL-13的分泌则无明显抑制作用。健康者分离的CD4+CD25+T调节细胞对Th1型细胞因子(IFN-γ)及Th2型细胞因子(IL-5、IL-13)的产生均有抑制作用。提示哮喘患者CD4+CD25+T调节细胞在抑制Th2型细胞因子产生的功能上存在部分缺陷。
糖皮质激素是治疗哮喘的一线用药,关于其对 CD4+CD25+T调节细胞功能的影响,目前已有部分研究。有动物实验发现给BA LB/c小鼠注射地塞米松后,小鼠淋巴器官尤其是胸腺中CD4+CD25+T调节细胞数量及CD4+CD25+/CD4+CD25-T淋巴细胞比例均升高。CD4+CD25+T调节细胞和CD4+CD25-T细胞对地塞米松表现出不同的凋亡反应,IL-2可选择性地保护CD4+CD25+T调节细胞,地塞米松对CD4+CD25+T调节细胞的调节可能参与其抗炎及免疫抑制作用[10]。Dao Nguyen和 Robinson[5]在体外培养实验中,激素预处理的CD4+CD25+T调节细胞在随后与抗原诱导的CD4+CD25-T细胞共培养时,具有更强的抑制增殖的能力,该效应见于健康者及过敏症者,后者增强的程度稍低。本实验中,采用地塞米松预处理CD4+CD25+T调节细胞后,哮喘患者和健康对照者CD4+CD25+T调节细胞抑制Th2型细胞因子(IL-5、IL-13)分泌的能力均显著增强,健康对照者CD4+CD25+T调节细胞抑制IFN-γ产生的能力亦增强。提示地塞米松可增强健康对照者及哮喘患者CD4+CD25+T调节细胞抑制 Th2型细胞因子产生的能力,且两者对地塞米松的反应性无差异;地塞米松还增强健康对照者CD4+CD25+T调节细胞抑制Th1型细胞因子产生的能力。推测激素类药物控制哮喘发作的机制之一可能是通过增强CD4+CD25+T调节细胞对Th2型反应的抑制能力来发挥作用,且哮喘患者与健康对照者CD4+CD25+T调节细胞对激素治疗的反应无显著差别。
氨茶碱也广泛应用于治疗哮喘方面。近年研究发现小剂量氨茶碱对哮喘患者有显著的抗炎作用[2]。Jaffar等[11]发现在给予哮喘患者小剂量氨茶碱后,其气道嗜酸性粒细胞浸润程度降低,CD4+T细胞比例降低。Nie等[12]在对接受小剂量氨茶碱规律治疗的哮喘患者的痰液研究后发现,痰中嗜酸性粒细胞比例降低,IL-5水平下降,但CD4+T细胞比例及IFN-γ水平无显著变化。本实验通过小剂量氨茶碱预处理CD4+CD25+T调节细胞后,发现健康对照者CD4+CD25+T调节细胞抑制Th2型细胞因子(IL-5、IL-13)能力显著增强,而哮喘患者仅对IL-5抑制能力增强,两者抑制IFN-γ生成的能力均无显著改变。提示小剂量氨茶碱可增强健康者CD4+CD25+T调节细胞抑制Th2型细胞因子产生的能力,从而发挥免疫调节作用,氨茶碱对哮喘者CD4+CD25+T调节细胞的抑制能力也有增强,但增强程度不如前者。
综上所述,本实验认为与健康对照者比较,哮喘患者CD4+CD25+T调节细胞在抑制Th2型细胞因子产生方面存在部分功能缺陷;地塞米松可增强健康者和哮喘患者CD4+CD25+T调节细胞抑制Th2型细胞因子的能力,且两者对该药物反应无差别;氨茶碱也可增强健康者和哮喘者CD4+CD25+T调节细胞对Th2型细胞因子产生的抑制,但哮喘者对该药物反应性不如健康者。从而为进一步研究CD4+CD25+T调节细胞与哮喘发病的关系及治疗哮喘药物发挥作用的机制方面提供依据。
[1]van Oosterhout AJ,Motta AC.Th1/Th2 paradigm:not seeing the forest for the trees?[J].Eur Respir J,2005,25(4):591.
[2]Barnes PJ.Theophylline:new perspectives for an old drug[J].Am J Respir Crit Care Med,2003,167(6):813.
[3]中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案)[J].中华结核和呼吸杂志,2008,31(3):177.
[4]Wichlan DC,Roddam PL,Eldridge P,et al.Efficient and reproducible large-scale isolation of human CD4+CD25+regulatory T cells with potent suppressor activity[J].J Immunol Methods,2006,315(1-2):27.
[5]Dao Nguyen X,Robinson DS.Fluticasone propionate increases CD4+CD25+T regulatory cell suppression of allergen-stimulated CD4+CD25-T cells by an IL-10-dependent mechanism[J].J Allergy Clin Immunol,2004,114(2):296.
[6]Kearley J,Robinson DS,Lloyd CM.CD4+CD25+regulatory T cells reverse established allergic airway inflammation and prevent airway remodeling[J].J Allergy Clin Immunol,2008,122(3):617
[7]Ling EM,Smith T,Nguyen XD,et al.Regulation of CD4+CD25+regulatory T-cell suppression of allergen-driven T-cell activation at atopic status and express of allergic diseases[J].Lancet,2004,363(9409):608.
[8]Grindebacke H,Wang K,Andersson AC,et al.Defective suppression of Th2 cytokines by CD4+CD25+regulatory T cells in birch allergics during pollen season[J].J Clin Exp Allergy,2004,34(9):1364.
[9]Shi HZ,Li S,Xie ZF,et al.Regulatory CD4+CD25+T lymphocytes in peripheral blood from patients with atopic asthma[J].Clin Immunol,2004,113(2):172.
[10]Chen X,Murakami T,Oppenheim JJ,et al.Differential response of murine CD4+CD25+and CD4+CD25-T cells to dexamethasone-induced cell death[J].Eur J Immunol,2004,34(3):859.
[11]Jaffar ZH,Sullivan P,Page C,et al.Low-dose theophylline modulates T-lymphocyte activation in allergen-challenged asthmatics[J].Eur Respir J,1996,9(3):456.
[12]Nie HX,Yang J,Hu SP,et al.Effects of theophylline on CD4+T lymphocyte,interleukin-5,and interferon gamma in induced sputum of asthmatic subjects[J].Acta Pharmacol Sin,2002,23(3):267.

