链霉素人工抗原的合成及其多克隆抗体的制备
张桂贤 (临沂师范学院生命科学学院 276005)
链霉素(SM)作为一种重要的氨基糖苷类抗生素,具有性质稳定、抗菌谱广、生产工艺简单、疗效好(尤其是具有强大的抗结核杆菌的作用),因而被广泛的应用于动物疾病的治疗和预防上。但链霉素具有严重的耳毒性和肾毒性,它在动物性食品中的残留已引起国内外的普遍关注[1-2]。目前,我国对于食品中链霉素残留的检测主要采用仪器分析方法,如气相色谱、液相色谱及质谱法等,这些方法虽灵敏度高,但处理过程复杂,且检测费用高,因此不能广泛应用,而免疫学检测法是未来抗生素残留检测的首选方法,而应用单克隆抗体建立的ELISA法可在生产过程中用于大量样本的快速筛选检测[3-4]。所以本试验研究目的在于制备链霉素的多克隆抗体,为链霉素残留的免疫学检测奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂与器材 链霉素(Streptomycin,SM)购自Sigma公司;牛血清白蛋白(BSA)购自中国医药(集团)上海化学试剂公司(批号F030405);卵清蛋白(OVA)购自Sigma公司(批号BP0123)HRP标记羊抗鼠IgG购自北京鼎国生物公司;U-1800型紫外分光光度计由日本日立公司生产;SUNRISE型酶标仪由瑞士TECAN公司生产;96孔可拆式酶标板由浙江省临海市华威分析仪器有限公司生产。
1.1.2 试验动物 SPF级BALB/C纯系小鼠4只,由临沂师范学院实验中心提供。
1.1.3 主要溶液 pH9.6碳酸盐缓冲液: 1.7g Na2CO3,2.8g NaHCO3定容于1000ml 超纯水中,4℃冰箱保存。NaOH试液:取NaOH4.3g,加入双蒸水至100ml。硫酸铁胺试液:取硫酸铁胺0.1g,加入0.5mol/L的硫酸溶液至5ml,使之溶解完全。包被缓冲液(pH 9.6):准确称取NaCO30.85g,NaHCO31.4g,双蒸水定容至500mL,4℃冰箱保存备用。pH7.4 0.01mol/L的PBS:准确称取KH2PO40.2g、KCL 0.1g、Na2HPO4·12H2O 2.9g、NaCl 8.0g,加双蒸水溶解,定容至1000m,4℃冰箱保存。洗涤液:每100ml pH7.4 PBS中加入50µl的Tween-20,摇匀即可,4℃冰箱保存。封闭液(5%脱脂乳):称取5g脱脂奶粉溶于100ml pH7.4PBS中,4℃冰箱保存。抗体稀释液:pH7.40.01mol/L的PBS,4℃冰箱保存备用。底物缓冲液:枸橼酸-磷酸缓冲液(枸橼酸0.51g,1.84g Na2HPO4·12H2O定容于100ml纯水中),4℃冰箱保存。显色液:准确称取OPD(邻苯二胺)5mg,溶于10ml底物缓冲液中,再加入30%H2O 15µl,混匀即可,现配现用。终止液(10%硫酸):量取浓硫酸10ml,逐滴加入到90ml双蒸水中,混匀,室温保存备用。
1.2 方法
1.2.1 人工抗原的制备 制备方法采用直接化学交联法,链霉素可以利用分子中的醛基和蛋白质的氨基直接缩合,反应路线见图1[5]:
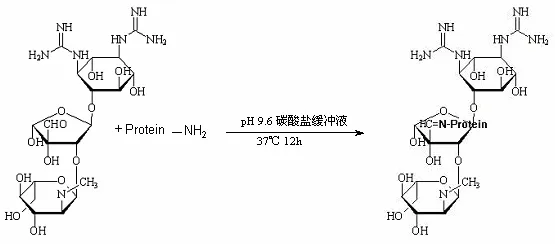
图1 SM与载体蛋白合成路线
具体合成路线:(1)称取BSA 50mg,溶解于6ml的pH为9.6的碳酸盐缓冲液中。(2)称取链霉素 82.5mg 溶解于4ml的pH为9.6的碳酸盐缓冲液中。(3)将上述两种溶液混合,并于37℃ 轻微搅拌反应12h。(4)将反应液收集用pH7.20.01mol/L的磷酸缓冲液透析48h。并收集12h、24h、48h的透析液。(5)将透析后的反应物小量分装-20℃冻存备用。
将卵清蛋白与链霉素的偶联也采用同样方法,将偶联物作为包被原,用于间接ELISA法。
1.2.2 人工抗原的鉴定 (1)显色反应。链霉素在碱性溶液中,分子发生重排,使环扩大形成六元环,然后消除N-甲基葡萄糖胺和链霉胍,生成麦芽酚(α-甲基-β-羧基-γ-吡喃酮),麦芽酚与硫酸铁铵溶液形成紫红色配位化合物[6]。根据链霉素所特有的性质可以通过麦芽酚反应进行鉴别试验,通过对透析后产物进行麦芽酚反应初步鉴定链霉素是否联结成功,同样对透析外液进此反应可以初步鉴定反应物是否透析完全。透析产物最终通过紫外分光光度计来进一步确定是否连接成功,并估算人工抗原的浓度,为下一步实验奠定基础。具体作法:将不同时段收集的透析液分别取1ml,然后加入0.3mL NaOH试液。37℃水浴3min后,加入0.5ml硫酸铁胺试液显色,如果有紫红色,则说明含有链霉素,如果没有则透析干净了。确定透析外液不含链霉素后,则取透析后的反应物1ml,然后加入0.3ml NaOH试液。37℃水浴3min后,冷却至室温后,加入0.5ml硫酸铁胺试液显色,如果有紫红色,则说明含有链霉素,联结成功。(2)紫外扫描。用PBS配制好标准溶液(SM、BSA和OVA)及人工抗原(SMBSA和SM-OVA)溶液,通过紫外分光光度计扫描,比较透析产物的特征峰是否是链霉素和蛋白载体特征峰的叠加,且出现了偏移。透析产物通过紫外分光光度计来初步确定是否交联成功,参考杨利国[7],OD280/OD260<1.5时,蛋白质含量(mg/ml)=(1.45×OD280- 0.74×OD260)×稀释倍数,粗略估算结合蛋白的浓度,以确定小鼠的免疫剂量。
1.2.3 动物免疫 将小鼠编号,并做好标记,取一定量制备成功的免疫原(SM-BSA)与等体积的弗氏完全佐剂乳化,依据估算浓度保证每只BALB/C小鼠的剂量100µg/只,0.2ml/只[8],腹腔注射。第14、35d将弗氏完全佐剂换成弗氏不完全佐剂同法进行加强免役,自二免后的每免7~10d断尾采血,2000rpm离心5min分离得到多抗血清。
1.2.4 多抗血清的检测 对标记小鼠,断尾采血,将包被原1:40稀释,抗血清1:100稀释,二抗采用1:1000稀释,按照表1间接ELISA流程表[9]测定抗血清效价,用P表示测定值,N表示阴性对照值,结果以P/N﹥2.1且P-N﹥0.2为临界判定值。
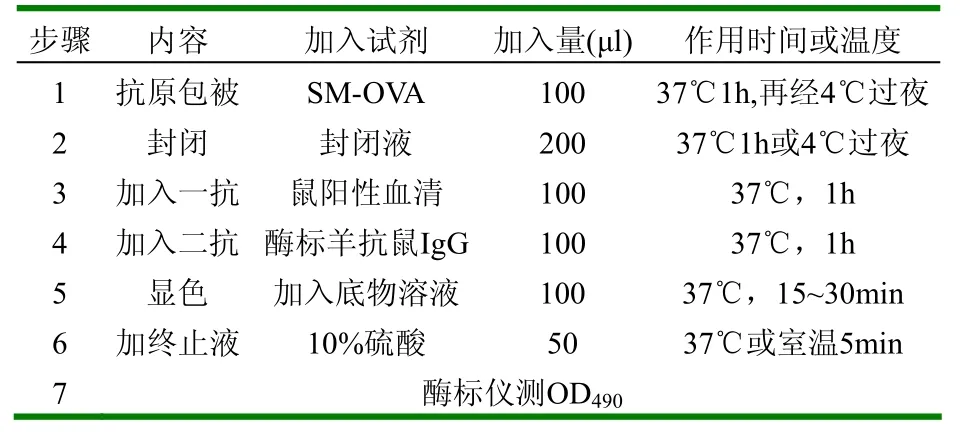
表1 间接ELISA的流程表
1.2.5 多抗血清的特异性分析 参考文献[10]将链霉素用0.01mol/l pH7.4的PBS稀释成一系列浓度(10000、1000、100、10、1、0.1ng/ml),分别取100µl与浓度为1:100的多抗100µl在离心管中混匀,置37℃温箱中孵育30min。分别取100µl加入预先用最适抗原包被浓度包被好的酶标板中,同种浓度的SM作2个重复,其他操作同上表1。B/B0%=OD490实验组/OD490对照组×100%,以链霉素浓度的对数值为横坐标,B/B0%为纵坐标作标准曲线,求出回归方程和IC50(B/B0%=50%)值。抗体特异性试验:将链霉素、庆大霉素、卡那霉素、双氢链霉素、硫酸新霉素配制成系列药物浓度,作竞争抑制实验,求出各自的IC50,根据交叉反应率= IC50链霉素/ IC50试验组药物×100%,求出各自的交叉反应率。
2 结果与分析
2.1 人工抗原的鉴定
2.1.1 显色反应 链霉素麦芽酚显色反应结果表明:12h后的透析外液有颜色反应,24h后的没有颜色反应,则表明透析外液基本不含链霉素,透析基本完全。收集48h后透析产物,经过麦芽酚反应显色(紫红色)明显,这说明透析产物存在且联结在蛋白质上,初步确定链霉素与蛋白质联结成功。
2.1.2 UV鉴定

图2 载体蛋白质和偶联物紫外扫描图
BSA、OVA、SM、SM-BSA和SM-OVA五个样品经紫外分光光度计扫描,结果(见图2)显示SM无明显紫外吸收峰与资料[11]吻合,BSA和OVA分别在278.5nm和279nm波长处有最大吸收峰,SM-BSA和SM-OVA的最大吸收峰分别在278nm和279.5nm波长处。根据UV吸收的合加性原理可知,整合后的特征峰与半抗原和载体没有重合,出现了偏移,说明半抗原SM已分别与载体BSA和OVA交联成功。
扫描SM-BSA,OD(280)值为0.64,OD(260)值为0.44,估算SM-BSA结合蛋白含量为1.65mg/ml;扫描SM-OVA,OD(280)值为0.54,OD(260)为0.33,估算SMOVA结合蛋白含量为0.54mg/ml。
2.2 多抗血清效价测定与特异性分析
对三免后的标记小鼠断尾采血,间接ELISA测定OD值,3只小鼠均出现了阳性结果见表2,效价1:51200。
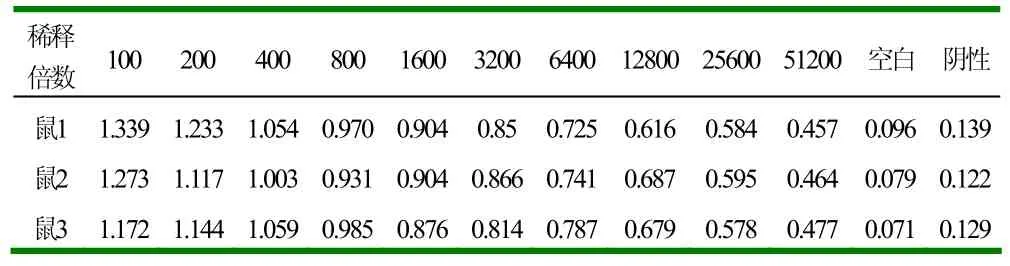
表2 多抗血清OD值
2.3 多抗血清特异性分析

图3 链霉素间接竞争ELISA标准曲线
间接竞争ELISA阻断试验结果见图3,链霉素浓度在1ng/ml~100ng/ml范围内,小鼠多抗抑制曲线呈良好的线性关系,其中鼠3抑制性最好,其抑制曲线回归方程为y=-19.96x+77.42 R2=0.9695,鼠3的IC50为23.62ng/ml,低于鼠2和鼠3。交叉试验结果(见表3)表明链霉素多抗与双氢链霉素交叉达107%,而与同类的其他药物无交叉反应。

表3 间接竞争ELISA的交叉反应实验结果
3 讨论
3.1 人工抗原的合成
链霉素属于不含伯胺基的氨基糖苷类抗生素,可采用两种方法制备免疫原。(1)利用醛基可以采用O-(羧甲基)羟基胺法,将其生成含有带羧基的半抗原衍生物,然后采用碳化二亚胺法,将带有羧基的半抗原与载体蛋白的胺基或者羧基结合[11]。(2)利用链霉素其醛基直接与载体蛋白的胺基缩和[5]。本试验采用了方法(2)。此法试验条件容易控制,且所需试剂常用价廉,抗原的合成易于实现。
3.2 人工抗原的鉴定
链霉素以PBS配制进行UV扫描,由于PBS自身的干扰使SM的紫外吸收峰不明显,但同浓度偶联物与链霉素的紫外吸收峰,并没有重合,说明偶联成功,因链霉素特有的麦芽酚显色试验更充分证明偶联物含有链霉素成分,说明人工抗原制备成功。
3.3 动物免疫
在免疫动物时,笔者曾采用尾静脉对小鼠加强免疫,但免疫效果不好,小鼠会在免疫后出现严重的副反应,分析原因是免疫原直接进入小鼠循环系统,造成不良应激所致,因此建议采用腹腔或背部皮下注射,此法易于操作,对小鼠的应激小,免疫效果较好。
[1]高岩. 链霉素引起前庭神经损坏1例[J]. 医用放射技术杂志, 2005,(5): 75.
[2]王燕, 陶泽璋. 氨基糖苷类抗生素耳毒性的机理及防治措施[J]. 国外医学耳鼻喉科分册, 2005, 29(6): 392-395.
[3]杨智洪, 杜根成, 乔宏兴等. 链霉素残留检测方法的研究进展[J].上海畜牧兽医通讯, 2005, (5): 2-3.
[4]吕青, 朱咏梅, 刘勇等. 食品中链霉素检测方法研究进展[J]. 安徽农业科学, 2009: 37(17): 7850-7851.
[5]何华, 焦庆才. 生物药物分析[M]. 第1版. 北京: 化学工业出版社,2003, 116.
[6]张兰桐. 药物分析[M]. 北京: 中央广播电视大学出版社, 2002, 322.
[7]杨利国, 胡少旭, 魏平华等. 酶免疫测定技术[M]. 南京: 南京大学出版社, 1998, 272.
[8]李志勇. 细胞工程[M]. 北京:科学出版社, 2003:139.
[9]李金明. 临床酶免疫测定技术[M]. 北京: 人民军医出版社. 2005:11-87.
[10]周斌, 石德时, 覃雅丽等. 氯霉素间接竞争ELISA(Ielisa)检测方法的建立[J]. 中国兽医学报, 2002, 22(1): 77-79.
[11]犯国英, 王顺岗, 王自良等. 链霉素人工抗原的合成与制备[J].西北农业学报, 2009, 18(2): 45-5.

