地西泮对5-羟色胺诱导的成年大鼠离体胸主动脉收缩的减弱作用及其机制研究1)
王 微,宋二飞,戚晓静,张轩萍,张明升
地西泮(diazepam,DZP)是苯二氮艹卓类代表性药物,临床上已被普遍应用于镇静催眠、抗焦虑、抗惊厥、抗癫痫,其在产科中的应用也已相当广泛。近年发现,DZP还能有效拮抗中枢神经系统因缺血缺氧和创伤造成的损害。DZP能引起血管平滑肌的松弛[1],较大剂量时可降低血压,减慢心率。5-羟色胺(5-HT)作用于血管平滑肌,主要经由5-HT2A受体介导而引起多数动静脉收缩。5-HT除了能直接调节血管张力,还能增高血管平滑肌对去甲肾上腺素(NE)、血管紧张素Ⅱ(AngⅡ)、组胺等缩血管物质的反应性。当原有动脉粥样硬化病变或高血压、糖尿病使血管内皮损伤时,血小板易黏附在血管壁上,促使5-HT释放增加,加强其缩血管作用,恶化疾病[2]。5-HT受体拮抗剂可治疗相应疾病,当DZP发挥其普遍治疗作用时,是否会对5-HT引起的血管改变产生相应的影响,对这些疾病的治疗有一定的帮助作用?本研究拟通过成年大鼠离体胸主动脉环实验,观察不同浓度的DZP对5-HT诱导的血管收缩产生的效应,并探讨产生这些效应的可能机制。
1 材料与方法
1.1 药品与试剂 地西泮由上海旭东制药有限公司提供(批号071201)。5-HT、乙酰胆碱(Ach)、左旋硝基精氨酸甲酯(L-NAM E)、四乙胺(TEA)、4-氨基吡啶(4-AP)均购自 Sigma公司,氯化钡(BaCl2)由上海中邦化工厂生产,其余试剂为市售分析纯。
1.2 大鼠离体主动脉环标本的制备 SD大鼠,雄性,体重220 g~250 g,由山西医科大学实验动物中心提供。将大鼠直接断头处死,迅速打开胸腔,分离胸主动脉,将取下的胸主动脉放入4℃的PSS液中,仔细剔除血管周围的脂肪及结缔组织,将动脉剪成3 mm~4 mm的血管环。血管环用两根不锈钢微型挂钩贯穿血管管腔,横向悬挂在10 mL浴槽内(浴槽内含有通以100%氧,pH 值为7.4、37℃的PSS液10 mL),下方固定,上方以一细钢丝连于张力换能器,使用Powerlab生物信号采集与分析系统记录血管环的张力变化。每个血管环悬挂在浴槽后,调前负荷至2 g,平衡 1 h,其间调整静息张力,使之维持在 2 g的恒定水平,每15 min换一次营养液。所有血管环用60 mmol/L KCl液刺激3次,待收缩稳定后,开始正式实验,去内皮的实验,用与血管内径相适的棉棒从管腔擦过,连续两次,用60 mmol/L KCl液刺激,待收缩稳定后加 10-5mol/L的Ach检验血管内皮完整性。当Ach不产生舒张作用或舒张幅度小于预收缩的10%时,认为内皮已去除。设定60 mmol/L KCl液引起的最大收缩幅度为100%,以加入不同浓度药物引起的血管收缩幅度与KCl诱导的最大收缩幅度的比率反映血管张力变化。
1.3 大鼠胸主动脉环收缩作用测定 采用内皮完整的胸主动脉环,加入KCl(60 mmol/L)待血管环收缩达到稳定后用PSS液洗脱,使其恢复到稳定静息张力,在静息张力下累积加入5-HT使浴槽中的终浓度依次递增为10-7mol/L,3×10-7mol/L,10-6mol/L,3×10-6mol/L,10-5mol/L,3×10-5mol/L,观察血管环的张力变化,制作5-HT的累积浓度-血管反应曲线。
1.4 溶剂组和DZP组对大鼠胸主动脉环收缩作用的影响 采用内皮完整和去内皮的胸主动脉环,加入KCl(60 mmol/L)待血管环收缩达到稳定后用PSS液洗脱,使其恢复到稳定静息张力,在静息张力下,溶剂组预孵10-4mol/L溶剂,DZP低浓度组预孵3×10-6mol/L的 DZP,高浓度组预孵 10-4mol/L的DZP,均预孵20 min,再分别加入累积浓度的5-HT,观察血管环的张力变化。
1.5 DZP减弱5-HT诱导的血管环收缩作用的机制研究 根据浓度-血管反应曲线,计算静息张力组、溶剂组、DZP低浓度组和高浓度组5-HT对血管收缩作用达50%时所对应的浓度(即EC50值),其接近 3×10-6mol/L。在内皮完整的胸主动脉环上,用KCl(60 mmol/L)诱发血管环收缩达稳定后用 PSS液洗脱,恢复至稳定静息张力后,对照组预孵低浓度DZP后加入3×10-6mol/L的5-HT,观察血管环的张力变化。实验组预孵低浓度DZP后,再分别预孵L-NAME(10-4mol/L),TEA(10-2mol/L),4-AP(10-3mol/L),BaCl2(10-3mol/L),达到稳定收缩坪值后,加入3×10-6mol/L的 5-HT,观察血管环的张力变化。同法,预孵高浓度DZP,观察血管环的张力变化。
2 结 果
2.1 DZP对大鼠胸主动脉环张力的影响 在静息张力状态下,5-HT对大鼠离体胸主动脉环产生浓度依赖性的收缩作用。与静息张力状态下相比,溶剂组 5-HT各浓度收缩作用无明显差异;DZP低浓度组、高浓度组收缩百分率明显降低,5-HT浓度为3×10-7mol/L,10-6mol/L,10-5mol/L,3×10-5mol/L时有统计学意义(P<0.05),浓度为10-7mol/L,3×10-6mol/L时无统计学意义。详见图 1。

图1 DZP对5-HT诱导的浓度依赖性血管环收缩减弱作用
2.2 内皮对DZP减弱5-HT诱导的血管环收缩作用的影响在去内皮的胸主动脉环上,预孵低浓度DZP,再加入浓度递增的5-HT,血管环呈浓度依赖性收缩,与内皮完整组相比,其收缩百分率升高,即内皮减弱了DZP对5-HT诱导的血管收缩的减弱作用。在浓度为 3×10-7mol/L,10-6mol/L,3×10-6mol/L,10-5mol/L,3×10-5mol/L时有统计学意义(P<0.05)。同法,预孵高浓度DZP后,在浓度为 10-6mol/L,3×10-6mol/L,10-5mol/L,3×10-5mol/L时有统计学意义(P<0.05)。详见图2、图3。

图2 低浓度DZP对内皮完整和去内皮血管环的影响

图3 高浓度DZP对内皮完整和去内皮血管环的影响
2.3 L-NAME、TEA 、4-AP、BaCl2对 低浓度DZP减弱5-HT诱导的血管环收缩作用的影响 在内皮完整的胸主动脉环上,对照组血管环出现一个峰值收缩,实验组预孵阻断药L-NAME、T EA、4-AP、BaCl2后减弱了 DZP减弱 5-HT诱导的血管环收缩的作用,表现为收缩峰值的升高(P<0.05)。详见图4。
2.4 L-NAME、TEA、4-AP、BaCl2对高浓度DZP减弱 5-HT 诱导的血管环收缩作用的影响 在内皮完整的胸主动脉环上,对照组血管环几乎无收缩反应,实验组预孵阻断药L-NAME、BaCl2后减弱了DZP对血管环的收缩抑制作用,出现收缩反应,且有统计学意义(P<0.05);而实验组预孵 TEA、4-AP后对血管环作用无统计学意义(P>0.05)。详见图4。
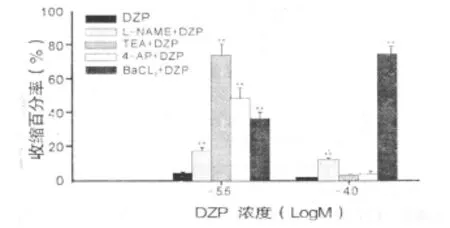
图4 阻断剂对低浓度、高浓度DZP减弱血管环收缩作用的影响
3 讨 论
地西泮能降低人体动脉血压[3],在离体胸主动脉环上,能松弛和抑制氯化钾、氯化钙、去甲肾上腺素、去氧肾上腺素引起的浓度依赖性的血管收缩,对血管平滑肌具有松弛作用[4,5]。
5-羟色胺为内源性的血管活性因子,是中枢神经系统重要的神经递质,同时又是重要的血管调节物质。5-HT受体包括七个类型(5-HT1-5-HT7)[6]。目前,已知分布于大血管平滑肌上的5-HT受体主要为5-HT2A亚型,5-HT主要通过血管平滑肌的5-HT2A受体引起血管收缩。受体激动时,经G蛋白的耦联作用激活磷脂酶C(PLC),PLC促进二磷酸磷脂酰肌醇水解产生三磷酸肌醇(IP3)和二酰甘油(DG)。IP3最初促使细胞内Ca2+贮存库释放Ca2+进入胞浆,随后由Ca2+的释放诱发较长的细胞外Ca2+内流。Ca2+与细胞内的钙调蛋白结合形成复合物,复合物可结合于肌球蛋白轻链激酶并使之活化,导致肌球蛋白轻链磷酸化和平滑肌收缩;DG在Ca2+存在下可激活蛋白激酶C(PKC),使蛋白质或酶发生磷酸化,从而引起血管收缩[7,8]。本实验中,DZP使5-HT诱导的血管环的收缩作用减弱,提示DZP可能通过IP3-Ca2+信号通路和DG-PKC信号通路,阻滞内钙释放和外钙内流,减弱了5-HT对血管的收缩效应。
血管平滑肌的舒缩功能可通过内皮释放的血管活性物质来进行调控,其中一氧化氮(NO)和前列环素(PGI2)是典型的内皮释放的血管活性物质,能产生强大的舒血管作用[9]。NO能刺激可溶性鸟苷酸环化酶,从而引起血管平滑肌环磷酸鸟苷(cGMP)水平的增加,后者主要通过cGMP依赖性蛋白激酶使钙内流减少,增加钙ATP酶对钙的摄取或直接作用于收缩蛋白去磷酸化而使血管舒张[10]。本实验中,经DZP预处理,去内皮的血管环引起血管收缩幅度的减弱明显弱于内皮完整的血管环。在内皮完整的血管环上,L-NAME预处理后,减弱了DZP对血管环收缩作用的减弱,使收缩增强,提示DZP对5-HT诱导的血管环收缩作用的减弱可能与内皮有关,可能有NO途径的参与。
K+通道活性的改变可使动脉平滑肌细胞膜电位去极化或超极化,是参与动脉血管舒缩调节的重要机制[11,12]。当这些K+通道的活性受抑制时,可使细胞膜去极化,从而使电压依赖性钙通道开放,细胞外钙内流,细胞收缩而导致血管张力增加;相反其被活化时,可使细胞舒张而导致血管张力降低。本实验分别用TEA、4-AP、BaCl2阻断钾通道,低浓度DZP减弱了其对血管环收缩作用的减弱,使收缩增强,提示低浓度DZP对5-HT诱导的血管环收缩作用的减弱可能有KCa、KV、KIR通道的参与。高浓度DZP则只对BaCl2有作用,提示高浓度DZP对5-HT诱导的血管环收缩作用的减弱可能只有KIR通道的参与。
DZP对5-HT诱导的成年大鼠离体胸主动脉环收缩具有减弱作用,其机制可能是通过IP3-Ca2+信号通路、DG-PKC信号通路或通过内皮源性舒血管物质或钾离子通道使内流入血管平滑肌细胞的Ca2+减少而发挥作用。5-HT对血管、血压的影响还与5-HT1R有关,DZP对和其相关的疾病及病变是否起到一定的治疗作用,还有待进一步研究。
[1]French JF,Rapopo rt RM,Matlib MA.Possible mechanism of benzodiazepine-induced relax ation of vascular smooth muscle[J].Cardiovasc Pharmacol,1989,14(3):405-411.
[2]陈修,陈维渊,曾贵云.心血管药理学[M].北京:人民卫生出版社,2001:202-204.
[3]Samuelson PN,Reves JG,Kouchoukos N T,et al.Hemody namic responses to anesthetic induction with midazolam or diazepam in patients with ischemic heart disease[J].Anesth Analg,1981,60:802-809.
[4]Ishii K,Kano T,Ando J.Pharmacological effects of flurazepam and diazepam on isolated canine arteries[J].JPN J Pharmacol,1983,33(1):65-71.
[5]Park SE,Sohn JT,Kim C,et al.Diazepam attenuates phenylephrine-induced contractions in rat aorta[J].Anesth Analg,2006,102(3):682-689.
[6]Hoyer D,Hannon JP,Martin GR,et al.M olecular,pharmacological and functional diversity of 5-HT recepto rs[J].Pharmacol Biochem Behav,2002,71(4):533-554.
[7]姚泰,乔健天.生理学[M].第5版.北京:人民卫生出版社,2003:370-374.
[8]姚泰,曹济民,樊小力,等.生理学[M].第 1版.北京:人民卫生出版社,2005:34-46.
[9]Tanaka Y,Koike K,Toro L.MaxiK channel roles in blood vessel relaxations induced by endothelium-derived relaxing factors and their molecular mechanisms[J].J Smooth Muscle Res,2004,40(4-5):125-153.
[10]Vaandrager AB,de Jonge HR.Signalling by cGMP-dependent protein kinases[J].Mol Cell Biochem,1996,157(1-2):23-30.
[11]Nelson MT,Quayle JM.Phy siological roles and properties of potassium channels in arterial smooth muscle[J].Am J Physio-Cell Physiology,1995,268(4):799-822.
[12]Jackson WF.Ion channels and vascular tone[J].Hypertension,2000,35(1):173-178.

