pAAV-PEG3-sTRAIL质粒的构建及表达研究*
蒋祥龙,彭 炬,潘 艺,卢光琇
(中南大学生殖与干细胞工程研究所,人类干细胞国家工程研究中心,湖南 长沙 410078)
恶性肿瘤是一类严重危害人类生命健康的常见病,在肿瘤的临床治疗过程中,对各种已确诊的肿瘤患者,所采取的主要治疗手段是单独或联合运用肿瘤外科手术切除,激素治疗、放疗、化疗。总的说来,用传统的方法治疗原发性的、未转移的肿瘤都取得了一定的疗效。虽然传统的治疗在临床上是有效的,但是当肿瘤发展到恶性浸润和转移状态时,将对传统的治疗药物产生耐受性并易复发,而加大治疗药物的剂量又将杀死大量的正常细胞,最终导致肿瘤患者的死亡。由于传统的治疗方法的局限性,肿瘤的基因治疗越来越引起了人们的注意。研究表明,肿瘤干细胞是恶性肿瘤转移及扩散的根源[1,2]。多潜能的人恶性畸胎瘤细胞NTERA-2来源于睾丸畸胎瘤,具有类似人胚胎干细胞的特点,体外培养具有自我更新及诱导分化为三个胚层的能力,被认为是人胚胎干细胞的恶性对照物以及研究肿瘤干细胞理想的模型[3]。
肿瘤坏死因子相关凋亡诱导配体(Tumor Necrosis Factor-related Apoptosis-Inducing Ligand TRAIL/ApoL)是肿瘤坏死因子家族一个典型的Ⅱ型膜蛋白[4],具有引起大多数肿瘤细胞凋亡,而对正常组织细胞无细胞毒的特性。TRAIL/ApoL的膜外部分即可溶性TRAIL(sTRAIL氨基酸序列114-281)[5],在血液中以同源三聚体的形式存在[6,7],是引起肿瘤细胞凋亡的功能片段。
大鼠 progression-elevated gene-3(PEG3)基因的启动子是已被鉴定的、在癌症细胞中特异性高表达的启动子。萤光素双报告基因系统研究表明,PEG3启动子在大多数肿瘤细胞系中活性高,而在正常组织的细胞中活性低或检测不到活性,因此,PEG3启动子可能是肿瘤基因治疗的理想启动子,在肿瘤的基因治疗中,可能特异地在肿瘤细胞中启动抑癌基因的表达。
然而,在用PEG3启动子来启动sTRAIL基因时,能否引起NTERA-2凋亡并对人正常细胞如胚胎成纤维细胞(hSF)及胚胎干细胞(hESC)无细胞毒作用,还有待实验证明。本文用PEG3启动子和sTRAIL基因构建了pAAV-PEG3-sTRAIL质粒,为进一步的研究打下了基础。
1 材料与方法
1.1 细胞与细胞培养
hSF和NTERA-2细胞贴壁生长于含12%FBS的DMEM/F12培养液的细胞培养瓶中,每2~3 d传代1次,细胞培养于37℃、5%二氧化碳培养箱中。人胚胎干细胞由人类干细胞国家工程研究中心提供。
1.2 质粒和试剂
大肠杆菌DH5α和腺相关病毒载体pAAV为本实验室保存;RevertAid First Strand cDNA Synthesis Kit购自Fermentas公司;FUGENE HD转染试剂购自 Roche 公司;kpnI、BamHI、HindⅢ限制性内切酶、T4 DNA连接酶和质粒抽提试剂盒购自宝生物公司;Annexin-Ⅴ-FITC早期凋亡检测试剂盒购自Bender MedSysteme公司;DMEM高糖培养液和胎牛血清购自Gibco Invitrogen公司。
1.3 PCR引物的合成
由上海生工公司合成。
PEG3启动子引物:上游引物为5'-GGTACCTGTTGTTTTCCTCTCTCCACCT?-3',下游:引物为5'-GTCGACGGTTCGGTTTGCCAAAAG?-3'。sTRAIL基因引物:上游引物为5'-GGATCCATGGTGAGAGAAAGAGGTCCTCAG-3',下游引物为5'-AAGCTT TTAGCCAACTAAAAAGGCCCCGA-3'。在sTRAIL基因的两端加上BamHI和HindⅢ酶切位点。
1.4 大鼠基因组DNA的提取及PEG3启动子的扩增
用锋利的眼科手术剪,呈45度角剪取大鼠尾部约1 cm长,放入Eppendorf管中,于55℃水溶中,用500μL STE溶液,含有(5μL 10 mg/mL蛋白酶K)中消化过夜,再按常规DNA提取方法抽取基因组DNA(gDNA),溶于TE缓冲液后,用紫外分光光度计测定浓度,4℃保存。PEG3启动子扩增条件如下:95℃预变性2 min后,94℃变性30 s,63℃退火30 s,72℃延伸 30 s,完成 35 个循环。72℃ 5 min,置4℃保温。
1.5 sTRAIL基因的扩增
将常规方法提取的细胞总RNA溶于无RNAse的水中,1%琼脂糖凝胶电泳检测RNA的完整性,紫外分光光度计测定A260/A280的比值应在1.8~2.0之间。取总RNA 2μg,按说明书将其逆转录得到cDNA。sTRAIL基因的扩增条件如下:95℃预变性2 min 后,94℃变性 30 s,60℃退火 30 s,72℃延伸 30 s,完成35个循环,72℃ 5 min,置4℃保温。
1.6 pAAV-PEG3-sTRAIL质粒的构建
将PEG3启动子和sTRAIL基因的PCR扩增产物连接到pMD18-T载体上,以此构建T-PEG3和T-sTRAIL质粒,测序以保证PEG3启动子和sTRAIL基因序列正确。先以kpnI和BamHI双酶切pAAV载体和T-PEG3质粒,然后,将T载体上已测序正确的PEG3启动子克隆到pAAV载体中替代CAG启动子,得到pAAV-PEG3空载体。然后,以BamHI和HindⅢ双酶切pAAV-PEG3和T-sTRAIL质粒,利用设计的BamHI和HindⅢ位点,将sTRAIL基因连接入pAAV-PEG3后,得到pAAV-PEG3-sTRAIL质粒。
1.7 pAAV-PEG3-sTRAIL质粒的传染
转染前的准备:细胞培养在100 mm的细胞培养皿中,待细胞长満后传代至六孔板中。当细胞长到约80%融合度时,开始进行质粒转染。每个孔转染2μg pAAV-PEG3-sTRAIL质粒。
转染:2μg pAAV-PEG3-sTRAIL质粒稀释到100μL不含血清和抗菌素的DMEM中,轻轻混匀;6μL FEGENE HD稀释于100μL不含血清和抗菌素的DMEM中,轻轻混匀;将100μL FEGENE HD稀释液滴加到pAAV-PEG3-sTRAIL质粒稀释液中,一边滴加一边混匀。室温孵育15~20 min;然后,将此 200μL FEGENE HD/pAAV-PEG3-sTRAI混合物加到每孔中,轻轻摇动使混合均匀;放置于37℃,5%二氧化碳培养箱中孵育24~48 h后,分析转染目的基因的表达情况。
1.8 细胞早期凋亡的检测
hSF、hES和 NTERA-2细胞转染质粒pAAV-PEG3-sTRAIL或空载体pAAV-PEG348 h,0.5%胰酶消化,消化的细胞用1×PBS洗2次,再取PBS清洗过的5×105细胞1000 rpm离心5 min,去上清;加入400μL 1×结合缓冲液,混匀,取195μL于另一个Eppendorf管中,加入5 mL rh Annexin V/FITC抗体,室温避光静置 10 min;500μL l×结合缓冲液洗2次,1000 r/min离心5 min;去上清,加入190μL结合缓冲液,再加入10 μL PI,室温避光静置10 min后,FACS检测(4℃条件下可保存24 h)。
2 结果
2.1 PEG3启动子和sTRAIL基因的扩增
电泳结果表明,本文成功地获得了长度为301bp的PEG3启动子 DNA和长度为 519bp的sTRAIL DNA,其电泳条带与预测的PEG3启动子(图1)及sTRAIL基因(图2)大小相符。为了进一步检测所扩增的电泳条带是否为所需要的目的产物,将目的电泳条带进行胶回收,并在插入T载体后进行测序分析。结果证明无突变存在,接头正确。
2.2 pAAV-PEG3-sTRAIL质粒的酶切鉴定

图1 PEG3启动子的扩增结果
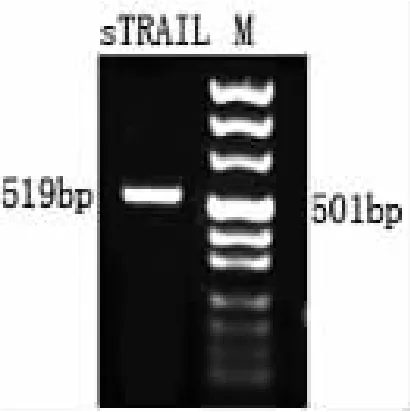
图2 sTRAIL基因的扩增结果
将构建好的pAAV-PEG3-sTRAIL质粒转化扩增及质粒抽提后,以 kpnI、BamHI或 BamHI、HindⅢ进行双酶切,酶切产物用琼脂糖凝胶电泳进行鉴定。结果显示,有长度为301bp或519bp的特异性电泳条带(图3),符合PEG3启动子及sTRAIL基因的分子量大小。
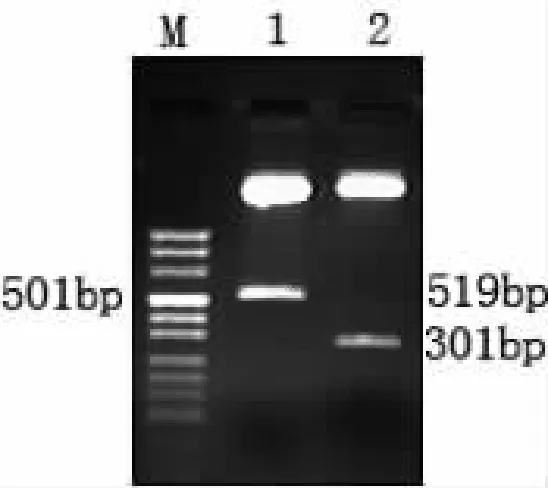
图3 pAAV-PEG3-sTRAIL质粒酶切鉴定结果
2.3 sTRAIL114-281的表达
hSF、hES和 NTERA-2细胞瞬时转染AAV-PEG3-sTRAIL质粒后,其sTRAIL的表达比转染pAAV-PEG3空载体有明显的上升,结果见图4。此结果从分子水平证明,NTERA-2细胞的凋亡是sTRAIL高表达所引起的。
2.4 细胞早期凋亡的检测
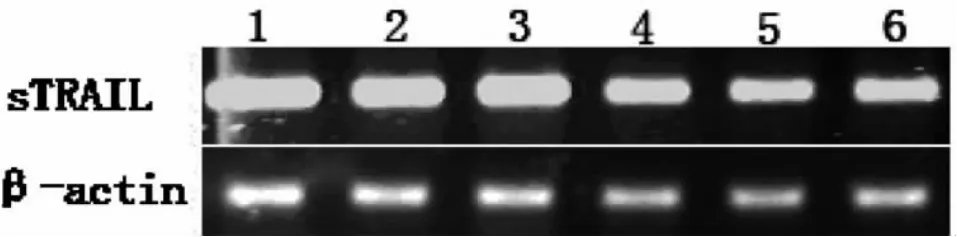
图4 sTRAIL114-281基因半定量PCR检测结果
为了检测sTRAIL基因在PEG3启动子作用下是否能引起hSF、hES和NTERA-2细胞凋亡,本文用pAAV-PEG3-sTRAIL质粒瞬时转染hSF、hES和NTERA-2细胞,同时设立pAAV-PEG3空载体转染对照组。瞬时转染48 h后,用rh Annexin V/FITC早期凋亡检测试剂盒对转染组及对照组hSF、hES及NTERA-2细胞进行早期凋亡检测。结果表明,转染组hSF、hES及NTERA-2细胞早期凋亡率分别为(4.3±1.5)%、(2.3±1.2)%及(24.4±2.1)%,对照组hSF,hES、及 NTERA-2细胞早期凋亡率分别为(3.9%±1.3)%、(1.8%±0.9)%及(1.9%±1.2)%,结果见图5。流式细胞仪检测结果表明,sTRAIL基因在PEG3启动子启动下,能引起NTERA-2细胞凋亡,具有体外抑制NTERA-2细胞生长的能力,而对hES和hSF无细胞毒作用。
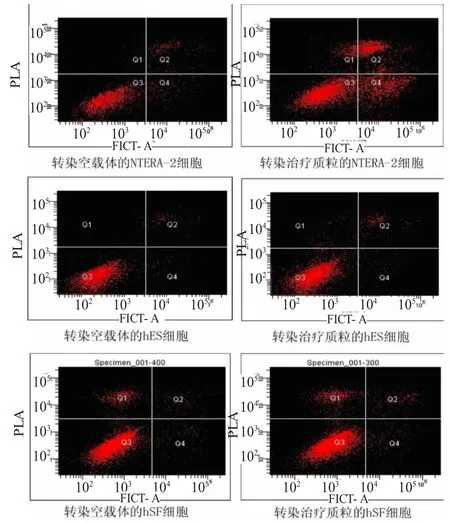
图5 hSF、hES和NTERA-2细胞早期凋亡的流式细胞仪检测
3 讨论
在肿瘤的基因治疗过程中,非肿瘤细胞特异性的转基因表达,在杀死肿瘤细胞的同时,也将杀死大量正常组织的细胞[8]。如能使促进细胞凋亡的基因在肿瘤细胞中特异性的高表达,对于发展有效的肿瘤基因治疗至关重要。为解决肿瘤基因治疗中的细胞靶向性问题,人们把目光投向了组织特异性表达的启动子,希望肿瘤细胞特异性表达的启动子,能在肿瘤细胞中启动抑癌基因高表达,即可杀死肿瘤细胞,而对正常的组织又无细胞毒作用。SU等[9]证实,联合运用PEG3启动子和白介素-24能确保有效地、选择性地杀伤肿瘤细胞,而正常组织细胞没有发现可检测到的细胞毒作用。SARKAR等[10]研究表明,用PEG3启动子启动白介素-24的表达,能明显的抑制乳腺癌细胞和Du-145-Bcl-x(L)细胞的生长,并对原发性肿瘤和转移性肿瘤具有很强的抑制作用,部分荷瘤小鼠甚至得到根治。因此,选择PEG3作为启动sTRAIL基因表达的启动子,将有助于sTRAIL基因在肿瘤细胞中高表达,并通过选择性地杀伤肿瘤细胞,达到抑瘤的目的。
在sTRAIL进行的肿瘤基因治疗中,人们首要考虑的问题就是sTRAIL的安全性。研究表明,sTRAIL能通过激活其死亡受体DR4和DR5引起大部分的肿瘤细胞凋亡,而对正常组织的细胞并无损伤[11-13]。近来研究证实,连续使用重组的、具有生物学活性的sTRAIL,在体外能诱导肿瘤细胞凋亡。动物试验证明,sTRAIL在体内能抑制肿瘤生长,改善荷瘤小鼠的生存状态,延长实验小鼠的生存期[11-14]。更为重要的是,sTRAIL与放线菌素D、顺铂、喜树碱等放疗或化疗药物联合使用,能增强sTRAIL对肿瘤细胞的杀伤作用,并能使对sTRAIL耐受的肿瘤细胞发生凋亡,抑制恶性转移性肿瘤的发展[15]。sTRAIL正是因为在基因治疗中的安全性和有效性,而被认为是最有希望的抗肿瘤分子武器。
在本研究中,我们构建了pAAV-PEG3-sTRAIL质粒并转染hSF、hES和NTERA-2细胞,并运用半定量PCR和流式细胞仪进行sTRAIL基因的表达和细胞早期凋亡分析。结果表明,sTRAIL基因在PEG3启动子启动下,能选择性地杀死具有肿瘤干细胞特性的NTERA-2细胞,而对正常组织细胞及干细胞无细胞毒作用,这将为肿瘤的基因治疗甚至肿瘤干细胞的基因治疗提供新的思路。
[1]TO DARO M,PEREZALEA M,SCOPELLITIA,etal.IL-4-mediated drug resistancein colon in cancer stem cells[J].Cell Cycle,2008,7(3):309-313.
[2]ERAMO A,LOTTI F,SETTE G,et al.Identification andexpansion of the tumorigenic lung cancer stem cell population[J]. Cell Death Differ,2008,15(3):504-514.
[3]PAL R,RAVINDRAN G.Assessment of pluripotency and multilineage differentiation potential of NTERA-2 cells as a model for studying human embryonic stem cells[J].Cell Prolif,2006,39(6):585-598.
[4]WILEY SR,SCHOOLEY K.Death recepters as targets of cancer and characterization of a new member of the TNF family that induces apoptosis[J].Immunity,1995;3:673-82.
[5]SCHNEIDER P,TSCHOPP J.Apoptosis induced by death receptors[J].Pharm Acta Helv,2000;74:281-286.
[6]MARIANI SM,MATIBA B,ARMANDOLA EA,et al.Interleukin 1 beta-converting enzyme related proteases/caspases are involved in TRAIL-induced apoptosis of myeloma and leukemia cells[J].J Cell Biol,1997,137:221-229.
[7]ASHKENAZI A,PAI RC,FONG S,et al.Safety and antitumor activity of recombinant soluble Apo2 ligand[J].J Clin Invest,1999,104:155-162.
[8]SUN WJ,ZHANG YD.Progress of gene therapy for pancreatic carcinoma.China Journal of Modern Medicine,2006,16(15):2314-2318.Chinese
[9]SU ZZ,SARKAR D,EMDAD L,et al.Targeting gene expression selectively in cancer cells by using the progression-elevated gene-3 promoter[J].Proc Natl Acad Sci,2005,25:1059-1064.
[10]SARKAR D,LEBEDEVA IV,SU ZZ,et al. Eradication of therapy-resistant human prostate tumors using a cancer terminator virus[J].Cancer Res,2007,67:5434-5442.
[11]ASHKENAZI A,PAI RC,FONG S,et al.Safety and antitumor activity of recombinant soluble Apo2 ligand[J].J Clin Invest,1999,104:155-162.
[12]WALCZAK H,MILLER RE,ARIAIL K,et al.Activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo[J].Nat Med,1999,5:157-163.
[13]CHINNAIYAN AM,PRASAD U,SHANKAR S,et al.Combined effect of tumor necrosis factor-related apoptosis-inducing ligand and ionizing radiation in breast cancer therapy[J].Proc Natl A-cad Sci,2000,97:1754-1759.
[14]ROTH W,ISENMANN S,NAUMANN U,et al.Locoregional Apo2L/TRAIL eradicates intracranial human malignant glioma xenografts in athymic mice in the absence of neurotoxicity[J].Biochem Biophys Res Commun,1999,265:479-483.
[15]ISHII M,IWAI M,HARADA Y,et al.Soluble TRAIL gene and actinomycin D synergistically suppressed multiple metastasis of TRAIL-resistant colon cancer in the liver[J].Cancer Letters,2006,1:1-10.

