青藤碱对糖尿病大鼠脑缺血再灌注损伤后 Bcl-2和 caspase-3表达的影响
吴 岚 周素娴 刘开祥 俸军林 李清华
(桂林医学院附属医院,广西 桂林 541001)
在糖尿病高血糖情况下,缺血性脑损伤加重可能与乳酸堆积、兴奋性氨基酸、自由基、Ca2+超负荷及细胞凋亡等有密切关系。青藤碱(Sin)是从中药青风藤中提取的生物碱单体。它具有抗炎、免疫抑制、镇痛、降压、抗心律失常等药理作用。前期研究证实,青藤碱对正常血糖大鼠缺血再灌注脑损伤有保护作用〔1〕,但机制未明。本实验通过建立糖尿病大鼠局灶性脑缺血再灌注模型,研究Sin对其 Bcl-2和 caspase-3蛋白表达的影响,探讨其保护作用的可能分子生物学机制。
1 材料与方法
1.1 糖尿病大鼠模型建立及实验动物分组 健康 Wistar大鼠,雄性,清洁级,共 50只,体质量(250±30)g(广西医科大学动物实验中心提供)。大鼠喂饲高脂饲料(1%胆固醇,10%猪油,0.2%丙硫氧嘧啶,89%基础饲料〔2〕)。 4 w后,单次空腹腹腔注射 30mg/kg链脲佐菌素(购于 Sigma公司),继续高糖高脂饲料喂养,于注射后 1、2个月测定体重和血糖〔3〕。选择非空腹血糖 16.7~25.6 mmol/L的大鼠作为造模成功的糖尿病大鼠。经检测模型成功大鼠共 45只,将其中 40只大鼠按随机分组原则分为假手术组(10只)、缺血再灌注组(10只)、Sin低剂量治疗组(10只)及 Sin高剂量治疗组(10只)。
1.2 方法
1.2.1 给药方法 Sin低剂量治疗组(30 mg/kg)和高剂量治疗组(60mg/kg)均于术前30 min分别给予大鼠腹腔注射,假手术组和缺血再灌注组给予等量的生理盐水腹腔注射。缺血再灌注组和 Sin低、高剂量治疗组建立脑缺血 90 min再灌注 24 h动物模型。
1.2.2 脑缺血再灌注损伤模型的建立 参照 Longa等〔4〕方法制备大鼠局灶性脑缺血再灌注模型。神经功能缺陷评分:各组分别在再灌注 24h进行评分。0分:正常,无神经学征象;1分:动物不能完全伸展右前肢;2分:动物右侧肢体瘫痪,行走时向右侧转圈,出现追尾现象;3分:动物行走向右侧跌倒,或动物不能站立或动物打滚;4分:无自发活动,有意识障碍。神经功能缺陷评分在 1~3分为模型成功。
1.2.3 Bcl-2和 caspase-3表达的免疫组化染色 再灌注24h,各组随机取 5只大鼠,用生理盐水和多聚甲醛进行心脏灌流固定,断头取脑。在左侧大脑半球距离嗅球尖端 7~11 mm之间冠状切取约 5 mm厚脑组织块,固定、脱水、包埋成腊块,连续切片,厚 5μm。连取 5张,1张作 HE染色,观察病理形态学改变。其余 4张作免疫组化染色。用SP法进行Bcl-2和 caspase-3蛋白的免疫组化染色。一抗由北京中山生物技术有限公司提供。阴性对照片用 PBS液代替一抗。在细胞质内出现棕黄染色颗粒代表 Bcl-2和caspase-3蛋白阳性表达细胞。于每个鼠脑取 1张切片,每张切片分别随机选取左侧大脑半球额顶部皮质 5个不重复高倍镜视野(×400),计数每个视野阳性细胞数,算出平均数即为每张切片阳性细胞数。
1.2.4 TTC染色 再灌注 24 h,将各组另外 5只大鼠深麻后开颅取脑。将鼠脑置于 -4℃冰箱 20 min后,将其切成 5等份冠状位切片,置于 2%TTC溶液中,水浴、多聚甲醛液固定。用计算机病理图像分析仪及梯形法计算出梗死灶体积,各脑片梗死灶体积之和即为梗死体积。左侧大脑半球梗死灶区呈白色,主要为额顶部皮质和尾壳核,正常组织呈红色。部分组织表现为由白色向红色过渡区。
1.3 统计学方法 数据处理采用 SPSS11.5统计软件进行分析,结果以 x±s表示,组间差异显著性检验采用方差分析。
2 结 果
2.1 各组Bcl-2表达的比较 假手术组可见 Bcl-2呈少量表达。缺血再灌注组 Bcl-2阳性细胞表达增多,部位主要分布于缺血周边区的额顶皮质,与假手术组比较,差异有统计学意义(P<0.05),见图 1。与缺血再灌注组比较,Sin高、低剂量治疗组的 Bcl-2阳性细胞均明显增加(P<0.05),高、低剂量组之间差异亦具有显著性(P<0.05),见表 1。
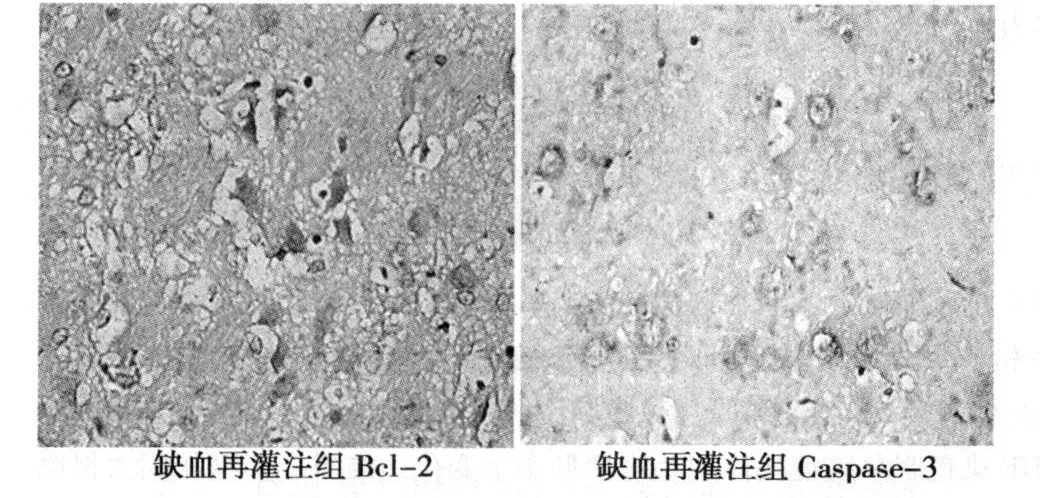
图1 Bcl-2和 caspase-3的免疫组化图(SP,×400)
2.2 各组 caspase-3蛋白表达的比较 假手术组 caspase-3呈少量表达。缺血再灌注组caspase-3阳性细胞表达增多,部位主要分布于缺血周边区额顶皮质和海马组织,与假手术组比较,差异有统计学意义(P<0.05),见图 1。与缺血再灌注组比较,Sin高、低剂量治疗组的caspase-3阳性细胞明显减少(P<0.05),高、低剂量组之间差异亦具有显著性(P<0.05),见表 1。

表1 各组 Bcl-2、caspase-3表达和脑梗死体积的比较(x±s,n=5)
2.3 各组脑梗死体积的比较 大鼠脑缺血再灌注 24 h TTC染色:TTC染色后,缺血再灌注 24 h左侧大脑半球梗死灶区呈白色,主要为额顶部皮质和尾壳核,正常组织呈红色。部分组织表现为由白色向红色过渡区。Sin高、低剂量治疗组梗死体积较缺血再灌注组减小(均 P<0.05),高、低剂量组之间差异亦具有显著性(P<0.05),见图 2。
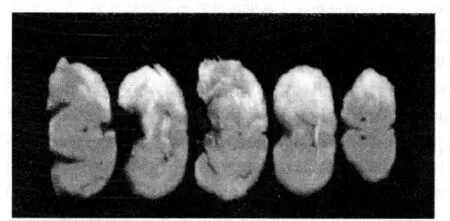
图2 缺血再灌注损伤脑梗死TTC染色
2.4 各组缺血侧脑组织病理学改变的比较 假手术组脑组织切片可见神经细胞、胶质细胞及毛细血管形态正常,结构完整,锥体细胞核大而圆,核仁明显。缺血再灌注组呈缺血改变,梗死区正常组织结构消失,结构不清,间质水肿,有炎细胞浸润;锥体细胞体积缩小,细胞核固缩深染,胞浆嗜伊红。部分细胞坏死,并可见呈筛状坏死的坏死灶。Sin不同剂量治疗组脑组织缺血改变较缺血再灌注组明显减轻,坏死范围缩小,细胞结构较完整,细胞核固缩减少,细胞间质水肿轻,高剂量组与低剂量组之间比较,缺血改变更轻。
3 讨 论
研究发现 Sin可治疗正常血糖的脑缺血再灌注大鼠,显示青藤碱对缺血再灌注脑损伤有保护作用〔1〕。但具体机制尚不清楚。本实验结果也表明,糖尿病大鼠脑缺血再灌注损伤给予不同剂量的 Sin治疗,可明显减少脑梗死体积,减轻缺血造成的病理损害,并且高剂量Sin的脑保护效果更显著。
在脑缺血急性期,神经元坏死与凋亡并存,细胞坏死位于缺血中心区,细胞凋亡主要出现在缺血半暗带。Bcl-2基因是一种癌基因,它所编码的膜相关蛋白是一种强有力的细胞死亡抑制因子,它在调节神经元凋亡过程中发挥着抑制凋亡的关键作用。目前认为 Bcl-2是与脑缺血神经元凋亡关系最密切的内源性凋亡抑制基因〔5〕。 Lawrence等〔6〕在过度表达 Bcl-2基因的转基因小鼠中发现,Bcl-2蛋白能减轻大脑中动脉阻塞引起的缺血性脑损伤,使脑梗死体积缩小。本实验结果显示,Bcl-2蛋白在糖尿病大鼠假手术组脑组织中几乎没有表达,但在缺血再灌注后,Bcl-2则出现了表达,主要出现在缺血半暗带的额顶皮质,我们推测这是机体对抗凋亡的一种反应。而Sin治疗组大鼠脑组织中 Bcl-2蛋白的表达明显高于缺血再灌注组,表明Sin可能通过上调 Bcl-2蛋白的表达从而对缺血再灌注脑损伤起到一定的保护作用。
天冬氨酸特异的半胱氨酸蛋白激酶家族(caspases)是细胞凋亡过程中最重要的蛋白酶,凋亡的最后实施是通过 caspases的激活而实现的。caspases的激活表现为“瀑布式”的级联反应,而 caspase-3是 caspases级联反应中下行的最关键的凋亡执行蛋白酶,在各种程序启动的凋亡程序中起最后枢纽的作用〔7〕,它的激活可通过裂解 DNA依赖性蛋白激酶等,改变其结构,促使细胞凋亡〔8〕。有研究发现〔9,10〕在缺血性神经损伤过程中,抑制caspase-3活性可产生明显的神经保护作用。本研究表明,Sin通过降低 caspase-3的表达与活化,可减少再灌注期神经元凋亡的发生,从而促进脑缺血后神经元的存活。
本实验研究表明,Sin增加缺血再灌注后Bcl-2蛋白表达同时抑制 caspase-3蛋白表达,对凋亡有抑制作用。近年有研究表明〔11〕,缺血半影区 Bc1-2过度表达可以抑制 caspase-3的活性,关于 Sin是否通过对 Bc1-2的激活抑制 caspase-3蛋白表达发挥脑保护作用机制我们还将做进一步探讨。
1 吴 岚,刘开祥,俸军林,等.青藤碱对鼠脑缺血再灌注损伤环氧化酶-2表达及前列腺素 E2含量的影响〔J〕.中国康复医学杂志,2009;24(4):293-6.
2 李仪奎,王钦茂 .中药药理实验方法学〔M〕.上海:科学技术出版社,1991:398.
3 李爱卿,王志慧,赵跃斌 .高糖高脂饲料诱导 2型糖尿病大鼠模型〔J〕.临床医药实践杂志,2005;14(2):2-3.
4 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occusion without cranietomy in rats〔J〕.Stroke,1989;20(1):84-91.
5 GrahamSH,ChenJ,Clark RS.Bcl-2 family gene products in cerebral ischemia and traumatic brain injury〔J〕.J Neurotrauma,2000;17:831-41.
6 Lawrence MS,Ho DY,Sun GH,et al.Over expression bcl-2 with Herpes simplex virus vectors protects CNSneurons against neurological insults in vitro and vivo〔J〕.JNeuroscience,1996;6(2):394-6.
7 Faubel S,Edelstein CL.Caspases as drug targetsin ischemic organ injury〔J〕.Curr Drug Targets Immune Endocr Metabol Disord,2005;5(3):269-87.
8 Wellington CL,Hayden MR.Caspases and neurodegeneration:on the cutting edge of new therapeutic approaches〔J〕.Clin Genet,2000;57(1):1-7.
9 Loetscher H,Niederhauser O,Kemp J,et al.Is caspase-3 inhibition avalid therapeutic strategy in cerebral ischemia〔J〕?Drug Discov Today,2001;6(13):671-80.
10 Li H,Colbourne F,Sun P,et al.Caspaseinhibitors reduceneuronal injury after focal but not global cerebra lischemia in rats〔J〕.Stroke,2000;31(1):176-82.
11 Zhao H,Yenari MA,Cheng D,et al.Bc1-2 overexpression protects against neuron loss within the ischemic margin following experimental stroke and inhibits cytochrome C translocation and caspase-3 activity〔J〕.Neurochem,2003;85:1026-36.

