组织工程化人工骨种植体修复兔骨缺损效果研究
黄文良,邓 江,苑 成,阮世强
(遵义医学院第三附属医院,贵州遵义 563002)
如何解决骨缺损的修复问题一直是骨外科、整形外科医师研究的重大难题之一[1]。近年来国内外对重组人胰岛素样生长因子-Ⅰ(IGF-Ⅰ)[2]、羟基磷灰石(CHA)[3]和自体红骨髓(ABM)[4]进行了诸多研究,但只涉及一种或两种成分或其中一种成分与其他生长因子合用对骨缺损修复作用的研究,且仍未达到理想效果。2008年 3月 ~2009年 6月,本研究通过将 CHA、IGF-Ⅰ与 ABM三者复合构建组织工程化人工骨种植体,并将其植入动物体内,从组织学角度探讨修复骨缺损的效果,为今后更好应用于临床提供实验依据。
1 材料与方法
1.1 实验动物 成年健康中国家兔(遵义医学院动物实验中心提供)36只,2.5 kg,雌雄不限,随机分为 A、B、C、D、E、F共 6组,各组种植体分别为CHA/IGF-Ⅰ /ABM、CHA/IGF-Ⅰ 、CHA/ABM、CHA、ABM、空白。
1.2 材料 IGF-Ⅰ(上海麦莎生物科技有限公司),CHA(上海睿星基因技术有限公司,每块 5 mm×5 mm×20 mm大小,平均孔径 200μm,孔隙率55%,抗压 3.3 k Pa,γ射线消毒灭菌)。
1.3 方法
1.3.1 CHA/IGF-Ⅰ的制备 无菌条件下,参照Zambonin等[5]的附壁方法,IGF-Ⅰ以浓度 400 ng/ml与 CHA混合后 4℃充分吸附 48 h,测量每块 CHA吸附 IGF-Ⅰ约 140 ng。
1.3.2 CHA/IGF-Ⅰ/ABM和 CHA/ABM的制备无菌条件下,用 16号骨穿针从兔股骨大转子穿刺,用肝素预湿后空针抽吸骨髓约 2 ml,摇匀后分别接种于 CHA/IGF-Ⅰ和 CHA各 1 ml,充分吸附 0.5 h。
1.3.3 模型制作 以 3%戊巴比妥钠(1 ml/kg)静脉麻醉家兔,备皮、消毒铺巾,切开皮肤逐层分离,充分暴露前臂桡骨中段,制作约 2 cm的桡骨全层缺损模型,生理盐水冲洗伤口后分别移植相应材料。术后伤口纱布包扎,不用外固定,前 3天每只肌注庆大霉素 2万 U/d,同术前喂养方法笼养。
1.3.4 检测指标 分别于 4、8、12周观察。大体观察:观察家兔术后精神状态、进食、活动和伤口愈合情况;处死后对标本及其周围组织的情况进行大体观察。组织学观察:①空气栓塞处死动物后截取带宿主骨端 0.3 mm移植物,剔除附着的软组织,10%中性甲醛固定24 h,5%硝酸脱钙、梯度酒精脱水、二甲苯透明、石蜡包埋。沿长轴制 5μm切片,HE染色,光镜观察;②组织学评估:评分内容包括连接(无连接 0分;纤维连接 1分;骨与类骨连接 2分;骨连接 3分;骨干完全再生 4分)、松质骨 (无骨细胞活性 0分;新骨早期聚集 1分;有活性的新骨聚集 2分;松质骨正在改造 3分;松质骨完全形成 4分)、皮质骨(无皮质骨形成 0分;皮质骨生长的早期表现 1分;皮质骨正在形成 2分;大部分被改造 3分;完全骨再生 4分)3个方面 12项。
1.3.5 统计学方法 采用 SPSS 13.0统计软件进行处理,评分结果采用 F检验,以 P≤0.05为有统计学差异。
2 结果
2.1 大体标本观察 术中因麻醉意外死亡 1只,术后第 5、6天腹泻死亡 2只,后补做 3只,术后前 3天所有家兔精神状态稍差,饮食活动减少,术肢稍肿胀、跋行。第 4天恢复正常活动,饮食、精神状态好。术后所有家兔手术切口干燥,局部无感染征象。在各个时期均未见植入物排出或脱出现象。A、C组:术后 4周植入部位周围有较多软组织包裹,骨端有部分骨痂连接,植入物无活动;术后 8周植入部位周围有大量软组织包裹,植入物表面有较多骨痂形成,与骨端连接紧密;术后 12周缺损部位骨皮质与骨端皮质连续,塑形较好,肉眼无法分辨缺损区。B、D组:术后 4周植入部位周围有较少软组织包裹,骨端未见骨痂连接,植入物易活动;术后 8周植入部位周围有少量软组织包裹,植入物表面有较少骨痂形成,与骨端连接疏松,有少量新骨形成;术后 12周植入物两端有新骨包绕,与骨端连接紧密,骨塑形差。E组:术后 4周骨缺损区大部分以软组织填充,靠近尺骨侧有较少骨痂形成;术后 8周骨缺损区大部分以软组织填充,靠近尺骨侧有少量骨痂形成,骨端有少量骨痂连接;术后 12周骨缺损区仍有 2/3以软组织填充,骨痂增多,骨端有明显骨痂连接。F组:术后骨缺损区均以软组织充填,大小基本未变,4周两骨端开始萎缩、封闭;12周两骨端已萎缩硬化、髓腔完全封闭,缺损区无骨性连接。
2.2 组织病理学观察 A组:术后 4周植入物可见大量较成熟骨小梁出现,仍能见到少量类骨质和软骨化骨现象;术后 8周可见成熟骨小梁大部分向板层骨转化,骨痂改造、塑形明显,已有皮质骨形成;术后 12周形成均匀致密的板层骨,较多贯穿连接,骨质更成熟。B、D组:术后 4周孔隙内多见纤维组织,软骨和类骨质少见;术后 8周主要为岛状编织骨,板层骨少见;术后 12周有少量板层骨附壁,成熟度低。C组:术后 4周有岛状或带状的编织骨小梁形成;术后 8周编织骨向板层骨过渡,但板层骨形成较少;术后 12周形成均匀致密的板层骨,较少贯穿连接,成熟度低于 A组。E组:术后 4周可见较多类骨质及少量新生骨小梁,编织骨形成不明显;术后 8周较多形成编织骨样组织,个别标本仍能见到散在类骨质和软骨组织;术后 12周形成板层骨样组织,出现成熟骨小梁。F组:术后 4、8及 12周均为纤维瘢痕组织,仅在骨端有少量成骨。
2.3 评分结果比较 见表1。
表1 各组 Lane-Sandhu组织学评分结果比较(±s)
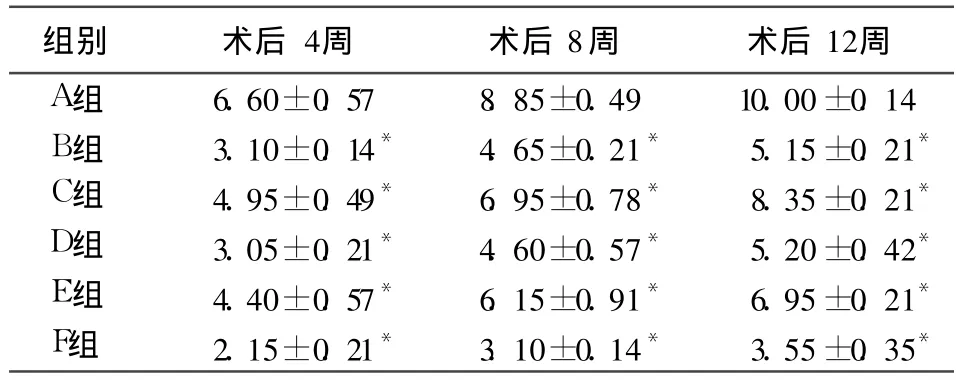
表1 各组 Lane-Sandhu组织学评分结果比较(±s)
注:与 A组比较,*P<0.05
组别 术后 4周 术后8周 术后12周A组 6.60±0.57 8.85±0.49 10.00±0.14 B组 3.10±0.14* 4.65±0.21* 5.15±0.21*C组 4.95±0.49* 6.95±0.78* 8.35±0.21*D组 3.05±0.21* 4.60±0.57* 5.20±0.42*E组 4.40±0.57* 6.15±0.91* 6.95±0.21*F组 2.15±0.21* 3.10±0.14* 3.55±0.35*
3 讨论
目前临床上修复骨缺损的方法主要包括以下几种:自体骨移植、同种异体骨和异种骨移植、人工骨移植。但存在着供体来源有限、排斥反应严重及并发症多等许多问题。骨组织工程技术为解决骨缺损修复提供了新的思路,促进骨愈合有 3种作用机制[6]。CHA是由 Roy等于 1974年用天然海珊瑚在高温、高压条件下,经过“热液交换反应”改进制成,具有较多的孔隙及均匀的孔隙率,与人体松质骨结构相似,为IGF-Ⅰ的附着、缓释提供了良好的载体,并为骨传导提供了良好的框架结构,为血管再生、骨沉积、骨再生提供了适宜的孔隙,其成骨潜能已被广泛证实。而IGF-Ⅰ是一种具有多种生物学活性的骨生长调节因子。它们以内分泌、自分泌或旁分泌方式作用于骨骼细胞,一方面刺激成骨细胞和成骨前体细胞增殖、分化和基质合成,促进骨生长修复;另一方面,通过介导作用调节破骨细胞的分化形成和功能活性,在骨改建耦联中发挥重要作用。另外,自体骨髓含有骨再生能力强的间充质干细胞,且抽吸创伤小,简单易行,不引起免疫排斥反应,已成功地用于多种骨科临床治疗。
CHA、IGF-Ⅰ及 ABM的单一或两者合用研究已取得了一定的成果[7,8]。根据组织诱导再生技术的方法,在人工骨中添加促进组织再生的细胞和物质,使丧失的组织再生,可克服传统治疗方法的某些局限性,使骨修复材料的生物活性有很大提高。本研究组织学观察结果显示:成骨作用 A组 >C组 >E组 >B、D组 >F组,表明 IGF-Ⅰ 、CHA、ABM三者相辅相成、相互促进;CHA/ABM成骨作用仅次于CHA/IGF-Ⅰ/ABM,表明 ABM有骨诱导能力;而CHA/IGF-Ⅰ与 CHA成骨作用比较无统计学意义,表明了单纯吸附 IGF-Ⅰ的 CHA并不能显著提高CHA的成骨效果,通过 ABM提供种子细胞才能发挥 IGF-Ⅰ骨诱导的生物学效应;在 ABM中,由于自体骨髓所能提供的成骨干细胞细胞数量极少(3 000/20 ml),所以成骨效果不理想,但与 CHA/IGF-Ⅰ、CHA相比略有优势;而从与 CHA/ABM的比较可以看出,ABM以 CHA为载体材料更能发挥成骨效应。
将 CHA、IGF-Ⅰ及 ABM三者复合构建具有较高生物活性的组织工程化移植物,充分体现骨再生、骨诱导及骨传导 3种机制,基本具备了理想移植材料所应有的特性。但由于本研究期限短,某些未知因素如其生物降解性能,IGF-Ⅰ附壁最佳方式及剂量,自体骨髓所能提供的成骨干细胞细胞数量极少等问题仍需进一步探索。
[1]Giannoni P,Mastrogiacomo M,Alini M,et al.Regeneration of large bone defects in sheep using bone marrow stromal cells[J].J Tissue Eng Regen Med,2008,2(5):253-262.
[2]Yao W,Zhong J,Yu J,et al.IGF-Iimproved bone mineral density and bodycomposition of weaver mutant mice[J].Growth Horm IGF Res,2008,18(6):517-525.
[3]Sarahrudi K,Mousavi M,Grossschmidt K,et al.Combination of anorganic bovine-derived hydroxyapatite with binding peptide does not enhance bone healing in a critical-size defect in a rabbit model[J].JOrthop Res,2008,26(6):759-763.
[4]Hisatome T,Yasunaga Y,Yanada S,et al.Neovascularization and bone regeneration by implantation of autologous bone marrow mononuclear cells[J].Biomaterials,2005,26(22):4550-4556.
[5]Zambonin G,Grano M,Greco G,et al.Hydroxyapatite coated with insulin-like growth factor 1(IGF1)stimulates human osteoblast activity in vitro[J].Acta Orthop Scand,1999,70(2):217-220.
[6]Koëter S,Tigchelaar SJ,Farla P,et al.Coralline hydroxyapatite is a suitable bone graft substitutein an intra-articular goat defect model[J].J Biomed Mater Res B Appl Biomater,2009,90(1):116-122.
[7]Silva RV,Camilli JA,Bertran CA,et al.The use of hydroxyapatite and autogenous cancellous bone grafts to repair bone defects in rats[J].Int J Oral Maxillofac Surg,2005,34(2):178-184.
[8]Madry H,Kaul G,Cucchiarini M,et al.Enhanced repair of articular cartilage defects in vivo by transplanted chondrocytes overexpressing insulin-like growth factorⅠ (IGF-Ⅰ )[J].Gene Ther,2005,12(15):1171-1179.

