三草方不同极性部位及其配伍后对人肺腺癌SPC-A-1细胞的影响研究Δ
邵振中,贾晓斌,陈彦,封亮,施峰(.江苏省中医药研究院中药新型给药系统重点实验室/国家中医药管理局中药口服释药系统重点研究室,南京市 20028;2.江苏大学药学院,镇江市 2203)
中药复方三草方(SCF)是江苏省中医药研究院治疗非小细胞性肺癌的临床验方,由夏枯草、白花蛇舌草、仙鹤草等药味组成,具有滋补肝肾、清热利湿、散结抗癌之功效。在临床应用中该验方被证明不仅可以改善症状,提高患者的生存质量,而且可以减少复发,延长患者的生存期。本研究制备了SCF的水煎液及不同极性部位提取物,以SPC-A-1肺腺癌细胞株为模型,筛选出最有效抗癌极性部位,并明确提出了不同极性间的最佳配伍方案,为制备疗效更好的该复方制剂作准备,并为进一步阐明其抗肺癌的物质基础研究提供理论依据。
1 材料
1.1 仪器
MK3型酶标仪(美国Thermo公司);BS203型倒置显微镜(日本Coic公司);CO2细胞培养箱(Thermo公司);真空恒温干燥箱(上海精宏实验设备有限公司)。
1.2 试药
夏枯草、白花蛇舌草、仙鹤草等药材购于安徽亳州滕王药业有限公司,经南京中医药大学药学院吴德康教授鉴定均为真品;胰蛋白酶、RPMI 1640培养基、胎牛血清(美国Gibco公司);顺铂(DDP,南京制药厂有限公司,批号:20071104);四甲基偶氮唑蓝(MTT,南京生兴生物有限公司)。
1.3 细胞
SPC-A-1细胞株购自中科院上海细胞生物学研究所细胞库。
2 方法
2.1 SCF的提取与制备
2.1.1 水煎液的提取:按处方比例称取该复方,用10倍量的沸水提取2次,每次2 h,提取液经40目筛过滤后混合,定容至含生药量100 mg·mL-1。实验前用0.22 μm微孔滤膜过滤除菌,给药时用PBS溶液稀释至所需浓度。
2.1.2 各极性部位的提取:按处方比例称取该复方,依次用10倍量的95%、60%、30%乙醇溶液和水回流提取2次,每次1 h,滤过,回收乙醇,浓缩液真空干燥(温度60℃),95%和60%醇提部位用一定量含5%乙醇的PBS溶液溶解(有机相终浓度不超过0.5%),30%醇提部位和水提部位用一定量的PBS溶液溶解。这4个极性部位提取物均制成生药含量为100 mg·mL-1的SCF各极性提取液,经0.22 μm微孔滤膜过滤除菌,实验时用PBS溶液稀释至所需的药物浓度。
2.2 SCF水煎液及各极性部位对SPC-A-1细胞增殖活性的影响
取对数生长期细胞使其脱壁,用10%胎牛血清RPMI1640培养液重悬成单细胞悬液,以每孔2.5×104个细胞接种于96孔细胞培养板,每孔培养液100 μL。将培养板移入细胞培养箱继续培养24 h,吸弃孔内原培养液,加入不含胎牛血清RPMI1640培养液90 μL,再加入10 μL SCF水煎液及各极性提取部位不同浓度的PBS溶液,经初步的预实验,生药浓度均设置为10.0、5.0、2.0、0.4、0.08 mg·mL-1梯度。然后移入细胞培养箱继续培养36 h,每个药物浓度设6个平行复孔,设上下本底对照孔,另设阳性对照组(DDP,浓度为25 mg·L-1)和PBS空白对照组。36 h后,每孔加入5 mg·mL-1MTT 溶液10 μL,5%CO2、37℃继续孵育4 h后终止培养,小心吸弃孔内上清液,每孔加DMSO 100 μL,在微量振荡仪振荡10 min,使结晶充分溶解,用酶标仪测定吸光度(A)值,检测波长为550 nm,参比波长为690 nm。药物半数抑制浓度(IC50)用SPSS 10.0软件进行计算。实验重复3次。按下式计算细胞生长抑制率。
细胞生长抑制率(%)=(1-用药组平均A值/空白对照组平均A值)×100%
2.3 SCF各极性部位配伍后对SPC-A-1细胞增殖活性的影响
采用60%醇提部位与其它1个或多极性部位按1∶1等生药量进行配伍。60%醇提部位与95%醇提部位的配伍和60%醇提部位、95%醇提部位再与其它1个或2个极性部位配伍,其生药浓度均设置为1.0、0.4、0.2、0.08、0.016 mg·mL-1梯度;60%醇提取部位与30%醇提部位的配伍、60%醇提部位与30%醇提及水提2个部位的配伍、60%醇提部位与水提部位的配伍,其生药浓度均设置为2.0、1.0、0.4、0.2、0.08 mg·mL-1梯度。实验操作同“2.2”项下方法。
2.4 倒置显微镜观察细胞形态
经各组药物处理的SPC-A-1细胞直接置于倒置显微镜下观察细胞形态。
2.5 统计学方法
3 结果
3.1 SCF水煎液及各极性部位对SPC-A-1细胞的增殖抑制作用
SCF60%醇提部位、95%醇提部位及水煎液对SPC-A-1细胞均有显著的抑制作用,SCF水煎液和各极性部位对SPC-A-1细胞的抑制作用都有剂量依赖性;SCF60%醇提部位对SPC-A-1细胞的IC50最低,与其它各组药物均有显著性差异(P<0.05),说明60%醇提部位对SPC-A-1细胞的抑制作用最好,其次为SCF水煎液。故采用60%醇提部位与其它1个或多极性部位按1∶1等生药量进行配伍。复方水煎液和各极性部位对SPC-A-1细胞增殖作用的影响见图1;各组药物对SPC-A-1细胞的IC50见图2。

图1 复方水煎液和各极性部位对SPC-A-1细胞增殖作用的影响Fig 1 Effect of various polarity fractions of SCF and compound decoction with different concentration on proliferation of SPC-A-1 cells

图2 各组药物对SPC-A-1细胞的IC50与60%醇提部位比较:*P<0.05,**P<0.01Fig 2 IC50of various drugs for SPC-A-1 cellsvs.60%ethanol extract:*P<0.05,**P<0.01
3.2 SCF各极性部位合并后对SPC-A-1细胞的增殖抑制作用
SCF 60%醇提部位与其它1个或多个醇提部位按1∶1等生药量配伍后,对SPC-A-1细胞均有显著的抑制作用,并且呈剂量依赖关系;在60%醇提部位与其它1个或多个极性部位的配伍中,它们的IC50与60%醇提部位的IC50比较呈显著性降低(P<0.01)。这说明95%、30%醇提和水提部位对60%醇提部位均有一定的协同抑瘤作用。60%醇提部位与95%醇提部位配伍后,或60%与95%醇提部位再加上1个或者2个其它部位配伍后,IC50均无显著性变化(P>0.05);60%醇提部位与30%醇提部位和水提部位之间的配伍,它们的IC50也无显著性变化(P>0.05);而后三者与60%醇提部位与95%醇提部位的配伍比较,有显著性差异。这说明用60%与95%醇提部位配伍后就可以达到预期的要求。各极性部位配伍后对SPC-A-1细胞的IC50见图3。
3.3 细胞形态学观察
为后续研究SCF各提取部位对肿瘤细胞作用的机制,采用倒置显微镜观察SPC-A-1细胞生长情况。结果表明,经SCF各提取物处理36 h后的SPC-A-1细胞生长受到抑制,并出现贴壁生长细胞典型的凋亡形态变化现象,细胞浮悬于培养液中,细胞体积缩小、变圆,核颜色加深,细胞透明度和黏附力降低;而PBS对照组SPC-A-1细胞生长良好,贴壁生长,体积大,细胞核以圆形或椭圆形为主。这说明SCF各提取物有可能是通过促进细胞凋亡来抑制SPC-A-1细胞生长增殖的。各组药物作用SPC-A-1细胞36 h后倒置显微镜下细胞形态学变化见图4。
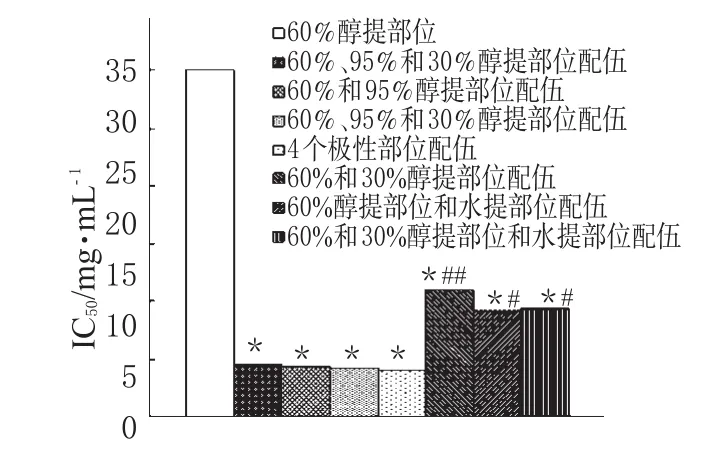
图3 各极性部位配伍后对SPC-A-1细胞的IC50与60%醇提部位比较:*P<0.01;与60%和95%醇提部位配伍比较:#P<0.05,##P<0.01Fig 3 IC50of various polarity fractions of SCF after mixing for SPC-A-1 cellsvs.60%ethanol extract:*P<0.01;vs.60%ethanol extract combined with 95%ethanol extract:#P<0.05,##P<0.01
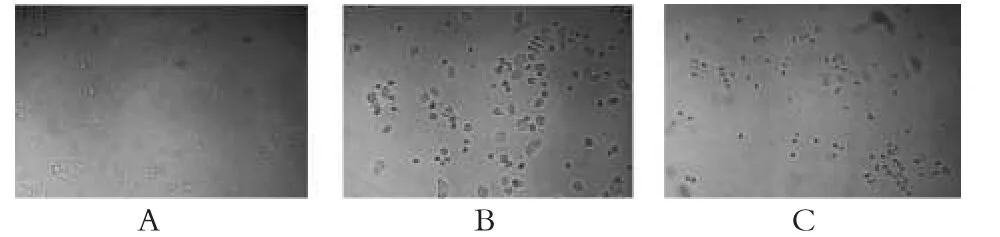
图4 各组药物作用SPC-A-1细胞36 h后倒置显微镜下细胞形态学变化A.PBS对照组;B.60%醇提部位(5 mg·mL-1);C.复方水煎液(10 mg·mL-1)Fig 4 Morphological changes of SPC-A-1 cells treated with various drugs for 36 h under inverted microscopeA.PBS control group;B.60%ethanol extract(5 mg·mL-1);C.compound decoction(10 mg·mL-1)
4 讨论
体外抑制肿瘤细胞增殖活性的研究说明,SCF60%和95%醇提部位的合并是最为合适的,这为制备疗效更好的该复方制剂提供了一些基础。SCF60%醇提部位与其它极性部位合并后,IC50均有显著降低,说明该复方有效组分之间在药理作用上具有协同作用,这从一个方面验证了中药复方的药理作用是多种有效组分共同作用的假说[1,2],也符合笔者所提出的关于物质基础“三个层次多维结构”假说中的一维结构:由多组分构成的整体(即中药复方的物质基础)其各组分间存在配伍配比关系[3]。
据文献报道,夏枯草、白花蛇舌草中的三萜类化合物——熊果酸与齐墩果酸[3,4]的含量较高,且药理实验也证明这2种三萜类物质均具有较好的直接抑制肿瘤细胞的作用[5~7]。经初步化学试验表明,SCF水煎液中含有三萜类、黄酮类、酚类和糖类物质;SCF60%与95%醇提部位主要含有三萜类、黄酮类和酚类化合物;而SCF30%醇提与水提部位主要含有黄酮类和糖类化合物。且本研究结果也证实,SCF水煎液、60%和95%醇提部位对人肺腺癌SPC-A-1细胞的IC50显著低于SCF30%醇提和水提部位,由此推断SCF中的三萜类有机酸类化合物可能是直接抑制肿瘤细胞增殖活性的主要有效成分。
本研究采用体外肿瘤细胞模型进行筛选,研究了SCF中各极性部位及其合并后对肿瘤细胞的直接杀伤作用,笔者准备进一步研究促进机体免疫反应的间接抑瘤作用和功能组分对有效组分的作用,为剂型优化作进一步准备,并阐明SCF抗肺癌的物质基础,为创制抗肺癌现代复方中药提供科学依据。
[1]王本祥,周丽秋.关于中药活性成分的认识及其研究方法[J].中国中药杂志,2001,26(1):10.
[2]罗国安,王义明.中药复方的化学研究体系[J].世界科学技术-中药现代化,1999,1(1):11.
[3]贾晓斌,陈 彦,李 霞,等.中药复方物质基础研究新思路和方法[J].中华中医药,2008,23(5):420.
[4]刘 悦,宋少江,徐绥绪.夏枯草的化学成分及生物活性研究进展[J].沈阳药科大学学报,2003,20(1):55.
[5]方岩雄,张永成,陈敏敏,等.抗肿瘤药物白花蛇舌草及其活性成分[J].中成药,2004,26(7):577.
[6]黄 镜,孙 燕.熊果酸的抗肿瘤活性[J].中国新药杂志,1997,6(2):101.
[7]杜 瑜,李焕德.齐墩果酸的研究进展[J].中国药房,2006,17(4):304.

