淋巴瘤组织中线粒体DNA突变的研究*
马 佳 陈治文 梅传忠 杨清玲 王 惠
安徽省蚌埠医学院 1生物化学与分子生物学教研室 2临床检验诊断实验中心,蚌埠 233000
近年来随着分子生物学的迅速发展,对于线粒体DNA(mitochondrial DNA,mtDNA)分子生物学领域的研究日趋深入。线粒体是人体细胞独特而重要的细胞器,是迄今发现的人类细胞核外唯一具有自身基因组,且能不依赖核 DNA(nDNA)进行复制、转录和翻译的细胞器。mtDNA编码参与氧化磷酸化和ATP生成所必需的多肽,与核基因组相比,mtDNA缺乏组蛋白保护,加之自身又缺乏有效的损伤修复系统,因此极易受到致癌物的攻击,进而诱发突变[1]。由于线粒体在能量代谢、氧自由基生成和细胞凋亡中都处于中心地位,而氧自由基的生成及肿瘤细胞凋亡的延迟均与肿瘤的发生有着莫大的关系,所以使得探讨mtDNA突变与肿瘤的相关性成为当今的研究热点。近年来,已在多种肿瘤组织中发现有mtDNA的突变,但未见mtDNA与恶性淋巴瘤的相关研究,我们采用PCR产物直接测序的方法,对38例淋巴瘤组织及对应的外周血淋巴细胞mtDNA序列进行了突变检测,目的在于探讨mtDNA突变与恶性淋巴瘤发生及进展之间的关系。
1 材料与方法
1.1 材料
收集2005~2008年38例石蜡包埋的淋巴瘤组织,由蚌埠医学院病理教研室提供。每个淋巴瘤蜡块组织的诊断均经重新切片后苏木精-伊红染色和免疫组织化学染色(CD20、CD79a、CD3、CD45RO、TdT)检查确诊为恶性淋巴瘤。38例病例中,B细胞淋巴瘤29例,T细胞淋巴瘤9例。并采集对应患者的外周静脉血。
1.2 主要试剂和仪器
蛋白酶 K(Amresco,美国)、T ris-饱和酚(上海生工生物工程有限公司),琼脂糖(Biowest,西班牙),Marker(天根生化科技有限公司),PCR扩增试剂盒(MBI Fermentas,立陶宛),PCR引物(上海生工生物工程有限公司合成)。梯度PCR仪、紫外凝胶成像仪、电泳仪、SMARTSPEC 3000分光光度计(BIO RAD,美国)。
1.3 DNA的提取
1.3.1 石蜡组织 采用 0.5%tween-20进行脱蜡,蛋白酶K裂解及酚/氯仿抽提(另文发表)。取2 片 10 μ m 切 片组织 ,加入 500 μ L 0.5%tween-20,70℃水浴15 min,15 000 r/min离心 15 min去除石蜡成分,室温下干燥后加入裂解缓冲液及蛋白酶K(终浓度 1 mg/mL),56°C水浴72 h,酚/氯仿抽提。
1.3.2 外周静脉血白细胞 采用蛋白酶K裂解及酚/氯仿抽提DNA。
1.4 PCR扩增引物
在http://www.mitomap.org查询mtDNA的全长序列,mtDNA的D-Loop区位于1~576 bp和16 024~16 569 bp,共约 1 120 bp。4对扩增mtDNA的引物是通过参考文献[2]报道,并经BLAST比对后,交由上海生工生物工程有限公司合成。4对引物序列、扩增长度、所位于基因区及PCR扩增时的退火温度均列于表1。
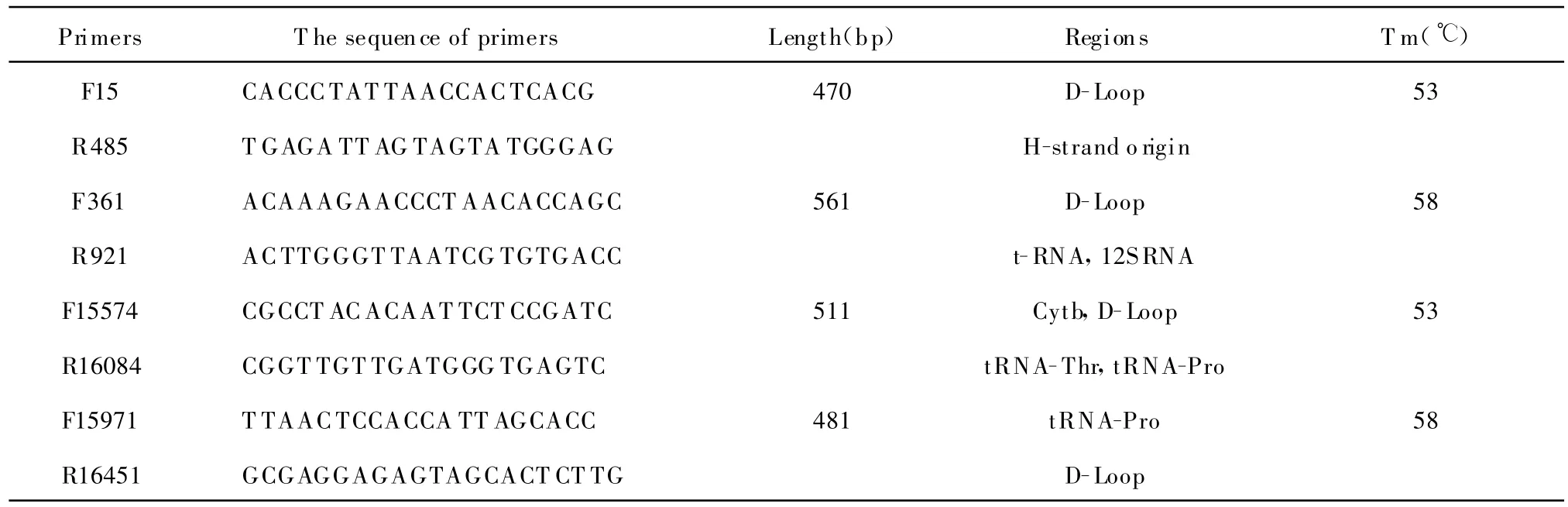
表1 PCR扩增的4对引物序列及扩增片段的大小Table 1 T he sequences of 4 pairs of PCR primers and the length of amplified fragments
1.5 PCR扩增
PCR反应体系为50 μ L,按照PCR扩增试剂盒操作说明进行,PCR Master Mix 25 μ L,上下游引物(10 μ mol/L)各 1.5 μ L,模板 1 μ L,ddH2O 21 μ L。循环条件为95℃5 min,94℃45 s,53℃45 s,72℃45 s,从第2步开始循环,36个循环,最后72°C延伸10 min。PCR产物各取 4 μ L用1.5%琼脂糖凝胶(EB染色)电泳分离。
1.6 PCR产物纯化、测序
PCR 产物4 μ L与1 μ L的6×上样缓冲液混合后加样于2%琼脂糖凝胶10 V/cm电泳30 min,结果用凝胶成像仪进行记录。DNA测序采用BigDye测序反应试剂盒于ABI377(AppliedBio system)自动测序仪上进行。测序反应用的引物同PCR反应的引物。
1.7 mtDNA突变的确定
将测序结果通过DNAssit序列分析软件进行比对分析,由于mtDNA具有高度的多态性,所以在本研究中以患者的外周血白细胞mtDNA序列作为正常对照,将癌组织出现的mtDNA序列变化定义为突变,同一病例的癌组织和血白细胞mtDNA序列相同,而与 mtDNA修改版剑桥序列(http://www.mitomap.org)不同时,定义为多态性变化,如这种变化尚未报道过则为新的多态性变化。
2 结果
2.1 PCR结果
淋巴瘤组织PCR结果显示扩增产物大小与预期相符,琼脂糖凝胶电泳图谱上显示出4条清晰的扩增条带,分别为4对引物扩增后的mtDNA片段(图1)。
2.2 PCR产物测序结果
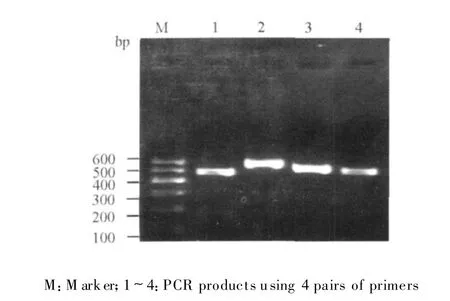
图1 淋巴瘤组织的PCR扩增产物Fig.1 PCR products using 4 pairs of primers from lymphoma tissues
2.2.1 突变位点分析 本研究共分析了38例恶性淋巴瘤组织,在18例(47.4%)组织中发现共25个突变,包括插入突变、缺失突变、点突变。25个突变发生在15个核苷酸位点(15个标本出现1个突变,1个标本中出现2个突变,1个标本中出现3个突变,1个标本中出现5个突变)。15个突变位点中有10个是已经报道过的,5个是新发现的。在这些突变中,有40%(10/25)是属于同质性突变,有60%(15/25)是属于异质性突变。其中21个突变位于mtDNA的D-Loop区,4个突变位于mtDNA的编码区,本研究共扩增了mtDNA的4个片段,其中包含D-Loop区序列987 bp,编码区序列796 bp,其中D-Loop发生变异的频率是编码区的4.26倍(21/987,2.13%与4/796,0.50%)。而变异发生频率最高是位于D-Loop区中的D310区域(np303~315区域),在21个D-Loop区突变中发现有9个突变位于此区域。在突变类型中,插入突变与缺失突变主要位于D-Loop区,点突变位于D-Loop区和编码区,多为A-G或T-C间的碱基置换。见表2和图2。
2.2.2 多态性分析 在38例组织中共发现54个多态性改变,其中50个(92.6%)多态性与mtDNA数据库中相符,4个(7.4%)是新发现的多态性;其中51个(94.4%)多态性改变出现在mtDNA的DLoop区域,3个(4.2%)多态性改变是位于编码区。新发现的多态性改变均位于D-Loop区。mtDNA多态性位点往往也是突变的高发位点,上述的突变中有13个(13/25,52%)位点就与多态性位点重叠。见表3。
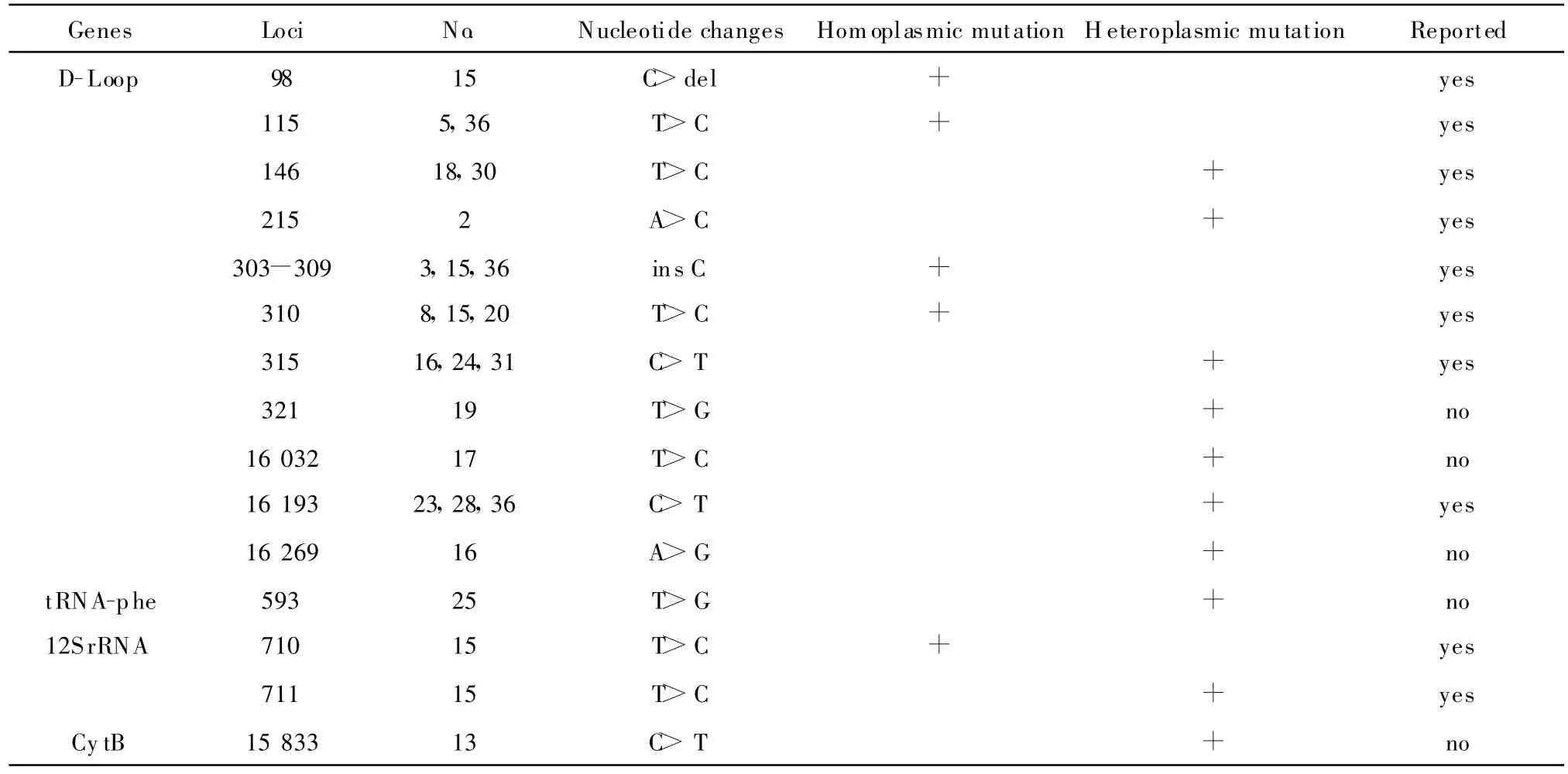
表2 淋巴瘤组织中mtDNA突变位点的分布Table 2 Somatic mtDNA mutations in lymphoma tissues
3 讨论
1956年Warburg[3]提出线粒体功能不全可能在肿瘤发生中起作用,他认为在肿瘤的发生过程中涉及到线粒体呼吸链的损伤。越来越多的文献报道了mtDNA异常改变与肿瘤发生的关系,人胰腺癌、胃癌、肺癌及乳腺癌等多种肿瘤组织及肿瘤细胞株中均发现有mtDNA的突变[4-8];此外Ishikawa等[9]认为mtDNA突变可以促进肿瘤转移,Arnold等[10]认为mtDNA突变可以促进肿瘤生长的相关报道更进一步证实了mtDNA突变与肿瘤的发生发展有关。淋巴瘤是原发于淋巴结或淋巴组织的恶性肿瘤,我国淋巴瘤的发病率及病死率均较高,而有关于mtDNA突变与淋巴瘤发生发展关系的报道在国内外文献中尚未见到。本研究采用PCR扩增、直接测序的方法检测了淋巴瘤组织中的mtDNA,以期为研究mtDNA突变与淋巴瘤的发生发展相关性提供实验依据。
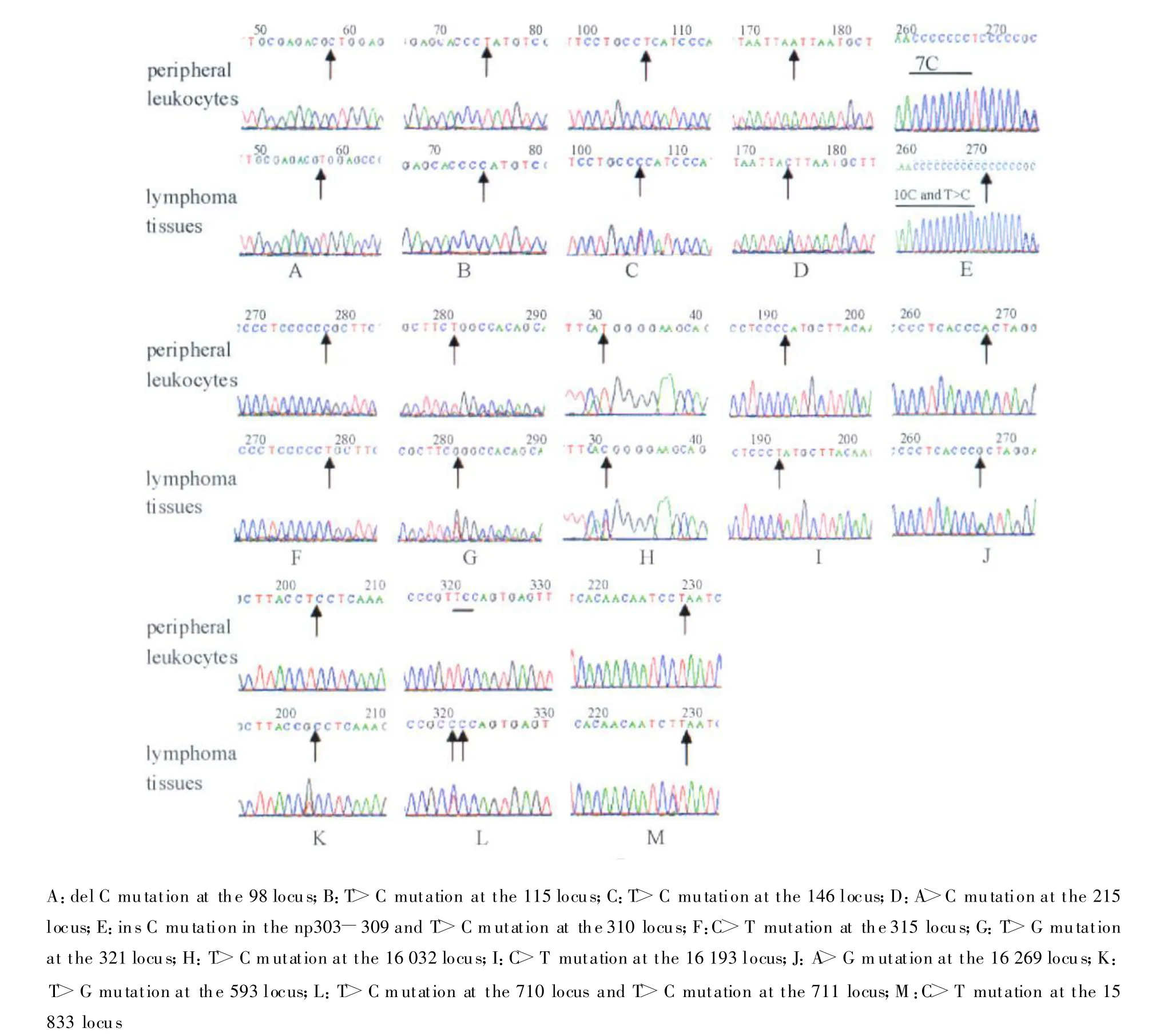
图2 淋巴瘤组织mtDNA突变的测序图(与外周血白细胞比较)Fig.2 mtDNA mutations in lymphoma tissues compared with peripheral leukocy tes
本研究检测了38例恶性淋巴瘤组织及相应的外周血白细胞的mtDNA,约47.4%(18/38)组织中出现了mtDNA突变,突变位点共25个,突变类型包括插入突变、缺失突变、点突变。从所报道的相关文献中可以看出不同肿瘤组织的mtDNA突变位点和突变程度并不一致,这可能与不同组织肿瘤发生所必需的mtDNA突变率、线粒体的数目和细胞分化固有的数目存在差异有关[11]。但是比较不同肿瘤组织中的mtDNA突变,有2个与实体肿瘤类型无关的变化特点:一是主要为T-C和G-A间的碱基替换,这与本研究结果一致,除了缺失与插入突变,点突变中只有3例发生A-C及T-G间的碱基颠换,其余均为T-C和G-A间突变。与实体肿瘤类型无关的第二个变化特点是D-Loop区是一个体细胞突变的频发位点。mtDNA是一条全长16 569 bp的双链闭环分子,一条为重链(H链),另一条为轻链(L链),mtDNA相邻基因间极少有非编码基因,DLoop(D环)区是 mtDNA的主要非编码区,位于16 024 bp~576 bp,约占全部 mtDNA的6%(约1 120 bp),富含A-T碱基,D环区有mtDNA复制的起始位点和转录启动子,对mtDNA复制和转录具有调控作用。在本研究发现的25个突变位点中,21个位点位于mtDNA的D-Loop区,4个突变位于mtDNA的编码区,D-Loop发生变异的频率是编码区的4.26倍。其中在D-Loop区域中的一段单核苷酸重复区域(核苷酸位点303~315,简称D310,基因序列为CCCCCCCTCCCCC)是新近发现的突变高发位点,D310区域参与了持久性RNA-DNA杂化的形成,与重链复制的起始过程有关,在本研究中D310区域突变频率为36%(9/25),与其他报道结果相似。D310是一个高度多态的区域,在np310位点为胸腺嘧啶(T),其中 np303~309的长度从7C到9C不等,最常见的野生型为7~8C。在本研究观察到了np303~309的长度长达10C的突变(图2),这种大范围的插入突变比较少见,可能与肿瘤的发生有关,究其原因可能是这些部位的突变影响了mtDNA的复制,从而促使氧化呼吸链蛋白多肽含量增加或者改变电子传递,使增生的癌细胞在低氧条件下能够存活[12]。
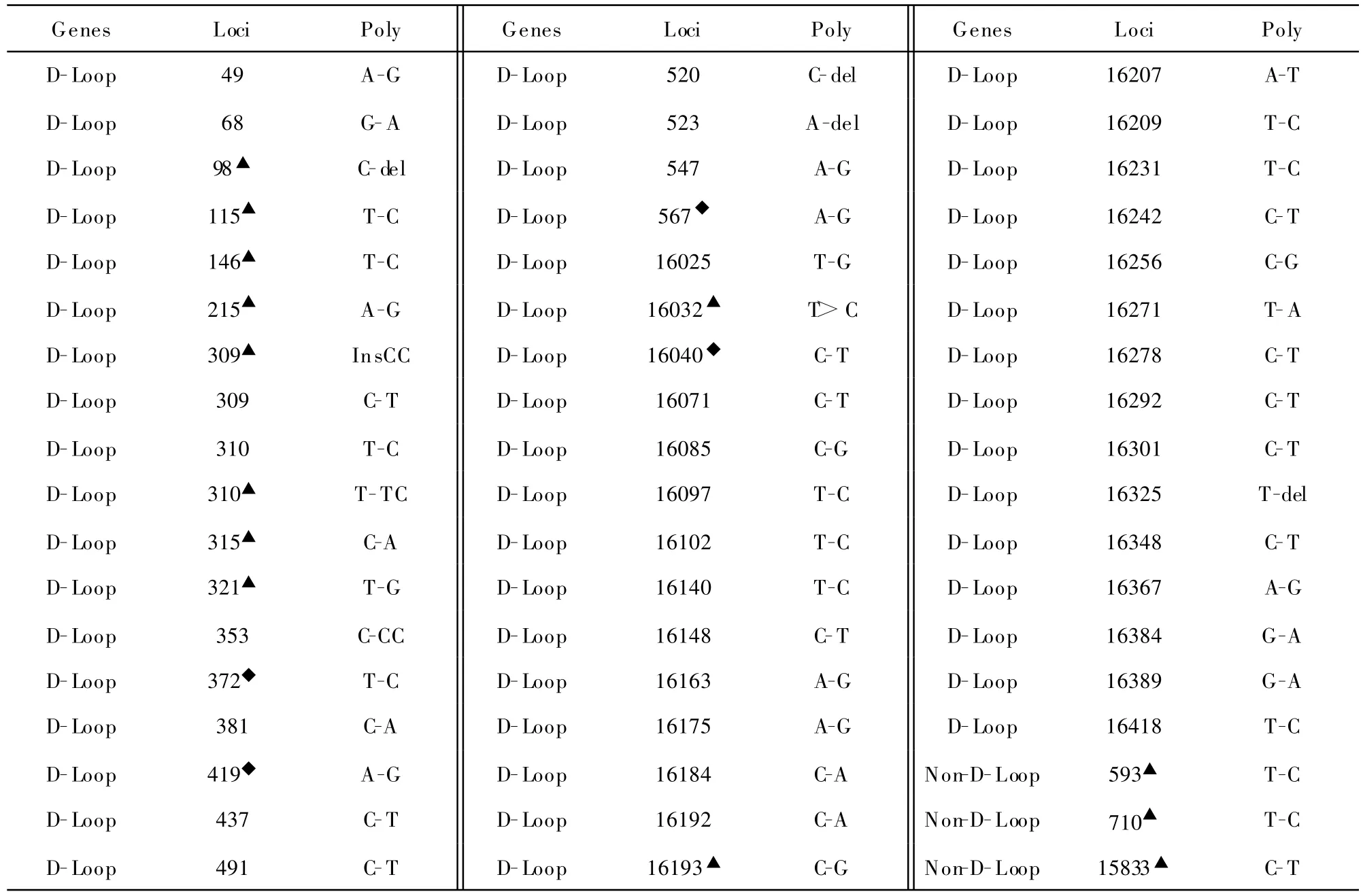
表3 淋巴瘤组织中mtDNA多态性位点分析Table 3 mtDNA polymorphisms in lymphoma tissues
在38例淋巴瘤组织中共发现54个多态性改变,其中51个(94.4%)多态性改变出现在mtDNA的D-Loop区域,3个(4.2%)多态性改变是位于编码区。mtDNA多态性位点往往也是突变的高发位点,约有24%(13/54)的多态性位点就与上述突变位点重叠。有关mtDNA多态性改变是否与肿瘤的发生有关并无直接证据,多态性位点与突变位点的重叠是否提示了多态性位点倾向于进一步形成突变位点,尚需进一步证明。也有学者认为几个多态性变化可能对氧化磷酸化作用较小,但长期的变化积累可能在癌变时发挥调节作用[13]。另外,在25个突变位点中,10个是同质突变,15个是异质突变。损伤可导致少量异质性mtDNA突变,异质性细胞获得一定选择性的生存优势,逐渐取代野生型mtDNA并转变为同质性,异质性突变积累到一定程度则可能导致细胞向恶性转化及肿瘤发生[14]。除此以外,由于线粒体在能量代谢、细胞凋亡、氧自由基产生等方面具有重要作用,mtDNA在不同部位的突变可能影响到细胞凋亡的过程,而致细胞凋亡的减少,细胞永生化;mtDNA突变致氧化磷酸化减少,ROS产物生产增加而由此促使了肿瘤细胞的增殖,所以mtDNA突变可能与肿瘤的发生发展有一定的关系[15-16]。在下一步的实验中,我们拟通过建立缺失mtDNA的淋巴瘤细胞模型(ρ0细胞),检测细胞中ROS的变化与肿瘤细胞增殖、肿瘤细胞凋亡的关系,以期为mtDNA突变与淋巴瘤的发生、进展的关系提供更多实验依据。
[1] Klaunig J E,Kamendulis L M.T he role of oxidative stress in carcinogenesis[J].Annu Rev Pharmacol Toxicol,2004,44:239-267.
[2] 庞玲娟,邵建永,梁小曼,等.鼻咽癌组织线粒体 DNA突变的研究[J].中国肿瘤,2005,14(5):330-332.
[3] Warburg O.On the origin of cancer cells[J].Science,1956,123(3191):309-314.
[4] Lueth M,WronskL I,Giese A,et al.Somatic mitochondrial mutat-ions in pilocytic astrocytoma[J].Cancer Genet Cytogenet,2009,192(1):30-35.
[5] Gochhait S,Bhatt A,Sharma S,et al.Concomitant presence of mutations in mitochondrial gen-ome and p53 in cancer developmenta study in north Indian sporadic breast and esophageal cancer patients[J].Int J Cancer,2008,123(11):2580-2586.
[6] Jakupciak J P,Maragh S,Markowitz M E,et al.Performance of mitochondrial DNA mutations detecting early stage cancer[J].BMC Cancer,2008,8:285.
[7] Jin X,Zhang J,Gao Y,et al.Relationship between mitochondrial DNA mutations and clinical characteristics in human lung cancer[J].Mitochondrion,2007,7(5):347-353.
[8] Kassauei K,Habbe N,Mullendore M E,et al.Mitochondrial DNA mutations in pancreatic cancer[J].Int J Gastrointest Cancer,2006,37(2/3):57-64.
[9] Ishikawa K,Takenaga K,Akimoto M,et al.ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis[J].Science,2008,320(5876):661-664.
[10] Arnold R S,Sun C Q,Richards J C,et al.Mitochondrial DNA mutation stimulates prostate cancer growth in bone stromal environment[J].Prostate,2009,69(1):1-11.
[11] Sanchez Cespedes M,Parrella P,Nomoto S,et al.Identification of a mononucleotide repeat as a majo r target for mitochondrial DNA alterations in human tumors[J].Cancer Res,2001,61(10):7015-7016.
[12] Tong B C,Ha P K,Dhir K,et al.mitochondrial DNA alterations in thyroid cancer[J].J Surg Oncol,2003,82(3):170-173.
[13] Tan D J,Chang J,Liu L L,et al.Significance of somatic mutations and content alteration of mitochondrial DNA in esophageal cancer[J].BMC Cancer,2006,6:93.
[14] Bianchi N O,Bianchi M S,Richard S M.Mitochondrial genome instability in human cancers[J].Mutat Res,2001,488(1):9-23.
[15] Tan D,Goerlitz D S,DumitrescuR G,et al.Associations between cigarette smoking and mitochondrial DNA abnormalities in buccal cells[J].Carcinogenesis,2008,29(6):1170-1177.
[16] Shidara Y,Yamagata K,Kanamori T,et al.Positive contribution of pathogenic mutations in the mitochondrial genome to the promotion of cancer by prevention from apoptosis[J].Cancer Res,2005,65(5):1655-1663.

