细胞色素C修饰电极的制备和性能研究
李 昕 周 静 杨昌英
(1.三峡大学化学与生命科学学院,湖北 宜昌 443002;2.三峡旅游职业技术学院,湖北 宜昌 443002)
生物传感器是一种分析检测装置,它将某种生物材料、生物衍生材料或仿生材料紧密连接或结合到生化转换器或转换微系统上[1].各种类型的生物传感器相应问世,并被应用于医学、食品安全、畜牧兽医、环境监测、发酵工程、军事和科学研究等诸多领域[2-3],生物传感器具有高灵敏度、高选择性、分析快捷、操作简单和仪器可集成化、微型化的特点,应用前景非常广阔,极具研究开发意义.
细胞色素C几乎存在于所有的原核生物和真核生物之中,作为细胞凋亡的信息物质,在研究病理学、药理学以及线粒体变化的过程中具有非常重要的作用.细胞色素C作为一种重要的生物电子载体,在生物体内可以发生可逆的氧化还原反应,但却不能在金属电极上直接进行可逆的电化学反应[4].细胞色素C的这种电化学反应被称之为直接电化学.继此之后,细胞色素C的电化学反应得到更加深入的研究[5].已有报道用细胞色素C作为敏感元件监测细胞培养的胶质母细胞瘤中超氧化物的产量[6].对苯二胺(p-Phenylenediamine,简称PPD),也是一种有广泛应用的中间体,主要用于聚合物制品、纺织品和染发剂行业,也可用于制取橡胶防老剂和照片显影剂,另外对苯二胺还是常用的检验铁和铜的灵敏试剂[7].在电化学领域中,PPD可以作为单体在不同条件下通过化学或电化学方法聚合为导电聚合物或非导电聚合物[8].本文通过自组装法和吸附法两种不同方法制备了修饰电极,运用循环伏安和交流阻抗,探究了细胞色素C修饰电极检测过氧化氢和亚硝酸钠以及对苯二胺电化学和酶催化反应产物引起的的电极钝化.
1 实验材料
1.1 实验试剂
谷氨酸(北京奥博星生物技术有限责任公司),EDC(上海共价有限公司),其它试剂均为国产分析纯,1mol◦L-1H2SO4溶液,PBS(pH=7.0)缓冲溶液,0.02mol◦L-1L-谷氨酸,Fe电解液(5.0mmol◦L-1K3Fe(CN)6+5.0 mmol◦L-1K4Fe(CN)6+0.1 mmol◦L-1KCl)溶液:依次称取 1.6460 g K3Fe(CN)6,2.1142g K4Fe(CN)6,7.4587g KCl溶解在200mL的水中,然后定容至1000 mL.
1.2 主要仪器
AUTOLAB-PGSTAT12电化学工作站(荷兰),SZ-93自动双重纯水蒸馏器(上海),KQ-100型超声波清洗器(昆山),DHG-9076A型电热恒温鼓风干照箱(上海).
1.3 修饰电极的制备
1.3.1 自组装法修饰电极
裸电极处理:将玻碳电极在抛光布上抛光成镜面,在硫酸∶过氧化氢(7∶3)的混合液中煮沸5min,最后在超声波水浴中用二次石英重蒸水彻底清洗.
电极活化:在经过电极预处理后还需要用电化学方法进行电极活化.取25 mL烧杯,加入15mL 1 mol◦L-1H2SO4溶液,在室温下,采用电化学工作站,用循环伏安法活化,扫描电位区间为0~+1.5V,扫描速度为50mV/s,扫描圈数为20圈.
谷氨酸修饰电极:谷氨酸通过电化学方法在电极上聚合.在25mL烧杯中加入15 mL谷氨酸溶液,在室温下,采用电化学工作站,扫描电位区间为-0.8V~+1.8V,扫描速度为100 mV/s,扫描圈数为10圈.通过电化学聚合,电极表面上形成一层聚L-谷氨酸薄膜,即制成PGLA-GCE电极.
细胞色素C修饰电极:细胞色素C自组装法修饰电极是采用静电结合法,谷氨酸上的羧基与细胞色素C上的氨基通过静电吸引结合,以使细胞色素C附于电极表面.
在1.5mL离心管,用移液枪加入100μ L细胞色素C 溶液和200μ L和PBS,在4℃下,放置12h.通过此步骤,电极表面上形成一层聚L-谷氨酸和细胞色素C组合的薄膜,即制成CYTC-PLGA-GCE电极.
1.3.2 吸附法修饰电极
裸电极预处理步骤与自组装法修饰电极一样.细胞色素C吸附法修饰电极是利用壳聚糖把细胞色素C固定于电极表面.用氮气将经过预处理的玻碳电极表面吹干,用移液枪取一定量 0.5%壳聚糖与1mmol◦mL-1细胞色素C混合溶液滴于电极表面,于空气中倒置电极4h以上.在电极表面滴加Nifion溶液形成一层Nifion膜,放置5h后将电极置于PBS溶液中2h.
1.3.3 电化学测试
电化学测试在电化学工作站上进行.分别以修饰电极(裸电极)为工作电极,Pt电极为对电极,甘汞电极为参比电极,选择合适电解液(主要为Fe(CN)63-/4-与KCl混合溶液和PBS),进行电化学检测.
(1)循环伏安扫描.取25 mL烧杯,加入15 mL Fe(CN)63-/4-与KCl混合溶液作为电解液,组装电解池,扫描范围-0.2~0.6V,扫描速度100mV/s.
(2)PBS中信号响应.取25mL烧杯,加入15mL PBS,组装电解池,选择合适的扫描范围(本实验中发现-1.2~0.4V这一范围效果较好)和扫描速度进行循环伏安扫描.修饰完电极之后需要采用不同扫速进行扫描 ,一般为 20、50、100、150、200、250、300 和350mV/s.
1.3.4 细胞色素C修饰电极的催化性能
(1)自组装法修饰电极的催化性能.细胞色素C修饰电极对过氧化氢的响应:取25 mL烧杯,加入15 mL PBS(pH=7.4),以细胞色素C修饰电极为工作电极组装电解池,逐步加入一定量过氧化氢,每加入一次之后进行循环伏安扫描.扫描范围为-1.2~0.4 V,扫描速度200mV/s.在同样条件下对有聚合谷氨酸的电极进行对照试验.
细胞色素C修饰电极对亚硝酸钠的响应:取25 mL烧杯,加入15mL PBS(pH=5),以细胞色素C修饰电极为工作电极组装电解池,逐步加入一定量亚硝酸钠,每加入一次之后进行循环伏安扫描.扫描范围为-1.2~0.4V,扫描速度200 mV/s.在同样条件下对有聚合谷氨酸的电极进行对照试验.
(2)吸附法修饰电极的催化性能.细胞色素C修饰电极在PBS中的响应:取25mL烧杯,加入15 mL PBS(pH=7.4).以细胞色素C修饰电极为工作电极组装电解池,进行循环伏安扫描.扫描范围为-1.0~0.4V,扫描速度100mV/s.
细胞色素C修饰电极在含对苯二胺电解质溶液中的钝化:取25 mL烧杯,加入 15 mL PBS(pH=7.4)和150ul PPDA.以细胞色素C修饰电极为工作电极组装电解池,进行循环伏安扫描.扫描范围为-0.6~0.5V,扫描速度 100 mV/s,扫描30圈.在同样条件下对裸电极进行对照试验.
2 结果分析
2.1 自组装法修饰电极
2.1.1 裸GCE电极的信号表征
图1为玻碳电极在5 mM Fe(CN)63-/4-和0.1 MKCl混合溶液构成的电解质溶液中的循环伏安谱.扫描速度100mV/s,在0.236V和0.150V处出现一对可逆的氧化还原峰,峰电位差ΔEp=86mV.在理想状态下,裸电极的峰电位差为59mV,在实验条件下应尽可能接近此值.实验中要求此值小于90mV,才可使用电极,否则要重新处理电极,直到符合要求为止.图2为玻碳电极在浓度为0.02mol◦L-1磷酸缓冲溶液中的循环伏安.图中没有明显氧化还原峰,此图形用于与细胞色素C修饰电极所得循环伏安图做比对.
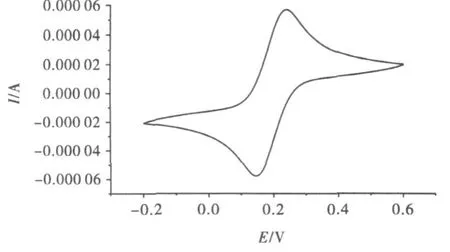
图1 玻碳电极的循环伏安谱
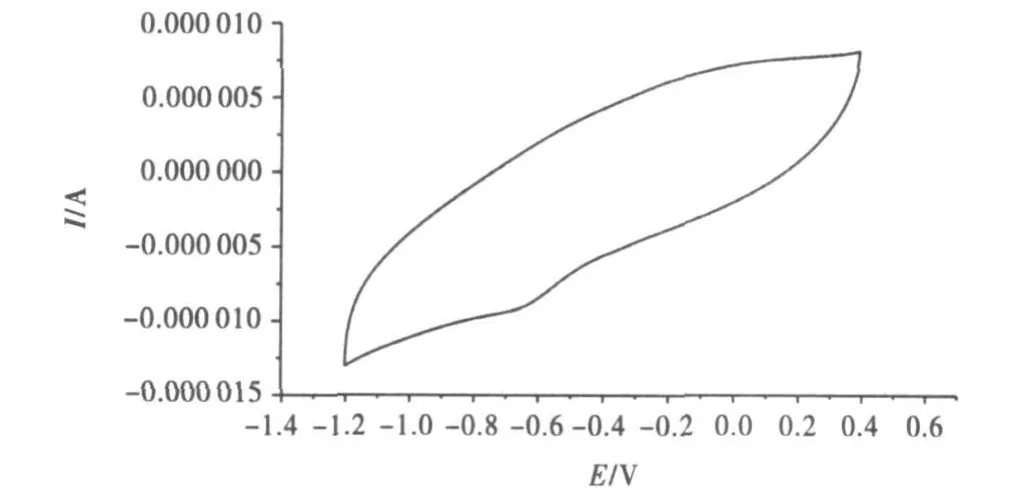
图2 玻碳电极磷酸缓冲溶液中的循环伏安
2.1.2 谷氨酸在电极表面的聚合
通过电化学聚合法所得循环伏安如图3所示,图形为聚合过程扫描10圈的组合图.由图可知随着聚合的进行,-0.12V处峰值逐渐增大,表明谷氨酸在电极上逐渐聚合.实验过程中发现谷氨酸的浓度对聚合效果有很大影响.当谷氨酸浓度过小时,有聚合谷氨酸的电极在PBS中进行响应得不到明显的氧化还原峰,说明聚合于电极表面的谷氨酸的量较小,聚合效果较差.此时应该加大谷氨酸的量,选择一个合适的浓度值.

图3 电化学聚合法所得循环伏安图
有聚合谷氨酸的电极在PBS中循环伏安响应,如图4所示.由图可知在-0.35V和-0.05V处出现一对明显的可逆氧化还原峰.有聚合谷氨酸的电极和裸玻碳电极在含Fe电解质液中的循环伏安图,如图5所示.由图可知,有聚合谷氨酸的电极相较裸玻碳电极氧化还原峰电流略微降低.

图4 聚合谷氨酸的电极在PBS中循环伏安响应
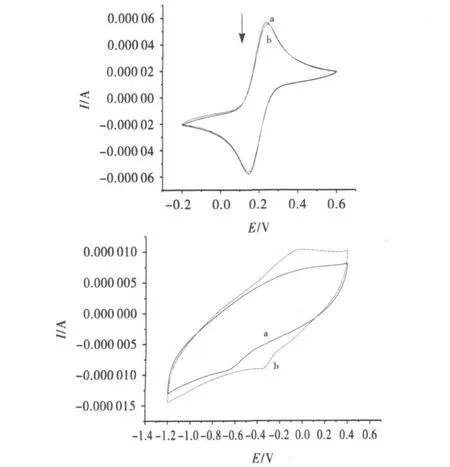
图5 聚合谷氨酸的电极和裸玻碳电极的电化学性能
2.1.3 细胞色素C修饰电极
(1)细胞色素C修饰电极的信号表征
图6中各曲线代表一定扫速时细胞色素C修饰电极在PBS中循环伏安响应图.图中显示,在-0.4 V和0.05V处出现一对明显的可逆氧化还原峰.这对氧化还原峰为电极表面细胞色素C活性中心的氧化还原峰.图7为裸玻碳电极、有聚合谷氨酸的电极和细胞色素C修饰电极在含Fe电解质液中的循环伏安比对图.图中显示细胞色素C修饰电极相较聚合有谷氨酸的电极氧化还原峰电流进一步降低,这说明细胞色素C已经修饰于电极之上,且经过细胞色素C修饰电极,电极表面阻抗进一步增大.
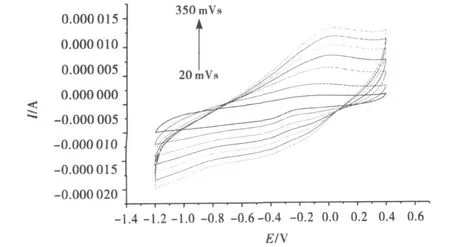
图6 细胞色素C修饰电极在PBS中循环伏安响应
(2)细胞色素C修饰电极的催化性能
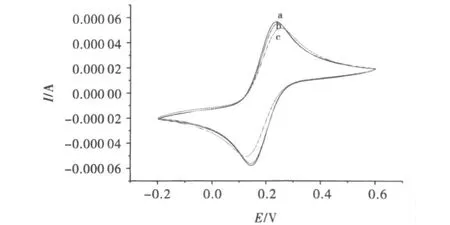
图7 修饰电极在含Fe电解质液中的循环伏安

图8 细胞色素C修饰电极对过氧化氢的响应
①修饰电极对过氧化氢的响应.细胞色素C修饰电极对过氧化氢的响应见图8.图中显示氧化峰消失,在-0.4V处出现一还原峰,且在一定的范围内,随着加入过氧化氢的量不断增加,还原峰增大.当加入过氧化氢浓度增大到一定程度时还原峰减小.图9为有聚合谷氨酸的电极对过氧化氢的响应图.图中显示氧化峰消失,在-0.35V处出现一明显还原峰,且在一定范围内,随着加入过氧化氢的量不断增加,还原峰增大.当加入过氧化氢浓度增大到一定程度时还原峰减小.表明在一定范围内,有聚合谷氨酸的电极可以用于检测过氧化氢,而且效果比较明显.比较有聚合谷氨酸的电极和细胞色素C修饰电极对过氧化氢的响应图可知,谷氨酸修饰电极对过氧化氢的反应要明显一些.因此若要检测过氧化氢,可直接使用谷氨酸修饰电极,实验方案更为简单,且价格相对低廉.
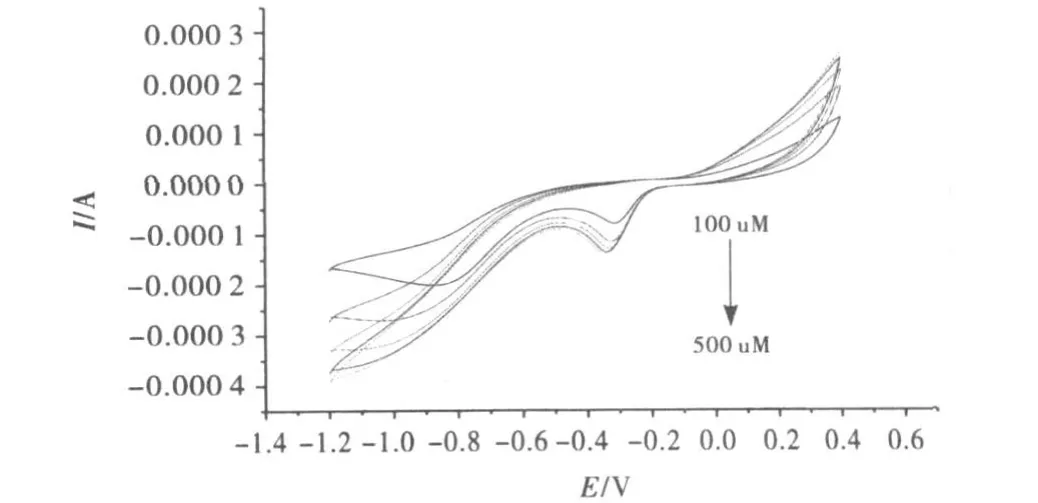
图9 有聚合谷氨酸的电极对过氧化氢的响应
②修饰电极对亚硝酸钠的响应.在酸性条件下,亚硝酸钠发生歧化反应生成NO.在图10中,随着亚硝酸钠的加入,细胞色素C修饰电极对亚硝酸钠的循环伏安响应图还原峰逐渐增加.由图可知,加入亚硝酸钠后,亚硝酸钠在溶液中反应生成一氧化氮,使得氧化还原电流增加.

图10 细胞色素C修饰电极对亚硝酸钠的循环伏安响应(左图为局部放大)
有聚合谷氨酸的电极在PBS中对不断加入亚硝酸钠响应图(图11)谱没有发生明显变化,说明有聚合谷氨酸的电极对一氧化氮没有明显反应.对照试验表明细胞色素C修饰电极对亚硝酸钠的响应是由于细胞色素C的催化作用.
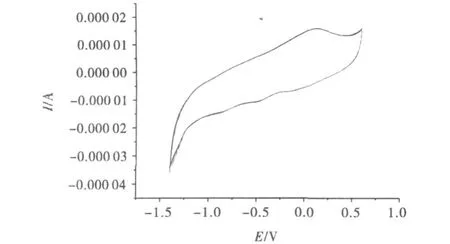
图11 聚合谷氨酸的电极在PBS(pH=5)中对不断加入亚硝酸钠响应图谱
(3)吸附法修饰电极
①细胞色素C修饰电极在PBS中的响应.用自组装法修饰电极在PBS中的响应所得循环伏安图在-0.4处出现一明显峰.此处用吸附法修饰电极,相应循环伏安图在相同位置出现一对氧化还原峰,而且出峰效果相对较好.但图形整体对称性不明显,不同的电极修饰方法所表现出的电化学性质存在着一定的差别.

图12 细胞色素C修饰电极在PBS中的响应
②细胞色素C修饰电极在含对苯二胺电解质溶液中的钝化.裸玻碳电极在含对苯二胺的电解质溶液的循环伏安见图13(a),随着圈数的不断增加,氧化还原峰逐渐减小,最后消失.在溶液中,对苯二胺氧化态物质与还原态物质相结合,在电极表面形成一层膜,阻碍电子传递,使得氧化还原峰逐渐减小.细胞色素C具有一定的电化学催化活性,图13(b)经细胞色素C修饰的电极在相同条件下没有出现电极钝化现象,在扫了30圈之后氧化还原峰没有明显减小.细胞色素C作为一种蛋白酶,能使对苯二胺处于氧化状态,从而防止电极表面膜的形成,避免电极钝化的发生.由图可观察到在-0.4V出现一还原峰,但随着圈数的增加,峰值逐渐减小并消失.这可能是电极表面结构发生了一定的变化,使得细胞色素C活性中心被覆盖,从而其相应的电化学反应受到抑制.相关文献在探讨酶催化作用对修饰电极在含对苯二胺电解质溶液中钝化情况时指出,所得循环伏安图显示一对新的氧化还原峰.这对氧化还原峰的存在是由于溶液中形成了可溶性的对苯二胺低聚物.
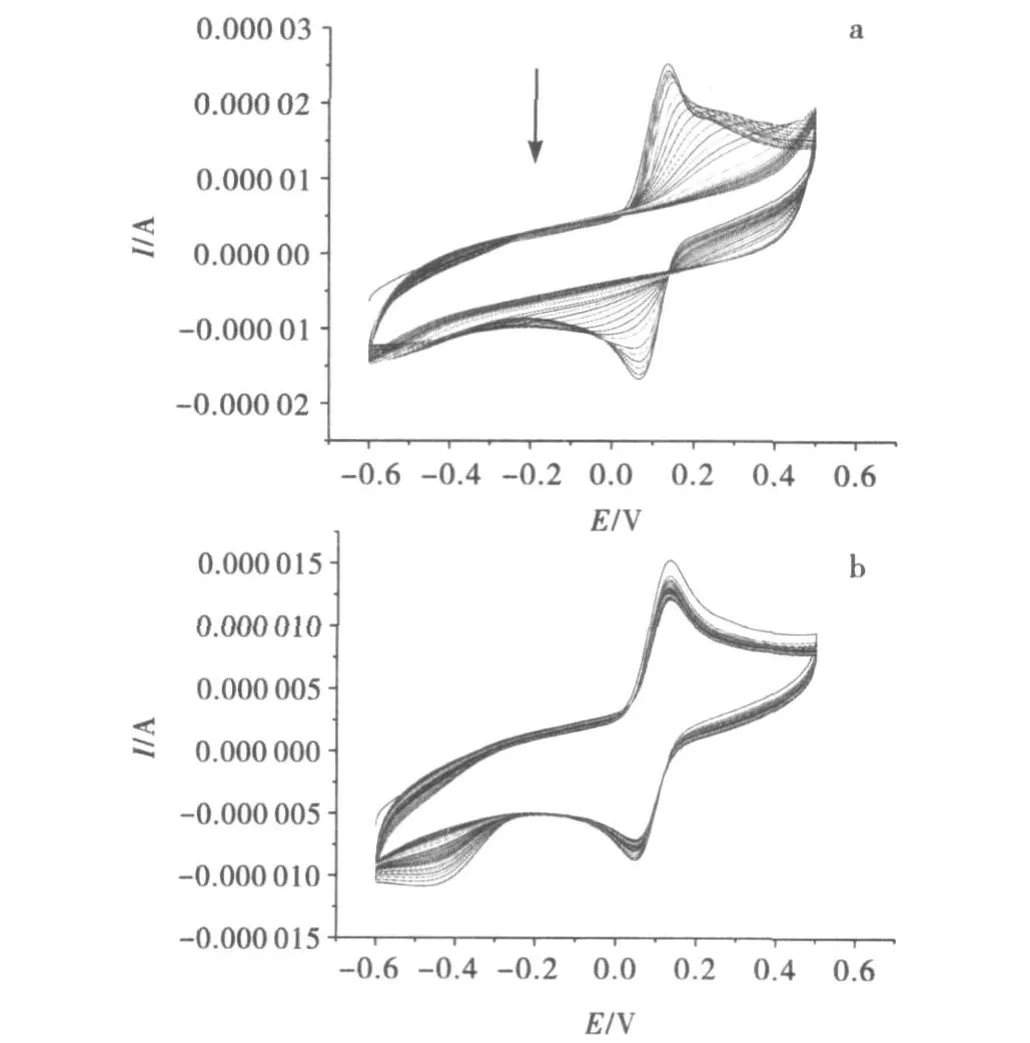
图13 裸玻碳电极(a)和细胞色素 C修饰电极(b)在对苯二胺的电解质溶液的循环伏安
(4)影响修饰电极钝化的因素
图14中每一条曲线表示一种对苯二胺浓度下细胞色素C修饰电极循环伏安图.由图可知对苯二胺浓度越大,氧化还原值越大.这说明溶液中电极反应形成的物质有助于电子传递.
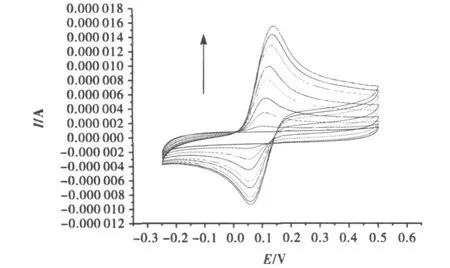
图14 PPDA浓度对修饰电极钝化的影响
3 结 论
(1)聚合谷氨酸的电极对过氧化氢具有一定的响应,所得循环伏安图在-0.35V显示一个还原峰,且在一定的范围内,随着加入过氧化氢的量不断增加,还原峰增大.在一定范围内,有聚合谷氨酸的电极可以用于检测过氧化氢,而且效果比较明显.聚合谷氨酸的电极对一氧化氮没有明显反应.
(2)细胞色素C修饰电极对过氧化氢响应与有聚合谷氨酸的电极对过氧化氢的反应相似.与细胞色素C修饰电极相比聚合谷氨酸的电极对过氧化氢的反应要明显.可直接使用谷氨酸修饰电极测过氧化氢,实验方案更为简单,且价格相对低廉.细胞色素C修饰电极对亚硝酸钠有反应.随着亚硝酸钠的加入,细胞色素C修饰电极对亚硝酸钠的循环伏安响应图还原峰逐渐增加.
(3)裸电极在含有中发生钝化,细胞色素C修饰电极可以避免对苯二胺电解质溶液对电极的钝化.在浓度一定的对苯二胺溶液中,随着扫速增大,电极钝化速度减慢.在不同浓度的对苯二胺溶液中进行试验,发现对苯二胺浓度越大,电极钝化速度越快.
[1]左少华.电化学生物传感器的制备和应用研究[D].上海:华东理工大学,2008.
[2]李业梅,代 月.生物传感器的应用和发展趋势[J].郧阳师范高等专科学校学报,2004,24(3):42-45.
[3]姜 燕.导电高聚物合成及生物传感器研究[D].扬州:扬州大学,2007.
[4]谢 英.血红蛋白在膜修饰电极的电化学行为及其信息分析[D].石家庄:河北师范大学,2007.
[5]周伟舫.电化学测量[M].上海:上海科学技术出版社,1985.
[6]曹楚南,张鉴清.电化学阻抗谱导论[M].北京:科学出版社,2002.
[7]田 娜.金/席夫碱自组装单层膜电化学行为研究[D].石家庄:河北师范大学,2002.
[8]Shan Wenjing,He Pingli,Hu Naifei.Electrocatalytic Reduction of Nitric Oxide and Other Substrates on Hydrogel Triblock Copolymer Pluronic Films Containinghemoglobin or Myoglobin Based on Proteindirect Electrochemistry[J].Electrochimica Acta.2005,51:432-440.

