GO/TiO2复合物的制备、表征及其光催化性能研究
钟 永 兰天龙 黄应平
(三峡库区生态环境教育部工程研究中心,湖北 宜昌 443002)
自1972年Fujishima报道了纳米TiO2在紫外光激发下光解水,此后对纳米TiO2光催化技术以及纳米TiO2的制备引起了人们的广泛关注[1].TiO2具有稳定性好、光效率高和不产生二次污染等特点,被认为是最有应用前景的光催化剂.但其仅对太阳光中5%的紫外光(λ<400nm)有作用,因此,如何使TiO2光响应范围从紫外光区扩展到可见光区已成为目前研究的重点[2-3].近年来国内外研究者们试图采用多种途径对其进行表面改性研究以提高其光催化效率[4].其中,氧化石墨因具有良好的层状结构,含有大量的极性基团和较大的比表面积[5],离子交换能力强等特点,易与有机聚合物形成插层复合材料进而改善材料的性能[8],这些特点无疑赋予了其良好的复合能力.目前,氧化石墨的制备方法已较成熟,但半导体/TiO2氧化石墨插层复合材料的研究才刚刚开始.因此,本文采用溶胶-凝胶制备了GO/TiO2复合物粉体,以罗丹明B(RhB)的光催化实验为探针反应,研究其光催化活性,与单纯TiO2相比,复合纳米粉末的光催化活性有了很大的提高,并且在弱酸性到中性范围内均有较好的光催化活性.通过用超氧化物岐化酶(Superoxide Dismutase,SOD)分光光度法测定了降解过程中的氧化物种,结果表明其光催化机理涉及到超氧根的高效氧化.研究发现,GO/TiO2复合物性能优异,有非常广阔的应用前景.
1 实验部分
1.1 主要实验试剂及仪器
钛酸四丁酯TBOT(AR);无水乙醇(AR);RhB:5.00×10-4mol/L水溶液;冰醋酸(AR);盐酸(AR);氧化石墨水溶液:1.725g/L(自制);1g/L辣根过氧化物酶(Horseradish peroxidase,POD)水溶液;10 g/L N,N-二乙基对苯二胺(N,N-diethyl-pphenylenediamine,DPD)水溶液;超氧化物岐化酶(SOD):0.035g/L的水溶液.实验所需的其它试剂均为分析纯;实验所用水均为二次蒸馏水.
TECNA I G220 S-Twin透射电子显微镜(TEM)(美国,FEI);D8 AdvanceⅡX-型射线衍射仪(XRD)(德国,B ruker公司);Lambda25紫外-可见光分光光度计(美国,PE);F-24500荧光仪(日本,日立);N/C 2100TOC分析仪(德国,耶拿).
光反应器自制:可见光光源为500 W的碘钨灯(佛山电器照明股份有限公司)置于一个圆柱形双层硬质玻璃冷凝套中,光反应时,通入自来水进行冷却.冷凝套外用滤光片(边长为5 cm)滤去λ<420nm的光,以保证反应只在可见光的激发下进行.在冷凝套两旁装有磁力搅拌器,正对滤光片的位置,以使反应瓶可更好的接受光强.反应器为70mL圆柱形硬质玻璃瓶,距光源约10cm.整个反应装制置于暗箱中,如图1所示.
1.2 实验方法
1.2.1 氧化石墨的制备
采用Hummers方法[9]用石墨、硝酸钠、浓硫酸和高锰酸钾来制备氧化石墨.然后配成1.725g/L的氧化石墨水溶液,在超声机中超声30 min后取出放置24h,取上清液配制250mL 1 mol/L的HCl氧化石墨溶液(GO/HCl)备用.

图1 可见光反应装置示意
1.2.2 氧化石墨复合纳米TiO2的制备及表征
GO/TiO2复合物粉体的制备:以钛酸丁酯为钛源,取一定比例的无水乙醇于烧杯中,形成A液,磁力搅拌.将1 mol/L GO/HCl溶液、冰醋酸按一定比例加入烧杯中混合均匀形成B液,分别将此溶液滴入上述含钛的溶液中,搅拌30 min,得到稳定的墨色半透明溶胶.静至陈化,完成溶胶-凝胶转化,然后放到80℃的电热烘箱内干燥,得到呈米粒状的松散黄色干凝胶.将干凝胶研磨成粉末于箱式电阻炉中进行1℃/min的程序升温至400℃,保温焙烧4 h后,随炉冷却,得到呈灰白色的复合粉体样品.将所得GO/TiO2复合物粉体用XRD、BET、TEM进行了初步表征.
1.2.3 光催化降解目标染料
在70mL圆柱形硬质石英瓶中,加入约1.0 mL 5.0×10-4mol/L的目标染料RhB定容到50mL,用高氯酸或氢氧化钠调节pH=3.00,然后加入30.0 mg催化剂.均匀混合后将其转入反应器中,暗反应30min后,开始加光并计时,间隙一定时间取样于Ep管中,高速离心,用紫外可见分光光度计在波长为554nm处测量其吸光度值,跟踪测定RhB吸光度值的变化.
1.2.4 光催化降解RhB条件优化
探讨不同pH对催化剂光催化活性的影响:实验了pH为1.00,3.00,5.00,7.00,9.00,11.00下RhB降解动力学情况;并在实验最佳pH下探讨催化剂的用量对催化性能的影响.
1.2.5 中间氧化物种的跟踪测定
◦OH和H2O2的测定:光催化体系中间氧化物◦OH和H2O2的测定分别按照文献[10]和[11]的方法进行.
光生空穴捕获:采用KI光催化氧化实验[12].在70mL圆柱形硬质石英瓶中,加入25mg催化剂,415 mg碘化钾,放入少量水用超声波震荡5min,再定容到50mL,均匀混合后将其转入反应器中,暗反应30 min后,开始加光并计时,间隔一定时间取样于Ep管中,高速离心,滤膜过滤除去催化剂,得到的滤液稀释5倍后再倒入石英比色皿中,于288 nm处I3-的最大吸收峰值用来表示不同催化剂的空穴氧化能力,以其在相同条件下测定不加催化剂的空白对比实验.
◦-O2捕获:在70mL圆柱形硬质石英瓶中,加入约1.0mL 5.0×10-4mol/L的目标染料RhB定容到50mL,用氢氧化钠调节溶液pH至7.0,加入2.5 mL 0.035g/L的SOD溶液,然后加入30.0mg催化剂.均匀混合后将其转入反应器中,暗反应30 min后,开始加光并计时,间隙一定时间取样于Ep管中,高速离心,用紫外可见分光光度计在波长为554 nm处测量其吸光度值,跟踪测定RhB吸光度值的变化.
2 结果分析
2.1 透射电镜分析
图2为采用Hummers方法制备的氧化石墨(2)和在程序升温400℃灼烧得到了锐矿型纯TiO2(1)和纳米复合 TiO2粉体(3)(4)(5)透射电子显微镜(TEM)图片,由图比较,相同条件制备的空白样纯TiO2颗粒较大,易团聚,催化活性较差,而制备的复合TiO2粉体颗粒细小,有良好的分散性,当氧化石墨复合量增加一定程度时仅极少数团聚.极佳的分散性和较小的粒径对于促进光催化剂的界面反应,提高光催化活性有着显著作用.

图2 不同复合量TiO2的TEM
2.2 不同氧化石墨复合量下制备的纳米 TiO2的XRD分析
图3是不同氧化石墨复合量下制备的纳米TiO2的X射线衍射谱图,从图3可知,在25.33°,37.84°,48.08°,54.00°,62.91°处有锐钛矿相的特征衍射峰.利用Ceantitative公式

式中,KA=0.886,KB=2.721,AA为锐钛矿101的衍射峰的强度,AR为金红石110晶面的衍射峰的强度,AB为板钛矿121晶面的衍射峰的强度.可计算出混晶结构中锐钛矿相和金红石相的质量分数,表明所得TiO2为完整的锐钛矿相[13].利用 Scherrer公式:Davg=kλ/βcosθ,式中 D 为晶粒大小,单位为 nm;λ为X射线波长(λ=0.15405nm);K为常数(K=0.89);θ为布拉格衍射角,β为衍射角的半高峰宽,计算粉体的平均晶粒尺寸[12].不同氧化石墨复合量的条件下制备的TiO2平均晶粒尺寸分别为11.42 nm、11.64 nm和12.45nm.可见,氧化石墨复合后TiO2粉体平均晶粒尺寸的影响不大.
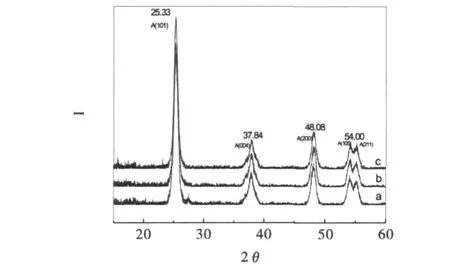
图3 不同氧化石墨复合量下制备的纳米TiO2的XRD
2.3 物理吸附性能测试
不同氧化石墨复合量下制备的纳米TiO2与纯TiO2对N2吸附脱附等温线如图4所示.曲线对应于BDDT分类中的typeⅣ等温曲线和type H3滞后回线[14].从图4可知在中等的相对压力中孔毛细凝聚填满后,GO/TiO2还有比纯TiO2大孔径的孔,可能继续吸附形成多分子层(曲线b),因而吸附等温线继续上升,之后出现一吸附终止平台,并不发生进一步的多分子层吸附.GO/TiO2与纯TiO2表面结构参数由氮气吸附解附等温线计算见表1.
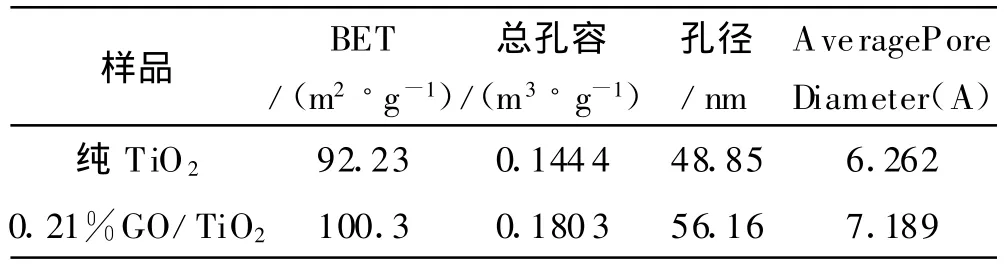
表1 G O/TiO2与纯 TiO2表面结构参数


图4 GO/TiO2与纯TiO2的孔径分布和等温吸附曲线
2.4 催化剂的发散光谱分析
图5是300 nm处受到激发时发射产生的荧光谱图.从图5可见,纯TiO2和氧化石墨复合后的TiO2在紫外光的照射下,电子受激发跃迁到激发态后,重新回到基态而发散能量,并在420nm和460nm处产生荧光.由于氧化石墨复合后,激发的电子被转移,从而使返回到基态的电子减少,发散的能量减少,荧光强度降低.在可见光光催化实验中,TiO2在可见光的激发下没有产生光生电子和光生电子空穴,从而得出氧化石墨复合量下制备的纳米TiO2使得氧化染料,使其降解是敏化机理.
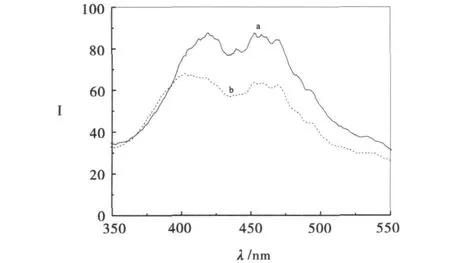
图 5 GO/TiO2与纯TiO2的荧光谱图
2.5 氧化石墨的电化学性能
图6不同复合纳米TiO2附着在玻碳电极上,在1mol/L H2SO4电解液中,电极扫速为0.1 V/s的循环伏安图.从该图可以看出,所制备复合氧化石墨量的催化剂在0.29V和0.45V处出现了较为明显的氧化还原峰.在0~1.0V之间以恒流10μ A对不同复合氧化石墨量的纳米TiO2进行多次循环充放电,发现的复合氧化石墨量少的充放电性能最优越,多次循环后仍呈现出良好的三角形对称性,而且电位与时间基本呈线性关系,表明复合氧化石墨后的纳米TiO2电容特性较为稳定.
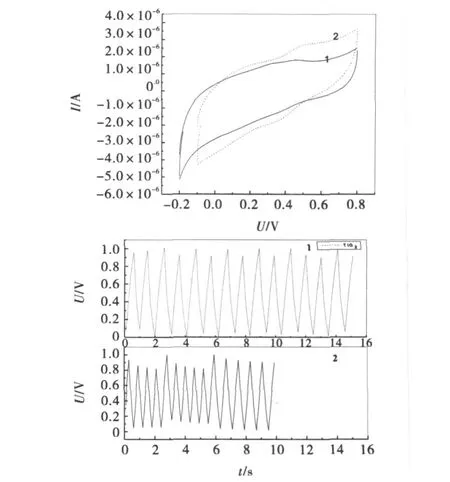
图6 复合纳米TiO2的循环伏安(A)和恒流充放电(B)曲线
2.6 不同氧化石墨复合量对催化剂催化活性的影响
按照1.2.2的方法,在相同条件下,通过改变钛酸丁酯与HCl的GO溶液的体积比来调节氧化石墨的不同复合量制备催化剂,并用来降解RhB,结果如图7所示.从图7可知:5种不同复合量的氧化石墨制备的GO/TiO2与不加氧化石墨制备的TiO2在可见光照射下光催化降解RhB的反应动力学常数分别为 ka=2.54×10-3min-1;kb=3.25×10-3min-1;kc=4.56×10-3min-1;kd=15.66×10-3min-1;ke=23.79×10-3min-1;kf=3.01×10-3min-1.数据表明,不同复合量的氧化石墨制备的GO/TiO2活性不同,随着复合量的增加,GO/TiO2活性提高,当GO复合量为0.35%(ke)时,活性最佳,之后,随着GO复合量继续增加,活性降低.

图7 不同复合催化剂对RhB的降解
2.7 pH对RhB降解的影响
在可见光照射下,TiO2/GO光催化降解RhB过程中pH值的影响如图8所示.实验结果表明,不同pH值条件下,复合催化剂的光催化活性有所不同.在pH=6.70时,RhB降解效果最好,随着pH值的增大RhB的降解速率递减.实验结果表明,GO/TiO2体系降解RhB在pH=6.70的条件下复合催化剂光催化活性效果最佳,这可能与催化剂表面的电荷密度有关,并且在弱酸性到中性范围内有较好的光催化活性.所以本试验选择在pH=6.70值,探究复合催化剂的光催化性能.

图8 pH值对光催化降解RhB的影响
2.8 催化剂用量的影响
催化剂用量对降解速率的影响见图9,在pH=7.00的条件下,催化剂用量增加可以促进反应进行,但过多的催化剂反而降低了催化效果.因为催化剂的过量加入会对光的吸收产生屏蔽效应,不利于光子的有效吸收.实验选择GO/TiO2催化剂最佳用量是0.6 g/L.

图9 催化剂用量对光催化降解RhB的影响
2.9 中间氧化物种的检测
采用苯甲酸荧光光度的方法测定了中间可能产生的氧化物种羟基自由基,并用F-4500荧光分光光度仪测定时,实验发现并没有荧光物质生成.为进一步确认氧化机理,又采用KI光催化氧化实验方法用UV-Vis分光光度计测定288nm处I3-的吸光度,来反映I3-的产量,并以此来扑获催化剂的光生空穴.实验发现在288nm处I3-的吸光度很小,几乎没有吸收.因此,GO/TiO2催化剂产生的空穴较少,这一点与未检测到荧光物质是一致的.随后按照文献[11]的实验方法进行H2O2浓度的跟踪测定,结果如图10所示.图中是GO/TiO2/RhB体系中H2O2的产生与分解的动力学曲线,从图中可知光催化体系产生了部分的H2O2,0~120 min为H2O2的累计阶段,120 min以后H2O2迅速被分解.
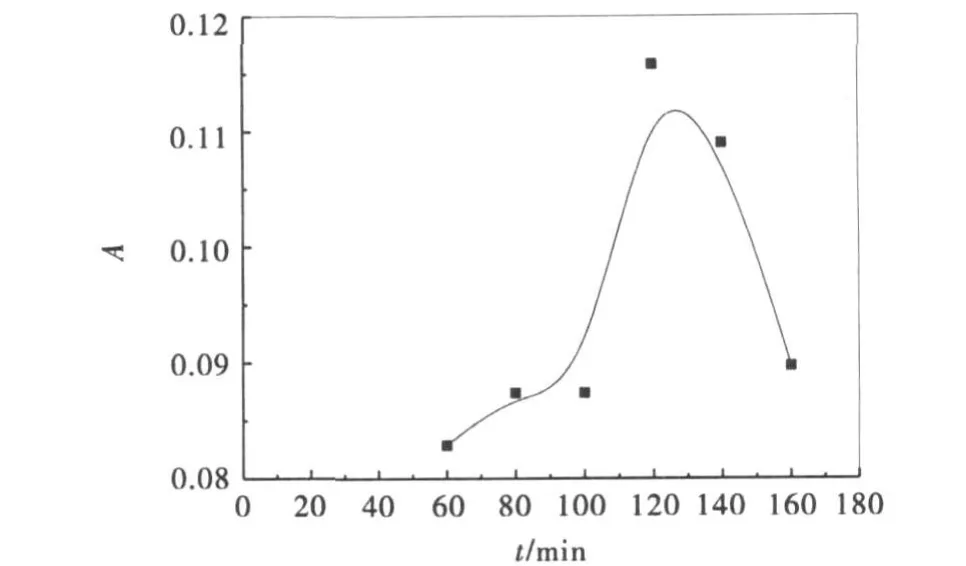
图10 RhB降解过程中的H2O2跟踪测定
为进一步探究氧化机理,实验又采用SOD来捕获◦O2-.图11是加入SOD后与没加SOD的催化剂降解 RhB的动力学曲线.从图可知,GO/TiO2/RhB体系 120 min脱色率已达到 100%,而 GO/TiO2/SOD/RhB体系脱色率只有60%.加入SOD溶液后催化剂的催化效率明显降低.从而得出GO/TiO2/SOD/RhB体系催化降解机理为敏化,中间氧化物种涉及到◦O2-.

图11 RhB降解过程中◦O2-的测定
2.10 催化剂循环
图12将GO/TiO2催化降解RhB后回收继续降解染料,5次循环后的图.从图中可知回收后GO/TiO2体系的催化活性有所降低,平均每次循环推迟1 h,5次循环后7h降解率几乎达到100%,表明GO/TiO2体系易回收,且回收后催化性能稳定.
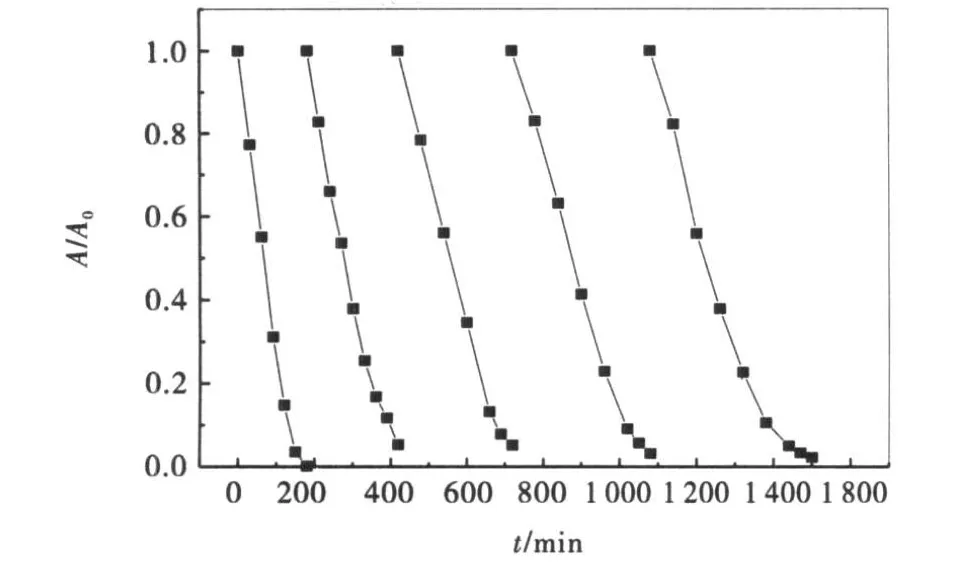
图12 催化剂循环使用对光催化降解RhB的影响
3 结 论
本文通过溶胶-凝胶法,在VTBOT∶VGO/HCl=10∶5条件下制备了GO/TiO2粉体,并在 1℃/min程序升温到400℃灼烧4 h得到了完整的锐钛型.GO/TiO2具有下列特征:(1)纳米尺寸较小,晶粒粒径为11.64nm,由于氧化石墨引入增加了TiO2的孔径和比表面积,使得TiO2颗粒分布均匀,从而提高了纳米TiO2对可见光的光谱响应,减少了光生电子的复合效率,弥补了TiO2光催化剂的不足;(2)GO/TiO2体系在弱酸性到中性范围(pH=5~7)内有较好的光催化活性,催化剂的用量少(0.6g/L),在可见光照射的条件下,将其用于光催化降解罗丹明B,降解率为120 min达到100%;(3)GO/TiO2体系充放电性能优越,电容特性稳定,多次循环后仍呈现出良好的三角形对称性,而且电位与时间基本呈线性关系;(4)GO/TiO2/RhB体系催化降解机理为敏化,中间氧化物种涉及到◦O2-;(5)GO/TiO2体系体系易回收,且回收后催化性能稳定.
[1]Fujishima A,Hondo K,Electro Chemical Photolysis of Water as Semiconductor Electrode[J].Nature,1972,37(1):238-245.
[2]籍宏伟,马万红,黄应平,等.可见光诱导TiO2光催化的研究进展[J].科学通报,2003,48(21):2199-2204.
[3]冯光建,刘素文,修志亮,等.可见光响应型 TiO2光催化剂的机理研究进展[J].稀有金属材料与工程,2009,38(1):185-188.
[4]陈小景,张胜义,王子涛,等.TeO2/TiO2纳米复合物的制备与表征[J].安徽大学学报:自然科学版,2007,31(4):58-60.
[5]周文明,贺蕴秋.氧化石墨插层纳米复合材料的制备研究进程[J].材料导报,2007,21(Ⅸ):204-213.
[6]邹艳红,刘洪波,傅 玲,等.氧化石墨在H2还原过程中的结构与性能变化[J].中国有色金属学报,2005,15(6):940-945.
[7]Xiao Min,Du Xusheng,M eng Yuezhong,et al.The Influence of Thermal Treatment Conditions on the Structures and ElectricalConductivities of Graphite Oxide[J].New Carbon Materials,2004,19(2):92-96.
[8]Singh V K,Patra M K,anoth M M,et al.Insitu Synthesis of Graphene Oxide and Its Composites with Iron Oxide[J].New Carbon Materials,2009,24(2):147-152.
[9]Graeme Williams,Brian Seger,Prashant V.K amat.TiO-Graphene Nanocomposites UV-Assisted Photocatalytic Reduction of Graphene Oxide[J].Nano,2008,2(7):1487-1491.
[10]姜利荣,赵 超,黄应平,等.可见光照射下α-FeOOH 光催化降解有机污染物的研究[J].环境化学,2007,26(4):434-437.
[11]杨 静,邓安平,黄应平,等.纳米 TiO2低温制备及光催化降解有毒有机污染物[J].分子催化,2009,23(2):178-184.
[12]沈晶晶,刘 畅,朱育丹,等.介孔 TiO2的水热法制备及其光催化性能[J].物理化学学报,2009,25(5):1013-1018.
[13]Zhang Hengzhong,Banfield Jillian F.Understanding PolymorphicPhase Transformation Behaviorduring Growt Nanocrystalline Aggregates:Insights from TiO2[J].J.Phys.Chem.B.,2000,104:3481-3487.
[14]辛 勤,罗孟飞.现代催化研究方法[M].北京:科学出版社,2009.

