内毒素对大鼠肺泡Ⅱ型上皮细胞的损伤作用
杨华 侯勇 唐云安
(四川中医药高等专科学校基础部生理教研室,四川 绵阳 621000)
急性肺损伤(Acute lung injury,ALI)是严重的休克、感染、创伤和中毒等多种因素所导致的急性弥漫性肺泡和肺血管内皮细胞的损伤,严重阶段即为急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS),死亡率高达40~60%。肺泡Ⅱ型上皮细胞(Alveolar type II cell,AT-II)损伤是其发病过程中的重要环节之一。AT-Ⅱ是肺泡表面一类重要的细胞群体,合成和分泌肺表面活性物质,补充和分化肺泡Ⅰ型上皮细胞,修复肺泡上皮、肺水转运、局部免疫等多种重要生理功能,对维持肺泡结构和功能有重要意义[1]。该细胞损伤是ALI发病过程中的重要环节之一。脂多糖(LPS)是内毒素的主要生物活性成分,具有极强的生物活性,肺是内毒素的主要靶器官之一。现已明确革兰阴性菌感染、内毒素血症是ALI主要致病原因之一,但是LPS是否对AT-Ⅱ有损伤作用还存在较大争议,我们拟通过动物实验证实LPS对AT-Ⅱ的损伤作用,从而进一步揭示ALI的发病机制。
1 材料和方法
1.1 材料 成年SD大鼠 18只,200~250g,雌雄各半,由四川大学华西医学中心实验动物中心提供,动物合格证号:SCXK(川)2005001;LPS(Sigma);碱性磷酸酶(AKP),乳酸脱氢酶(LDH),丙二醛(MDA)试剂盒(南京建成生物工程研究所);磷标准溶液由四川大学华西医学中心预防系营养与食品卫生学教研室提供;7252C型紫外可见分光光度计(上海第三分析仪器厂生产)。
1.2 方法
1.2.1 动物模型 18只SD大鼠随机分为2组:对照组以及LPS模型组(n=9),分别经颈外静脉导管注入等容积生理盐水以及LPS 2 mg◦kg-1复制大鼠急性肺损伤模型。
1.2.2 手术及标本采集 大鼠腹腔注射200g◦L-1乌拉坦5mL◦kg-1麻醉后固定于鼠板,沿颈部正中切开皮肤,分离一侧颈外静脉,插入导管给药。给药后4h行颈椎脱臼处死并行气管插管术,以4℃生理盐水20ml◦kg-1进行支气管肺泡灌洗,连续3次,取第1次灌洗所得肺泡灌洗液(BALF)0.2ml用于表面张力的测量;收集所有BALF并记录BALF回收量达到90%,1000 r◦min-1离心 10min,取上清1.4ml用于测AKP、MDA、LDH和总蛋白(TP)等,剩余上清用于磷脂的提取。
1.2.3 肺组织的光镜观察 取右肺下叶,以40ml◦L-1甲醛固定,石蜡包埋切片,HE染色,光学显微镜观察。
1.2.4 BA LF中 AKP、MDA、LDH和 TP的测定 根据试剂盒说明采用放免法测定BALF中AKP、MDA和LDH的含量,采用考马斯亮蓝G2250染色法测定TP含量。
1.2.5 总磷脂(TPL)的测定 采用Bartlett法[4]略有改进。BALF中加入2倍体积的氯仿-甲醇(2∶1,V/V)萃取液,震荡1min,2500 r◦min-1离心 10min,弃上层液体但不弃界面杂质,加入1/4体积的甲醇-水(1∶1,V/V)萃取液,震荡 1min,2500 r◦min-1离心10min,弃去上层液及界面杂质,氮气吹干,-20℃保存待测。将TPL加入1ml高氯酸加热,温度由低到高逐渐上升,直至颜色由黑变白后继续加热蒸干。磷钼蓝比色法测定样本中无机磷含量,根据磷脂中磷含量约为4%算出磷脂含量,再计算出每公斤体质量的磷脂含量。
1.2.6 表面张力的测定 用毛细管法测定肺泡BALF表面相对张力,然后根据拉普拉斯方程σ=rρ g(h+r/3)/2计算出BALF的表面张力,以此来反映PS的含量及功能。其中,σ为表面张力(单位为N◦cm-1),r为毛细管的半径,ρ为液体密度,g为重力加速度,h为液体上升高度。
2 结果
2.1 LPS对肺组织的损伤作用
LPS可升高BALF中TP含量、MDA含量以及LDH活性(见表1)。光镜下可见LPS组大鼠肺间质较对照组明显增宽,有白细胞浸润,肺泡萎陷、肺不张,肺泡腔偶见红细胞,表现为间质性肺水肿(图1)。
表1 脂多糖对肺组织及肺泡Ⅱ型上皮细胞的损伤作用(±s,n=9)

表1 脂多糖对肺组织及肺泡Ⅱ型上皮细胞的损伤作用(±s,n=9)
*模型组与对照组比较P<0.05;**模型组与对照组比较P<0.01。
组别 对照组 模型组LDH(ukat◦L-1) 4.7±1.9 8.2±1.9*TP(g◦L-1) 29±16 85±31**MDA(μ mol◦L-1) 1.3±0.3 2.1±0.8*AKP(nkat◦L-1) 102±81 256±101**表面张力(mN◦m-1) 19.60±2.5 23.12±2.8*TPL(μ g◦kg-1) 432±43 370±57*
2.2 LPS对AT-Ⅱ的损伤作用 LPS可使BALF中AKP活性升高近4倍,使BALF中TPL含量明显下降,表面张力明显升高(表1)。
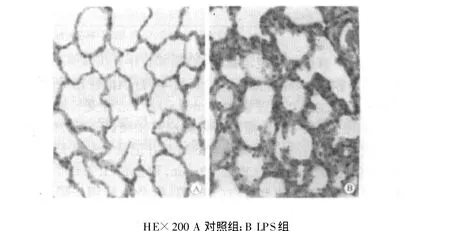
图1 大鼠肺组织的病理改变
3 讨论
革兰氏阴性菌感染、内毒素血症是引发急性肺损伤/急性呼吸窘迫综合征的常见原因。正常生理情况下,AT-II主要分泌大量的肺表面活性物质参与肺组织成熟和肺的正常生理功能,其损伤是ALI/ARDS发病过程中的重要环节之一。ALI时LPS是否对AT-Ⅱ有损伤作用还存在较大争议。本研究发现,颈外静脉注射LPS后大鼠肺组织出现明显肺损伤病理形态变化,LPS可使BALF中TP含量升高,表明肺泡渗出增加;LDH是胞内酶,LPS组BALF中LDH活性增加表明细胞损伤加重;LPS组BALF中MDA含量升高,提示脂质过氧化作用增强。上述4项指标变化符合急性肺损伤表现,表明LPS性急性肺损伤模型复制成功。AKP是A T-Ⅱ的特异性分化标志,当AT-Ⅱ损伤时被释放入BALF,LPS使BALF中AKP活性增强,表明其对AT-Ⅱ有损伤作用;磷脂是PS的主要成分,TPL能反映PS含量变化,我们利用定磷法测量BALF中TPL含量,结果表明LPS可使BALF中TPL含量降低;表面张力反映了PS降低肺泡表面张力的功能,是AT-Ⅱ合成、分泌PS的质和量的综合体现。综合TPL及表面张力的变化,表明LPS可以抑制PS的合成、分泌,其机制可能为内毒素血症时肺血流阻力增加,肺组织缺血、缺氧,引起 AT-Ⅱ损伤,进而影响PS的合成、分泌;也可能是LPS对AT-Ⅱ有直接损伤作用[2],进而使PS合成和分泌减少,具体作用机制尚有待于进一步研究。另外LPS导致AT-II损伤后可能还会引起合成肺表面活性物质蛋白(Surfactant protein,SP)能力下降[3],也有待进一步研究。
1 Adamson IY,Young L.Alveolar typeⅡcell growth on pulmonaryendothelial ex tracellular matrix[J].Am J Physiol,1996,270(6 Pt 1):1017-1022.
2 许峰,何勇,匡凤梧,等.急性肺损伤大鼠肺表面活性物质及肺表面活性物质蛋白的研究[J].重庆医科大学学报,2004,29(2):131-133.
3 刘静,王正晖,何立英,等.急性肺损伤对大鼠肺表面活性物质蛋白C合成的影响[J].中国急救复苏与灾害医学杂志,2008,3(2):79-81.

