卫生技术评估:德国视角
卫生技术评估:德国视角
德国 卫生技术评估(HTA) IQWiG
自20世纪90年代末以来,卫生技术评估(Health Technology Assessment,HTA)在德国引起了广泛讨论,这与循证医学的产生是密切相关的。在德国进行技术评估的论点首先由“国会技术评估办公室”提出。随后Hanover医学院进行的一个科学项目进一步支持了需要进行技术评估的论点[1],该项目旨在评估在德国卫生保健系统中HTA评估的应用与收益。1997年,德国成立了卫生保健技术评估科学工作组,该工作组的目的是建立一个当前可获得的各种HTA技术的数据库,以及对HTA的方法进行改进。该项目组成员包含来自各大学的科学家和法定健康保险(Statutory Health Insurance,SHI)机构的代表,项目由联邦政府资助,并受德国医学文献和情报学会(German Institute for Medical Documentation and Information,DIMDI) 的监督指导。该项目于2001年完成。伴随着德国2000年的卫生保健改革,HTA在德国得到了正式确立。卫生保健改革包括建立数据库的任务和一项与DIMDI合作的HTA相关科学工作计划。同年,德国卫生技术评估局(Deutsche Agentur für Health Technology Assessment,DAHTA@DIMDI)成立,隶属于DIMDI。在德国卫生保健技术评估科学工作组所做工作的基础上,HTA的原则与方法不断为众多决策制定机构所采纳,如联邦联合委员会(Gemeinsamer Bundesausschuss, G-BA)。
本文的第一和第二部分描述了在德国进行HTA评估涉及到的组织以及这些组织进行HTA评估的程序。第三和第四部分讨论了目前评估中存在的问题和HTA的应用。第五部分描述了德国HTA的相关经验。
一、德国HTA的相关组织
在德国的HTA评价中,最重要的组织机构是G-BA、卫生保健质量与疗效研究院(Institut für Qualität undWirtschaftlichkeit im Gesundheitswesen,IQWiG)和DIMDI。其他组织机构包括SHI的医疗服务负责人协会(Medizinischer Dienst der Spitzenverbände,MDS)、国家SHI内科医师协会(KassenärztlicheBundesvereinigung,KBV)和以高校为依托的各种协会,以及在德国进行HTA的其他组织。
(一)联邦联合委员会(G-BA)
G-BA是德国所谓的自我管理体系中的最高决策机构。G-BA中包括了来自内科医生、牙科医生、医院、疾病基金会和患者的各方代表。G-BA发布各种指令,由它决定SHI所覆盖的700万人群的报销服务包。G-BA负责做出报销决策。
同许多国家一样,在德国,国会设定提供卫生保健服务的法定框架,G-BA发布标准化的具有约束力的指令,从而使这些法定框架转化为实践。由G-BA发布的指令对医疗保险人群,以及包括医生、医院、疾病基金会在内的卫生保健提供者都具有法定约束力。这些指令对药物、诊断、治疗过程、医疗器械和非医学治疗的提供和报销做出了相关规定。
G-BA职责的一个重要组成部分是对新的诊断和治疗方法(如果医疗器械属于方法的一部分,则包含医疗器械)进行评估。在门诊治疗中,每种新治疗方法都要经过G-BA的明令批准。在住院治疗中,如果G-BA没有将一种治疗方法从SHI的使用范围中排除,则这种治疗方法即被认为是可以使用的。G-BA依据循证医学原理而建立的标准化程序对新治疗方法和操作过程进行评价。不仅IQWiG能够进行评价,G-BA也能够在其能力范围内对新的诊断和治疗方法进行评价。在当前人们所掌握的医学知识基础上,G-BA对需要评价的治疗方法的疗效、质量和经济性进行评估。在经济性评估中对收益的评估程序参见图1。
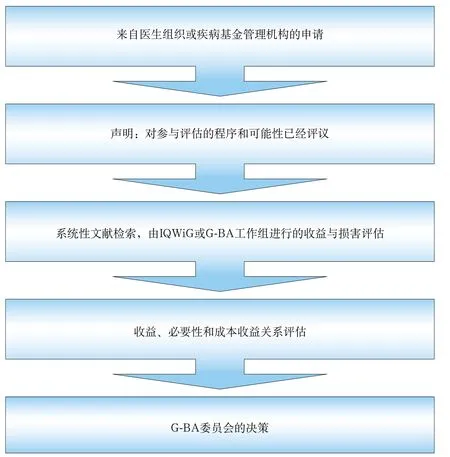
图1 G-BA的收益评估程序[2]
G-BA的评估程序原则(Verfahrensordnung)对评估的程序规则进行了说明。除药物外,这种评估对在诊断和治疗领域建立报销类别也是十分重要的。不过,这些情况G-BA也可以委托IQWiG进行评估。
(二)卫生保健质量与疗效研究院(IQWiG)
2004年,G-BA依据一项新法规[Gesetzliche Krankenversicherung (GKV)— Modernisierungsgesetz]建立了一个独立的评价机构——IQWiG。IQWiG代表G-BA或卫生部(MoH)对诊断、治疗方法与药物的疗效、质量和效果进行评价。IQWiG的技术评价结果用于为G-BA制定决策提供信息参考。但其评价结果并不能决定G-BA的最终决策。
(三)德国医学文献与情报学会(DIMDI)
DAHTA@DIMDI开发与维护信息系统和专业化数据库,并撰写HTA报告。这些报告最初的目的是为卫生政策决策提供信息,并非建立不同的报销等级类别。IQWiG也可能委托DIMDI进行评估,但由IQWiG进行的收益评估和由DIMDI进行的各种HTA是有区别的。
由于预算有限,科学评估的主题需要基于德国卫生保健系统内所有相关团体讨论,经过选择和确定优先顺序后纳入HTA项目。对主题的选择过程参见图2。HTA理事会(由保险公司、医院、医生组成,另外还包括护士、患者、消费者代表以及来自IQWiG和企业的观察员作为补充)设定研究主题的优先顺序,并决定多级程序中未来研究报告的主题。

图2 DIMDI进行卫生技术评估(HTA)的过程[3].
(四)医疗服务负责人协会中的循证医学组织(MDS)
SHI的其他组织也可以发布HTA报告,如SHI 的医疗服务负责人协会中的循证医学组织MDS。该组织为SHI的疾病基金会服务,撰写综述和HTA报告为疾病基金会的决策提供信息。这些评估均遵循内部标准进行,内部标准是不对外公开的。由MDS发布的HTA可以看作是地方疾病基金会的医疗服务指南和疾病基金会决策指南,例如个别基金申请纳入尚未被报销服务包所覆盖的诊断或治疗方法。
(五)国家SHI医师协会(KBV)
对新诊断或治疗方法的评估是将该方法纳入报销目录的必要条件。自1996年起,国家SHI医师协会(KBV)即开始进行这种评估,当时政府尚未正式引入HTA。该组织现在是进行医疗机构创新和收益评估的部门(KBV部门)。KBV进行评估的目的是支持内部决策,或作为G-BA的成员之一支持G-BA的工作。
(六)其他组织
MDS和KBV组织均被视为德国HTA的先驱,而且目前仍然存在。在德国卫生保健系统中还有其他进行评估的组织。例如国家医师协会(National Association of Physicians)、Allgemeine Ortskrankenkassen科学研究院和Techniker Krankenkasse科学研究院。这些组织在HTA中不带有官方色彩。
目前,越来越多的高校正逐渐参与到HTA中。他们的关注点主要集中于HTA的方法论研究和培训进行或应用HTA的相关人员。另外,循证医学、流行病学、社会医学或公共卫生方面的科学协会也成立了HTA工作组或HTA专门兴趣组。他们的关注点主要集中于HTA中的多学科研究方法,以及这个领域的研究方法论。该领域的相关参与者还包括德国社会医学与预防协会(Deutsche Gesellschaft für Sozialmedizin und Prävention,DGSMP)、德国循证医学网络(Deutsches Netzwerk für Evidenzbasierte Medizin,DNEbM)、德国医学信息学会以及生物信息统计学与流行病学协会(GMDS)。
所有这些组织都可能对G-BA的决策制定产生影响。但G-BA决策制定的真正基础是其亲自进行的评估(诊断、医疗器械)或IQWiG为SHI或其客户服务进行的评估(主要是药品)。与之不同的是,DAHTA@DIMDI的服务对象范围更广,且G-BA和IQWiG必须遵守的规则对其没有约束力。
二、德国HTA程序
随着HTA的不断发展和在德国进行HTA的相关人员素质和数量的提高,要保证德国HTA的质量,就需要研究制定HTA指南。DIMDI、IQWiG进行了HTA指南及HTA评估程序的制定,G-BA也要遵守指南的规定。
(一)德国医学文献和情报学会(DIMDI)进行HTA的程序
DIMDI在上述已确定优先研究顺序的基础上进行HTA的委托评估。由DIMDI的委托人根据DIMDI确定的方法进行HTA。这些方法发布在DIMDI的一份文件中,该文件名为“Handbuch für Autoren zur Erstellung von HTABerichten”[4]。该文件定期更新。文件内容包括处理所需内容的方法、文件格式,以及HTA方法、报告和HTA终版报告的细节。HTA中期报告和终版报告将由内部和外部的HTA专家进行审查。内部审查由DAHTA@DIMDI成员进行,其目的是确保报告结构合理和内容可信,以及与已确定的HTA方法之间的一致性。外部审查由来自各科学协会、高校和其他研究院对这一领域的研究有所擅长或者对HTA方法论研究有所擅长的专家进行。外部审查的对象是报告内容和HTA所用的方法。通常进行外部审查的专家是2位。在内部和外部审查的基础上,该报告经修订再定稿。终版报告将在DIMDI的网站上予以发布。
(二)IQWiG HTA程序
IQWiG评估需要符合收益评估的“一般方法”和“德国法定卫生保健系统收益成本关系评估方法”,后者在这里简称为成本-收益评估方法。IQWiG于2005年2月底在一份一般性方法文件中首次确定并公布了其工作方法。2008年1月,该协会公布了其成本-收益评估方法。IQWiG和代表IQWiG的第三方参与者必须遵循这些方法。此外,对提交至IQWiG的所有证据的评估均按照这些方法进行。IQWiG每年对这些方法进行更新和修订,以适应卫生保健领域研究和卫生保健系统的需求和发展[5]。
成本-收益评估方法的确定是在一组外部专家和IQWiG的科学咨询委员会支持下完成的。但2008年的成本-收益评估方法并未得到最终确定。2009年,关于方法论的公开争论仍在持续,IQWiG预期2009年第二季度首次发布最终版方法论,而在此之前先进行试验性评估。
由IQWiG进行的评估要进行内部审查。另外在公布报告计划草案和报告草案后,IQWiG会举行听证会。听证会可能对最终版的评估报告产生影响。听证会通常以书面评论为依据,另外也可以选择附加的口头讨论。IQWiG的评估过程参见图3。
(三)G-BA的HTA程序
G-BA进行的评估是根据其标准程序(Verfahrensordnung)进行的。标准程序为G-BA决策提供了透明的、合理合法的基础[7]。这些标准程序适用于G-BA决策、收益评估以及与IQWiG的合作[7]。G-BA评估的产品包括创新的诊断或治疗方法、言语疗法和物理疗法等康复疗法,以及应G-BA某一成员的要求而已经由SHI实施的诊断和治疗方法。门诊治疗与住院治疗的差异仅与上文提到的评估实施相关。
评估标准包括疗效、收益-风险比、结果、与备选方案相比的增量收益、成本-效益评估、预算影响,以及已收集或提交的证据的水平[7]。另外,G-BA可以委托IQWiG进行评估。收益分析的实施参见图4。
三、卫生技术评估领域存在的问题
目前,卫生技术评估领域存在许多具有争议的问题[8]。这些问题包括评估透明度、相对治疗价值与相对疗效之间的区别、资源价值的相关数据、质量调整生命年(QALY)的阈值、不确定性、经济性信息的可移植性和真实世界数据的相关性。
在德国,由于评估是由不同组织进行的,并且这些评估都不是法定要求的,即企业不是必须递交这些材料才可以得到报销,因此这些问题的讨论与进行评估的机构以及受评估影响的机构相关。由此,讨论的问题应集中于以G-BA和IQWiG的观点、代表G-BA的利益进行的评估。如果在DIMDI作者手册中记录有关于各个争论的相关陈述,则讨论的问题还应集中于以DIMDI的观点进行的评估。该手册涉及了HTA报告结构、需包含的内容和正式格式[4]。
至少从正式的角度来看,由于这些机构与任何决策制定都是密切相关的,因此这些机构在上述争论点方面的观点也应予以考虑。
(一)评估透明度

图3 IQWiG的评估过程[6]
在HTA中存在不同层面的透明度。评估本身应该透明。手册的目的是尽可能保证评估透明度,这意味着证据描述与得出的结论之间应该存在一种合理的联系。此外,HTA在卫生保健决策制定领域中的应用也应该是透明的,这意味着评估结果和相关决策之间的联系也应该是合理的。如果一项评估对决策制定存在任何影响,则这两个方面的程序透明度均应得到保证[9]。

图4 G-BA(Gemeinsamer Bundesausschuss)评估的意义[2]
DIMDI手册确定了一般方法、HTA结构和透明度[4]。在政策决策中,没有正式的程序来考虑DIMDI卫生技术评估的应用。因此,除评估报告外,DIMDI卫生技术评估没有其他的直接结果产出。
IQWiG进行的评估是不同的,它常被称为收益评估而非卫生技术评估。这主要是由于评估中所使用的特殊方法具有收益评估或成本-收益评估的特征。IQWiG代表G-BA的利益进行评估,目的是为G-BA的决策制定提供支持。但IQWiG本身并不提供评估的基础,而是在IQWiG所服务的提供方提出的报告基础上进行评估。因此,在IQWiG的特殊方法报告、一般方法报告以及卫生保健干预成本-收益评估方法报告中,IQWiG只是试图确保站在它的角度进行评估的透明度。当然最终决策由G-BA做出。这个决策制定过程(包括评估自身)应尽可能透明,以便其受到法律挑战的可能性最小化。
从表面上看,G-BA设计的评估过程的程序规则是清晰的,但在细节方面可能还存在问题。因此G-BA正在寻找方法以提高评估过程及其含义的透明度和可理解性[2]。显然,由于G-BA的评估过程和决策可能会受到法律挑战这一事实的存在,G-BA过程的透明度极有可能在德国范围内是最佳的。
(二)相对治疗价值与相对疗效
相对治疗价值与相对疗效是不同概念下的两个结果测量方法,也可以看作是综合的结果治疗方法。相对治疗价值是指与目前治疗标准相比,在发病率、死亡率和生命质量方面的差异。在DIMDI卫生技术评估手册中,没有对结果测量方法提出明确要求。但是,DIMDI间接地强调了服务提供者、支付方和患者对评估技术的接受程度[4]。
IQWiG的评估不同,在IQWiG评估中患者相关健康结果是其评价的相关参数。只有当卫生保健新技术的相对疗效与患者相关结果或相对治疗价值存在因果关系时,这一结果的测量方法才会发挥作用。与患者相关结果不存在因果关系的代用参数是不为IQWiG所接受的[3]。IQWiG的立场与G-BA的观点保持一致。如果G-BA根据程序委托IQWiG进行评价,那么IQWiG就需要遵守这些规则[7]。
在德国,药物间的一对一比较将会成为未来的评价标准,而且这个趋势是不受进行评价的机构或者使用HTA进行决策的机构影响的。
(三)价值相关数据
当进行DIMDI卫生技术评估时,对资源使用数据的价值赋值没有特殊规定。对于收益评估来说,这也不是一个重要的问题。但是目前对进行成本-收益评估时资源利用的价值赋值,就存在着激烈的争论。这场争论起源于评估的相关视角,具体而言争论的焦点在于支付方和社会这两种视角。
DIMDI没有卷入这场争论,其手册仅涉及到HTA报告的结构和正规格式两方面。对于成本-收益分析,IQWiG认为应采用支付方和参保人员的综合视角,即所谓“Perspektive der Versichertengemeinschaft”的关注点应集中在“德国SHI参保公民”[10]。IQWiG承认,由于卫生技术评估对健康结果的深远影响,因此评估应该以一种不同的视角进行分析,如阿尔茨海默氏病的药物治疗结果不仅使SHI受益,而且长期治疗还会有益于社会安定。对于预算影响分析,IQWiG的投票结果明确赞成使用预算持有人角度,即包括患者在内的疾病基金管理机构的视角[21]。
另外,最近公布的技术文件或“收益与成本关系评估方法”附录对这些争论点进行了更加深入的探讨,并将SHI参保公民视角模棱两可地定位在SHI视角与社会视角之间[11]。
评价视角确定之后,依然存在“卫生保健服务价值赋值的正确方法是什么”这一问题。关于成本测量的IQWiG技术文件偏向于社会机会成本。但由于卫生保健市场的不完善性,技术文件认为在数据可得的情况下应使用基于资源利用量乘以资源价格的微观成本方法[11]。在文件中所讨论的特殊情况下,应考虑根据更好的评价机会成本进行调整。
但由于资源价格通常不是公开可得的,并且反映机会成本的调整可能会引起争议或受到战略性利用,因此该方法并不简单易行。从实用角度出发,从SHI视角进行的卫生保健服务的价值赋值应将SHI所用全部资源的成本考虑在内。
(四)QALY阈值
QALYs不为德国评估机构所接受[24]。因此QALY阈值也没有得到认可。根据卫生部的指令和卫生部关于QALYs的评论,IQWiG没有做出关注QALYs的官方评价。因此,阈值的讨论与目前德国的环境是不相关的。
(五)不确定性的处理
成本-收益评估的IQWiG方法报告并没有对如何处理不确定性问题进行明确阐述。该问题在文件中多次出现,但仅建议读者参考关于不确定性的技术文件[13]。在技术文件中,不确定性的处理方法是根据对某一参数真实值的估计和根据这一估计的置信区间来表示。
(六)经济数据的可移植性
在技术文件中,成本测量部分涉及到经济数据在不同国家间的可移植性[11]。文件指出了影响成本数据移植性的因素、受影响的关键性决定因素、验证研究与目标国家之间一致性的工作,以及根据目标国家的环境进行的提高可移植性的调整。
该文件还涉及到排除成本数据可移植性的“剔除标准”,例如待评价的干预项目与目标国家不相关,研究质量不符合目标国家的方法学标准,等等。在流行病学、卫生保健标准(卫生保健过程和资源利用)和相关价格方面可能需要调整模型。如果货币需要进行转化,则应该根据购买力等价性进行调整。
(七)产生和使用真实世界的数据
在各种HTA的评价中,使用的数据包括结果数据、资源利用数据、所用资源的价值数据。真实世界数据的讨论重点在于结果数据,以及存在潜在问题的资源利用。所用资源的价值通常决定于分析采用的视角和成本计算方法[11]。
对于结果数据,在一般方法中IQWiG主要关注随机对照试验(RCTs),这是由于随机对照试验的内部有效性较好,而这恰恰可以证明因果关系的存在[6]。但这也带来了关于各研究结果外部有效性的问题。对于IQWiG来说,内部有效性研究结果最重要的影响因素是随机性、无偏评估、概要和将研究结果发表以获得高度确定性的结果。
此外,IQWiG认为内部有效性与外部有效性之间并不存在矛盾,因为外部有效性取决于研究问题和“对研究类型、设计和实施的科学综合”[6]。参与到关于实际试验与将RCTs视为可行方法这一讨论的组织,希望能够通过合适的试验设计得到真实世界的数据。因此,收益评估作为成本-收益评估的前身,在可用的情况下,IQWiG规定仅可以使用RCTs的数据,但在常规治疗试验设计的接近性方面是灵活的。只有在没有可替代数据的情况下,该协会才会使用由研究设计而非RCTs产生的真实世界数据[6]。
四、应用HTA存在的问题
HTA的最终目的是为卫生保健决策制定提供支持(详见Henshall等关于欧洲HTA政策与实践方面的综述[14])。在德国,卫生保健决策由国会制定,卫生部负责建立卫生保健框架。同时,卫生保健决策也由一些在特定领域负责卫生保健服务实施的G-BA做出[15]。
作为决策制定的基础,各种HTA需要提前进行。G-BA或政府部门可以委托IQWiG就他们希望得以解决的任何研究问题进行评估。但正如上文所述,与DIMDI相比,IQWiG不存在任何明确的优先权。
DIMDI2008年的优先论题列举如下[16]:
(1)与侵入性和非侵入性方法相比,通过尿素呼气试验法进行幽门螺旋杆菌的初期诊断检查会带来哪些医疗和经济上的收益?
(2)哪种治疗肌张力亢进的药物能够有助于2型糖尿病的治疗?从长期来看,什么样的药物是具有成本-效果的?
(3)预防跌倒的干预措施在人们所关注的躯体可移动性、跌倒率和跌倒后果上的疗效如何?跌倒的干预措施和相关治疗的效果以及随之而来的成本怎么样?
(4)医学上支持和反对假肢注册使用的理由是什么?国际上的经验是什么?效果如何?对法律、伦理和社会各方面带来的影响?
(5)德国冠心病患者非医疗二级预防的疗效(efficacy)和效果(efficiency)如何?与保守治疗方法相比,对医师、患者和基金会的价值是什么?
G-BA使用IQWiG评估的结果进行决策制定。而DAHTA@DIMDI进行的各种HTA是否应用于卫生政策制定目前还不清楚,因为没有得到关于该问题的任何证据。但德国许多组织在HTA方面都很活跃,至少他们认为开展这项活动可以使自身从中受益。
HTA在应用中的问题主要包括以下几个方面,即决策制定过程中的透明度,评估的独立性,卫生政策与政治的关系,基金预算,平行贸易,患者与卫生保健服务提供者的选择,以及HTA对预算、报销与使用的影响。
(一)决策制定过程中的透明度
DIMDI的评估过程是透明的,但在DIMDI卫生技术评估的基础上不可能直接制定任何决策。
对于IQWiG来说,评估过程中决策制定的基础是报告计划草案,草案公布的目的是便于让不同利益相关者进行讨论,其以书面形式公布,并举办一次听证会。评估过程中可以进行讨论的原因是该方案并未在公共领域发布。由于IQWiG是一个私立机构,其作为联邦卫生保健质量与效果(Foundation for Quality and Efficiency in Health Care)基金会下的一个机构,承担来自G-BA或卫生部的委托进行卫生技术评估,所以IQWiG仅对基金会及其代表负责。
此外,G-BA在IQWiG评估基础上的决策制定是透明的,这意味着最终决策将会以指令形式编写,并且各决策对应的原因也会以书面形式给出。G-BA的决策结果可能会面对法律的挑战,评估活动本身也可能受到法律的挑战。
(二)评估的独立性
IQWiG付给外部专家科研佣金,以此实现G-BA对外部专家的委托。这种佣金受到公共采购法的约束。外部专家需要符合以下条件:(1)遵守协会的方法学规定;(2)公开与任务相关的潜在利益冲突;(3)掌握德语;(4)具有医师/专业人员推荐的详细说明;(5)证明其具有与任务相关的医师/专业相关经验。
外部专家的评估不是独立的,代表了IQWiG的利益。由于IQWiG服务于创办人的利益,因此这个关于独立性的问题在德国有着不同的答案,它取决于个人的视角。
对于DAHTA@DIMDI,情况就相对简单了。由于DAHTA手册不是对评价内容的规定,而是对HTA内容格式的详细要求,因此进行评估的该工作组的独立性就显而易见了。
(三)卫生政策与政治的关系
证据与评估并非G-BA或卫生部决策制定的唯一影响因素。其他因素有卫生保健系统成本控制的要求、支持证据的文化、利益相关者支持或反对某一卫生技术的游说活动、决策制定的透明度、应用HTA的专家意见、政策体系的变化、实施HTA人员的变化、冗长的决策制定过程、缺少主要负责收集和提供各种HTA的协调办公室[9]。除上述因素之外,实施HTA的工作组或机构的声誉、评估过程中利益相关者的参与、HTA发起人与最终决策者是否一致、待评估卫生技术的创新性与耗资,以及与待评估卫生技术对最终决策有影响力的相关情感因素,等等。
目前关于这些因素与证据相比的相关性,可以获得的证据非常有限,还需要建立能够对这种影响进行定量测定的途径[17]。
(四)基金预算
德国卫生保健系统的资金支持是通过一个预算体系、对比的方法以及资助和报销的可及性来实现的,资助的力度根据不同卫生技术的特点而有所不同。药品的资助或报销主要由G-BA管理;对于门诊处方中患者可直接使用的医疗器械,需要得到疾病基金会负责人的批准并将其纳入辅助技术官方清单。对于门诊治疗使用的部分医疗器械,G-BA需要在G-BA“Verfahrensordnung”基础上对该服务的收益进行评估之后决定是否批准使用。当医疗器械用于住院病人时,情况会有所不同[18]。因此,不存在独立于被评估技术之外的通用评估过程或成套评估标准。
这些评估虽然相似,但由不同的机构组织进行,这些机构很少会顾及社会的视角。因此,那些给卫生保健系统带来额外成本,却给社会保障体系中其他组织带来收益的卫生技术,将可能被SHI的患者拒绝。
(五)平行贸易
在德国,平行贸易受到法律的保护,法律要求具有固定职业场所的药剂师开出的总药品处方中至少有5%是平行进口的药品。这项规定是出于成本控制和降低德国药品支出的目的。但目前还没有与HTA相关的平行贸易方面的讨论。在平行贸易方面,只有涉及药品安全性方面的少量争议。
(六)患者与提供者的选择
服务提供者的选择与疾病基金会和医生或医院使用的处方集相关。在德国,医院通常都使用处方集。医生虽未明确地使用处方集,但他们都拥有自己经常处方的一个药品范围。医生综合服务组织网或其他组织可以建立自己的处方集。疾病基金会也开始讨论建立个别基金会的单独处方集,这个处方集是建立在目前个别疾病基金会与德国制药行业之间进行的折扣谈判基础上的。
个别疾病基金会的单独处方集在德国卫生保健体系得以完善之前,还有许多路要走。目前,疾病基金会还没有实施直接影响医生药品处方的方法。
但这并不意味着患者可以自己选择药品。药品处方主要受医生的影响,而医生的执业又受到了G-BA对药品处方管制方向的左右。大体上看,G-BA的管制主要通过参考价格的实施、建立非报销药品目录、取消处方权、个体医生预算和其他措施,对药品的价格、使用和质量保证施加影响。Cassel和Wille在一篇文献中列举了18项影响药品价格、使用和质量的措施[19]。SHI的参保患者可以自由选择非处方药物。如果持有医生开具的处方,私人健康保险的参保患者可以选择药物。
对于技术辅助器材,SHI参保患者可以获得的处方范围是已被纳入官方目录的产品。在此范围内,患者可与其医生一起进行选择。如果医疗器械是某项卫生服务附属的一部分,那么患者很少享有对该器械的选择权。
(七)对预算、报销和使用的影响
HTA仅仅是影响预算、报销和药品可及性的因素之一。其他如上文提到的指导药物处方的措施,在德国也是很重要的。短效胰岛素类似物即是众多典型案例之一。在该例中,IQWiG的评估使疾病基金会和制药公司之间达成了折扣协议,由此影响到患者的可及性、报销以及预算。但从药物支出与相关管制的全局来看,管制的影响明显大于各种HTA技术的影响。有时管制的影响力与理性的处方行为是矛盾的。因此在HTA真正发挥作用之前,首先需要解决这种矛盾。
五、德国的卫生技术评估——经验
在德国,HTA逐渐应用于为卫生保健决策提供信息,但HTA究竟产生了什么样的影响,目前并没有系统和前瞻性的证据[9]。
药物评估主要由IQWiG代表G-BA的利益进行。因此,IQWiG评估作为HTA的一种特殊形式或改良形式,其重要性正在日益提高。由DAHTA@DIMDI推动进行的各种HTA在基金管理和报销方面起到的作用很小,然而却在国会的卫生政策决策和独立的患者信息提供方面起到了一定的作用,其起到的作用与IQWiG基金会成员的目标或许没有差异,但是有时事实并不总是这样。
HTA的使用者主要有G-BA、IQWiG、疾病基金会、法定医师协会(继IQWiG或G-BA之后使用),以及其他制定报销类别和目录的机构。HTA的应用主要集中于制定与更新报销目录。但这会给卫生保健预算带来帮助吗?
德国没有单一的卫生保健预算。许多医疗措施都会产生卫生保健成本,其中一些包括在预算范围内,但并没有设单独的预算指标。根据前述的Cassel和Wille的文章,只有药品有大约18种措施影响到其费用的增长[18]。相反,由于HTA在德国的使用,评估正在对卫生保健预算和卫生保健可及性产生影响。创新治疗方法的采用可能会由于增加了可获得的治疗方法而使卫生保健支出的压力增大,这是由于新治疗方法的纳入很少会导致现有治疗方法退出报销目录。由于G-BA的决策不仅对疾病基金会和法定医生有法律约束力,对参保人同样也有约束力,因此HTA也会产生同样影响。
G-BA对门诊治疗创新方法的采纳和将治疗方法排除在住院治疗之外的权力,诠释了创新治疗方法进入德国医疗体系的常规路径:新治疗方法常常通过住院治疗而进入系统,在得到G-BA许可后再应用于门诊治疗。甚至在治疗方法是为门诊治疗所设计的情况下,也是如此。评估花费了很多时间,因此延误了新治疗方法进入门诊治疗的时间。这种延误是积极的还是消极的不仅在德国有争议,在世界范围也有争议。对于药品而言,这种争议导致了这样一种要求,即对药品设置第四重障碍:在新药被批准上市后,针对该新药的资助和报销也被取消。在医疗服务、技术辅助和诊断中使用的药品和医疗器械有不同的市场可及性是不容质疑的,卫生政策制定者应该考虑基于HTA建立起新技术进入德国医疗体系的通用方法。然而这种探讨才刚刚开始。
在德国卫生保健系统中,由于不同利益相关者进行的HTA的应用和普及,引起了HTA业务的专业化,这种专业化不仅发生在G-BA、IQWiG、DIMDI、MDS、KBV和上文提到的其他组织中,甚至发生在医疗保健行业。德国卫生保健行业已经接受了通过阐述与当前技术水平相比,他们的创新产品的价值,以支持对创新产品的需求。产业学会利用HTA来评价并证明其产品的价值,似乎使HTA正在成为创新产品进入德国卫生保健系统的通用方法。
资金支持:本研究系由ISPOR慷慨资助,作者Frank-Ulrich Fricke 和Hans-Peter Dauben对此无异议。
[1] Perleth M. Aktuelle Entwicklungen im Bereich Health Technology Assessment—das deutsche HTA-Projekt. TADatenbank-Nachrichten, 2001,(1):22-28
[2] Bronner D. Assessment of Benefit, Implementation of medical innovations in Germany, presentation at the meeting College Voor Zorgverzekeringen (CVZ) and Gemeinsamer Bundesausschuss (G-BA).Amsterdam:2007-01-26
[3] DIMDI. HTA at DIMDI. Cologne: Basic Information,2008a
[4] DIMDI. Handbuch für Autoren zur Erstellung von HTABerichten (Manual for Authors). Köln: DIMDI,2008b
[5] IQWiG. Methods and Tools[OL]. [2009-02-01]. http:// www.iqwig.de/methods-and-tools.427.en.html
[6] IQWiG. Allgemeine Methoden (General Methods).Köln:IQWiG, 2008a
[7] G-BA. Verfahrensordnung des Gemeinsamen Bundesausschusses.Siegburg: G-BA, 2006
[8] Sorenson C, Drummond M, Kristensen FB, Busse R.How can the impact of health technology assessments be enhanced? Copenhagen:WHO Regional Office for Europe,2008
[9] Gerhardus A, Dintsios Ch-M. Der Einfluss von HTA-Berichten auf die gesundheitspolitische Entscheidungsfindung—eine systematische übersichtsarbeit.Köln: DAHTA@DIMDI, 2005
[10] IQWiG. Methods for Assessment of the Relation of Benefits to Costs in the German Statutory Health Care System. Köln: IQWiG, 2008b
[11] IQWiG. Technical Document Cost Estimation. Köln:IQWiG, 2008c
[12] Bundesministerium für Gesundheit. Stellungnahme zur Methodik der Kosten-Nutzen-Bewertung von Arzneimitteln Kosten-Nutzen-Bewertung—06 August 2008 [OL]. [2008-11-16]. http://www.bmg.bund.de/cln_117/ nn_1168258/sid_A3428FF5D375DE17EA8A776B5CA5D5AB/ SharedDocs/Standardartikel/DE/AZ/K/Glossar-Kosten-Nutzen-Bewertung/Stellungnahme.html?__nnn=true
[13] Der Gemeinsame Bundesausschuss. The German Health Care System and the Federal Joint Committee [OL]. [2008-11-19]. http://www.g-ba.de/institution/sys/ english/
[14] Henshall C, Koch P, Below GCv, et al. Health technology assessment in policy and practice, working group 6 report. Int J Technol Assess Health Care,2002,18:447-455
[15] IQWiG. Technical Document Uncertainty. Köln:IQWiG, 2008d
[16] DIMDI. Priority List [OL].[2008-11-19] http://www.dimdi.de/static/en/hta/programm/prioritaeten.htm
[17] Gerhardus A. Die Effekte von HTA-Berichten im Gesundheitssystem.In: Perleth M, Busse R, Gerhardus A, et al. Health Technology Assessment. Berlin:Medizinisch Wissenschaftliche Verlagsgesellschaft, 2008
[18] Perleth M, Busse R, Gerhardus A, et al. Health Technology Assessment, onzepte, Methoden, Praxis für Wissenschaft und Entscheidungsfindung. Berlin: Medizini schWissenschaftliche Verlagsgesellschaft,2008
[19] Cassel D, Wille E. Für mehr Markt und Wettbewerb in der GKV-Arzneimittelversorgung, GGW 1/2007 (January), 7.Jg.23-30
(本文根据德国纽伦堡IMS Health的Frank-Ulrich Fricke, PhD, MSc和德国科隆DIMDI的Hans Peter Dauben, PhD, MD在《Value in Health》2009年Vol.12(Suppl.2)(特刊)发表的文章编译。译者:宗欣 吴晶)


