胃癌中PTEN和hTERT的表达及意义
马鹏 谈晓红 冯义朝
张力蛋白同源、第10染色体丢失的磷酸酶基因 (phosphatase and tension homology deletedon chromosome ten, PTEN),是目前发现的第一个具有磷酸酯酶活性的抑癌基因,参与细胞凋亡调控[1],近年研究发现,其表达与一些恶性肿瘤发生发展、生物学行为和预后有密切的关系[2]。近年来研究表明,端粒酶的激活及其活性上调是恶性肿瘤发病机制中极其重要和关键的一步,其活性高低主要取决于端粒酶逆转录酶(hTER)的表达水平,hTER为端粒酶活性的限速因子[3]。我们应用免疫组化技术研究PTEN和hTER蛋白表达与胃癌及癌前期病变的关系。
1 材料和方法
1.1 材料 2003年~2005年我院普外科术后胃癌大体标本80例,术前均未化放疗,男56例,女24例。年龄23岁~72岁(平均54岁)。经苏木素伊红染色,病理医生诊断。兔抗人hTERT多克隆抗体,购自北京博奥森生物技术公司,PTEN单克隆抗体(浓缩液)、(S~P)试剂盒及(DAB)购自北京中杉生物技术有限公司。
1.2 方法 每个病例病理切片均分二部分,分别检测PTEN和hTERT蛋白的表达情况。标本经10%甲醛固定,石蜡包埋,4μm厚的石蜡切片65℃烘烤,脱蜡,3%过氧化氢灭活内源性过氧化物酶,微波修复抗原,10%正常山羊血清封闭,hTERT多克隆抗体及PTEN单克隆抗体(1:50) 4℃过夜孵育,磷酸盐缓冲液(PBS)冲洗,加生物素标记抗人IgG药置于室温下30分钟,冲洗,辣根酶标记链霉卵白素室温下孵育30分钟,冲洗后DAB显色,苏木素染色,封片。光镜观察。用已知阳性胃癌切片作阳性对照,用PBS代替一抗作阴性对照。
1.3 结果判断 PTEN染色定位在细胞质内,hTERT阳性染色主要定位于细胞核,呈棕黄色,以细胞质或细胞核呈棕黄色颗粒为阳性。由两位病理科医师随机选择5个有代表性的视野计数200个细胞,按阳性细胞占同类记数细胞的百分比将免疫组化结果分为阴性,即百分比<10%;阳性即百分比>10%。实验结果拍摄成像。
1.4 统计学方法 采用SPSS10.0统计学软件进行统计学分析,采用x2检验对免疫组化结果进行分析处理,以P<0.05为差异具有显著意义。
2 结果
所检测的80例胃癌中,早期胃癌29例,PTEN表达率为62.1%,hTERT表达率为65.5%,中晚期胃癌51例,PTEN表达率为37.3%。hTERT表达率为96.1%。详见表2。
PTEN和hTERT在胃癌中的相关性:80例胃癌组织中PTEN和htert蛋白表达强度呈明显负相关(P<0.05),即胃癌组织中hTERT表达愈强,pten蛋白表达就愈弱,反之亦然,详见表1,表2,表3。
3 讨论
张力蛋白同源、第10染色体丢失的磷酸酶基因(PTEN)作为一种抑癌基因,其表达的蛋白具有双磷酸酶活性,可以通过脱磷酸作用调节多种信号传导系统,包括下调黏着斑激酶(FAK)的活性抑制细胞的黏附,浸润和转移[4],通过磷酸肌醇(PI3K)途径促进细胞的凋亡,抑制细胞的增殖,通过促分裂原活化蛋白(MAPK)途径抑制细胞的分化。端粒酶是一种核糖核蛋白酶,广泛存在于永生化细胞和肿瘤细胞中,人端粒酶包括三个主要部分:即人端粒酶RNA(hTR)、端粒酶相关蛋白(TP1)和端粒酶催化亚单位,即端粒酶逆转录酶(hTERT,hEst2)。端粒酶的主要功能是以自身RNA为模板,从头合成端粒,维持染色体末端稳定,在肿瘤的发生、发展过程中起着重要的作用。多项研究报道,hTERT基因与端粒酶活性具有密切的相关性。hTERT对端粒酶活性表达起限速作用,其主要功能是具有逆转录活性。
胃癌是常见的消化道肿瘤,在胃癌的发生中,从正常胃黏膜上皮转化成癌是一个多步骤的过程,是由于多种基因异常在多年的阶段中积累的结果,其中涉及到多种癌基因,抑癌基因,端粒及端粒酶,细胞黏附因子及DNA错配修复基因的异常和积累,本结果表明,在从慢性胃炎-萎缩性胃炎—肠上皮化生-异型性增生-癌变的过程中,PTEN的阳性表达率逐渐降低,缺失率逐渐升高,hTERT阳性表达逐渐升高。PTEN蛋白在异型性增生组PTEN表达率为63.3%较萎缩性胃炎伴肠化明显减低,且有显著差异(P<0.05),说明随着增生程度的增加,抑癌基因的缺失也越来越明显。抑癌基因PTEN对于增生性萎缩性胃炎向异型性增生以及恶性转化过程中起重要作用。本研究结果还表明,在本组胃癌组织中PTEN的阳性表达率为46.3%,与患者的年龄,性别无关(P>0.05)。PTEN的阳性表达在与肿瘤的大小显著相关(P<0.01),在进展期胃癌中的表达明显低于早期胃癌且有显著差异(P<0.05),在有淋巴转移的胃癌表达明显低于无淋巴转移的且有显著差异(P<0.05),PTEN在低分化胃癌的表达率低于高分化胃癌且有显著差异(P<0.01),说明随着肿瘤恶性程度的增加,PTEN的缺失率增高,也说明PTEN表达缺失贯穿与胃癌的整个发展过程中。PTEN蛋白表达降低,使癌细胞增殖速度增快,对凋亡信号的敏感性降低,肿瘤生长速度增快,故PTEN的表达与肿瘤的大小有密切的相关性。PTEN可以使FAK脱磷酸,从而阻止整合素介导的细胞扩散和转移,故PTEN表达低的组,胃癌有较高的转移率。本组实验结果显示,在80例胃癌组织中,hTERT阳性表达85%,明显高于正常对照组0.0%及癌前病变(PL)组53.3%,差异有显著性(P<0.001),说明hTERT表达与胃癌的发生有关;实验还结果显示,胃癌有淋巴结转移组hTERT阳性率为91.7%,明显高于无淋巴结转移组70.59%,差异有显著性(P<0.05)。提示hTERT阳性表达可能是淋巴结转移的重要指标;说明hTERT表达上调对于胃癌的发生、发展可能起重要作用。检测hTERT,可能有助于胃癌的预后判断。提示hTERT有可能成为胃癌诊断的敏感而特异的一个新的肿瘤分子标志物。

表1 不同胃粘膜组织中hTERT和 PTEN阳性表达
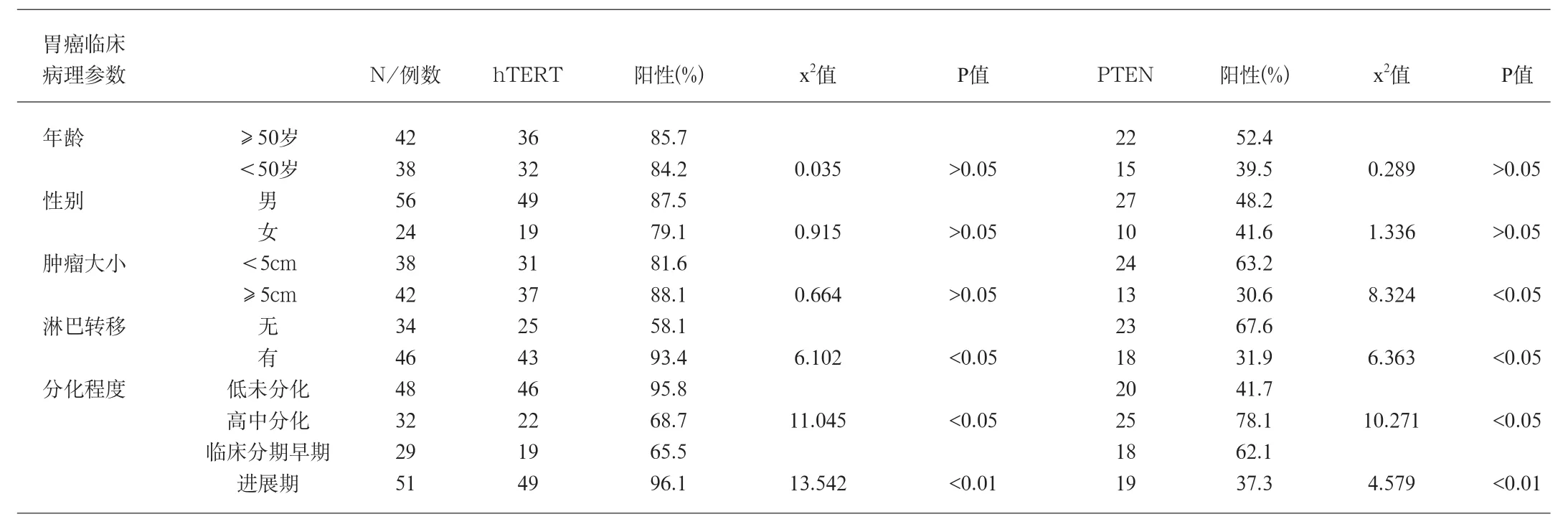
表2 胃癌病人hTERT、PTEN表达与临床病理特征指标关系

表3 胃癌组织hTERT活性表达与PTEN表达的关系
总之,抑癌基因PTEN的失活和端粒酶激活是胃癌变的早期表现,贯穿于胃癌的发生发展过程中。胃癌组织中PTEN和hTERT蛋白表达呈负相关,PTEN蛋白的表达越弱,hTERT蛋白的表达就越强,提示胃癌组织中hTERT的蛋白激活与PTEN蛋白的低表达和失表达密切相关,从而说明胃癌中PTEN蛋白的表达减低可能在胃癌中的hTERT活化起着调控作用,使细胞恶性转化和增殖,导致胃癌的发生。提示联合检测PTEN和hTERT达蛋白表达可作为判定胃癌生物学行为的客观指标。
[1] Maurice-Duelli A,Ndoye A,Bouali S,et al.Enhanced cell growth inhibition following PTEN nonviral gene transfer using polyethylenimine and photochemical internalization in endometrial cancer cells[J].Technol Cancer Res Treat,2004,(5)3:459-466.
[2] Khan S,Kumagai T,Vora J,et al.PTEN promoter is methylated in a proportion of invasive breast cancers[J].Int J Cancer 2004,(3)112:407-408.
[3] 林 云,涂亚庭,郑方蓉,等.尖锐湿疣和外阴鳞状细胞癌中htert mrna和survivin的表达及其相互关系[J].中国麻风皮肤病杂志,2006,22(3):179-81.
[4] Amura M,CU J,Tran H,et al PTEN gene and integrin signaling in cancer[J].Natl cancer Inst,1999,91(21):1820-1828.