航天搭载紫花苜蓿连续后代变异株系选育
范润钧,邓 波,陈本建,柴小琴,张蕴薇
(1.甘肃农业大学草业学院,甘肃兰州730070;2.中国农业大学动物科技学院,北京100193;
3.甘肃省天水市农业科学研究所,甘肃天水741000)
航天育种(或太空育种)又称空间诱变育种,其具有变异频率高、变异幅度大、有益变异多、稳定性强,优势明显。它是指利用返回式卫星或高空气球将植物种子带到太空,利用太空特殊的环境(空间宇宙射线、微重力、高真空、弱磁场等因素)使种子产生变化,引起生物体染色体畸变,进而导致生物体遗传变异,经地面种植选育新种质、新材料,培育新品种的植物育种新技术[1]。航天育种研究开始于1987年,到目前为止,我国利用返回式卫星先后进行了13次70多种农作物的空间搭载试验,共搭载粮食、经济作物、蔬菜、花卉、微生物菌株等800多个品种,经全国23个省市109个科研及生产单位的农业专家和技术人员的试验选育,取得可喜的成果[2]。空间诱变作为一种新的物理诱变手段,已被广泛应用于多种生物材料诱导变异,从中选育出一批新的优良品种,显示了空间环境中致突变因素的存在及其有效性[3]。
本研究是在筛选出航天搭载紫花苜蓿第1代突变单株的基础上,为后续世代的高品质选育工作进行展望,并提出建议和方法。
1 空间搭载紫花苜蓿种子第1代植株表型变异及基因多态性分析
1.1 供试材料
为4个紫花苜蓿品种,搭载于“神州三号”卫星,飞行时间从2002年3月25日至4月1日,共7 d,飞行高度为198~338 km,倾角42.4°,绕地球108圈[4]。4个紫花苜蓿品种分别为:A.得福(52株);B.德宝(47株);C.阿尔刚金(66株);D.三得利(59株),均为SP1植株。于2009年4月22日取自甘肃天水西部航天育种中心。
1.2 主要技术路线
田间性状调查选材→DNA的提取→SSR引物的筛选→SSR-PCR扩增→琼脂糖凝胶电泳→聚丙烯酰胺凝胶电泳→电泳谱带的统计分析→数据处理→确定变异单株。
1.3 试验结果
经搭载后的种子萌发获得的第1代(SP1,表示经飞船搭载后回收种植的第1代,后面各世代依次类推)植株中,大部分生长正常,无严重生理损伤,且结实率接近地面对照。但也有一些植株高度、叶片大小及叶色等发生了变化。根据4个主要变异性状植株较高、叶色较深、叶片较大、多叶,分别筛选出4个紫花苜蓿品种的变异单株。
采用正交设计优化紫花苜蓿SSR-PCR反应体系,25μL反应体系包括 Mg2+2.5 mmol/L,dNTP 0.2mmol/L,引物 0.7μmol/L,Taq DNA聚合酶2 U以及2.5μL 10×buffer和60 ng模板DNA。循环参数为:94℃预变性3min;95℃变性1min,52 ℃退火 1.5min,72 ℃延伸 60 s,共循环35次;最后72℃保温8min;4℃保存。利用该反应体系从17对SSR引物中,筛选出6对扩增产物具有稳定多态性的引物。
利用优化的SSR-PCR反应体系及筛选出的多态性较好的引物,对材料进行检测,共检测到25个等位基因,每对引物检测出2~8个等位基因,平均为4.17个。结合4个突变指标,检测经过筛选的植株的等位基因频率及每个位点的多态性信息量(PIC),PIC变化于0.221 6~0.832 8之间,平均为0.636 6,并对多态基因植株与筛选出的表型变异植株的多态性作相关性分析,根据检测结果初步确定13株突变植株(表1)。
由表1可 知,A-07,B-35,C-01,C-28 和D-21这5个SP1植株,可在其基因组检测到7个以上的多态性等位基因。结合表型变化分析发现,基因组多态率高的植株大多数都有较明显的变异表型(如 C-01,C-28,D-49等);但也有个别基因组多态率高的植株(如A-07),在本研究观察的数个表型范围内未发现形态性状的变异。可见,SP1植株的基因组DNA多态性与所观察的表型变异之间有一定的相关性,但不是必然联系。
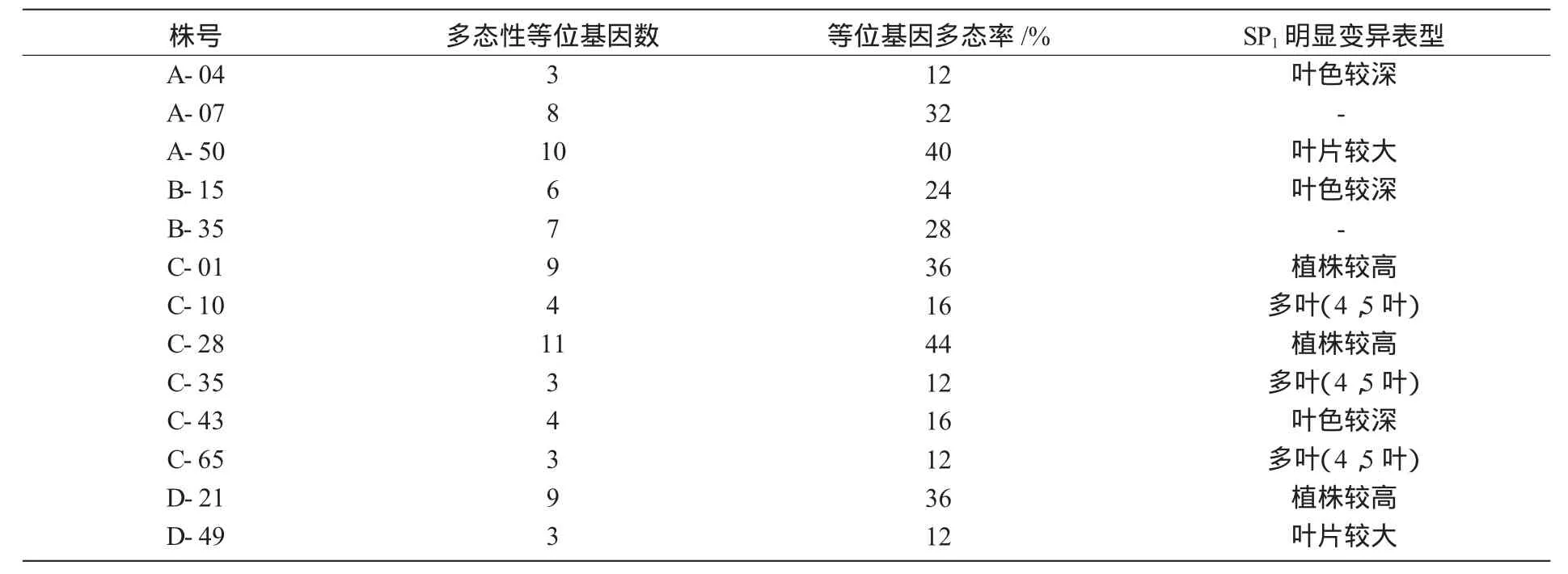
表1 基因组多态率较高的SP1植株及其表型变异
2 筛选株系后代植株表型及基因组变异展望
2.1 后续世代的种植和筛选方法
林作楫等[5]在1996年选用不同小麦品种(品系)进行卫星搭载,搭载种子在田间种植后,对SP2进行分析,可看到部分搭载材料在一些重要农艺性状上有明显变异,从中选出一批优良品系,产量较原始品种(品系)有显著提高,预期将有2~3个材料在生产上推广。本试验通过表型观察以及分子标记手段,从SP1植株中共筛选出13个株系,每个单株收种30粒,种植成SP2株系,再用同样的种植筛选方法,经3~4代(SP3~SP4)选育获得形态性状明显变异并能稳定遗传的突变株,种成SP5的突变株系。另外,还混收与地面对照组形态性状没有明显差异的第1代单株种子,混播种植SP2,继续选择与地面对照组形态性状有明显差异的单株,对形态性状变异的单株进行多代种植和选育,获得形态性状明显变异并能稳定遗传的突变株系。具体种植及筛选流程如图1所示。
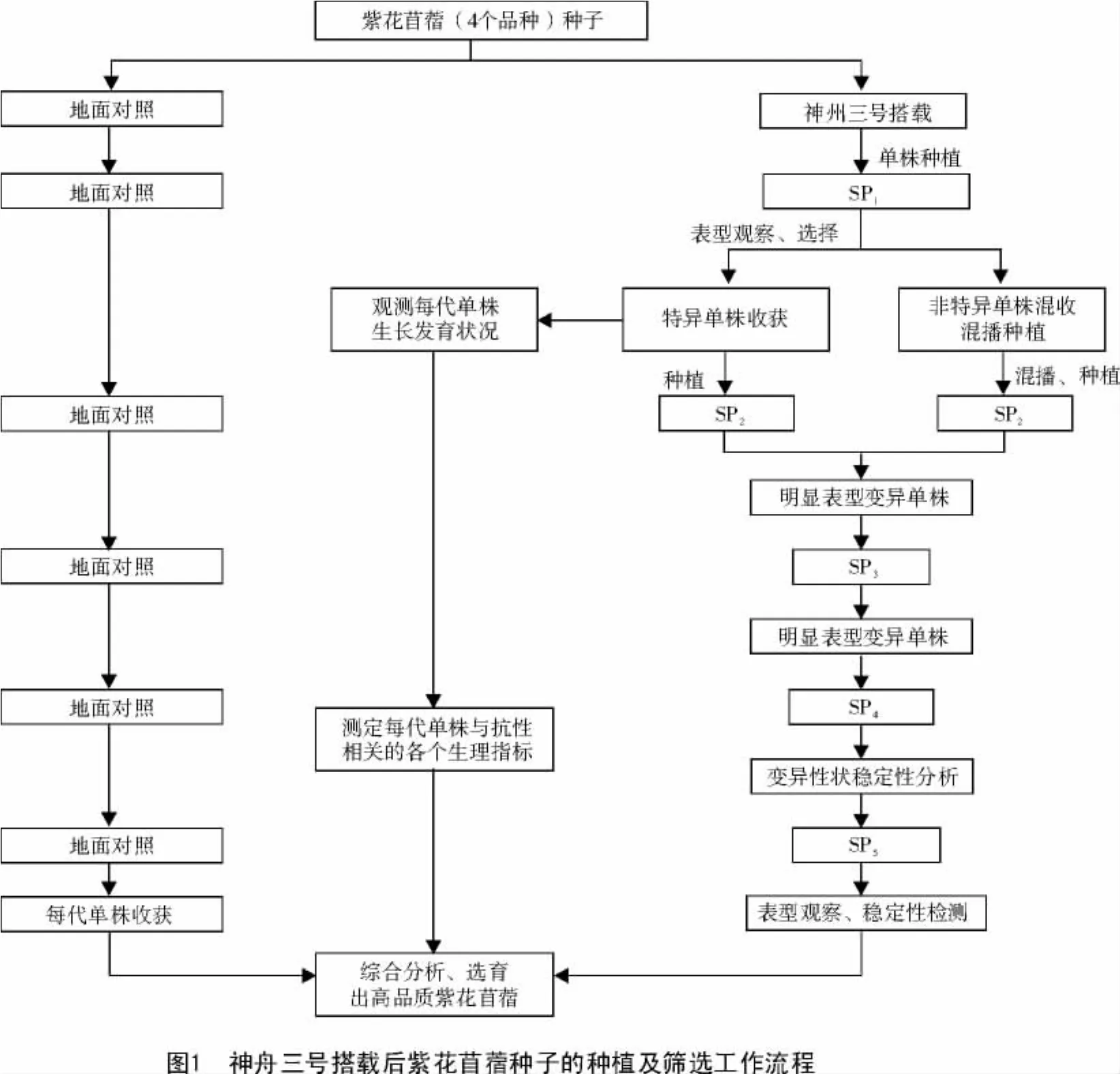
2.2 筛选株系后代植株表型及基因组变异探讨
与地面对照组相比,筛选出的13株SP1植株,大多数都存在表型变异特征。一般变异植株在其后的连续3代的分离有以下3种类型[6-8]:(1)前代的某些形态性状变化在后代某些单株得以保留,甚至更明显;(2)前代单株的形态性状变化在后代中逐渐回复;(3)后代单株出现前代所没有的新的形态性状变化。
为探索经飞船搭载后种子的基因组变异在世代遗传中的规律性,进一步应用分子标记技术跟踪分析以上13个筛选出的变异单株及其连续多代单株基因组变化。
经过4代种植和跟踪分析后,探求稳定突变株系基因组多态性等位基因的来源以及能否稳定地遗传给后代,以选育出高品质紫花苜蓿。然后对稳定突变株的连续多代(即从第一代开始到稳定突变体的连续多代)作分子标记检测,进而找到稳定遗传的突变单株。
3 稳定突变体生理生化指标检测
对稳定遗传的突变单株进行生理生化指标检测,进一步证明突变株系的优良变异。经过图1的筛选模式,对每一代材料都综合田间性状观察、考种分析数据,选出性状变异较明显的单株。对稳定突变株系的变异性状进行多代跟踪,并用Excel软件的单因素显著性分析方法,对突变株系与地面对照组的各性状进行显著性比较分析。同时,检测变异单株各项生理生化指标[9]。(1)与抗旱性相关的生理指标:叶片相对含水量、细胞膜透性、叶绿素含量、POD活性、叶片超微结构。(2)与抗寒性相关的生理指标:SOD活性、POD活性、CAT活性、游离脯氨酸含量、叶绿素含量、抗坏血酸含量。(3)与耐盐碱生理相关的指标:细胞膜透性、丙二醛和游离脯氨酸含量、株高、鲜质量、干质量。
4 世代遗传讨论
由于太空空间存在各种无法控制的诱变因素,因此,空间诱变处理对作物的诱变方向也具有不确定性。一方面空间诱变可以创造出符合人类需要的各种变异类型,经过选择可以创造有益的新种质,培育新品种。另一方面,空间诱变群体中并不是所有的变异都是有利的,而且空间诱变也不是对所有性状都能产生显著的作用[10]。
一般认为,飞船搭载使被搭载的种子基因组产生损伤,第一代植株基因组中的变异可以遗传给后代单株,使后代单株基因组与前代具有相同的多态性;遗传物质DNA分子的辐射损伤也可能部分被修复,后代单株基因组多态率下降;而DNA分子的辐射损伤不完全修复或错误修复,也可使后代单株基因组出现新的多态性等位基因,多态率增加。经过4或5代的种植,未修复的损伤及其导致的基因组变异能稳定地遗传给后代,获得表型和基因型变异均稳定的突变株系[4]。
[1] 密士军,郝再彬.航天育种研究的新进展[J].黑龙江农业科学,2002(4):31-33.
[2] 蒋兴村.农作物空间诱变育种进展及其前景[J].中国航天,1997(2):5-8.
[3] 丘运兰,何康远,梅曼彤,等.太空飞行对玉米种子的生物学效应[J].华南农业大学学报,1994,15(2):100-105.
[4] 骆艺.飞船搭载水稻种子连续世代遗传变异及基因组多态性分析[D].广州:华南农业大学,2006.
[5] 林作楫,雷振生,揭声慧,等.小麦搭载卫星进行诱变育种研究初报[J].华北农学报,2000,15(4):7-9.
[6] 李社荣,曾孟潜,刘雅楠,等.植物空间诱变研究进展[J].核农学报,1998,12(6):375-379.
[7] 周峰,易继财,张群宇,等.水稻空间诱变后代的微卫星多态性分析[J].华南农业大学学报,2001(22):55-57.
[8] 易继财,王慧.空间搭载诱导水稻种子突变的分子标记多态性分析[J].生物物理学报,2002,18(4):478-483.
[9] 武晓军.航天诱变棉花生物学效应及突变体多态性分析[D].武汉:华中农业大学,2006.
[10] 田伯红,孔德平,王建广,等.航天诱变对农作物的生物学效应及育种成就[J].山西农业科学,2008,36(4):14-16.

