结缔组织生长因子通过活化 ERK1/2通路促肌纤维母细胞增殖△
江苏大学附属医院呼吸内科 (镇江 212001) 郑金旭 田安国 黄震杰
在肺纤维化动物模型以及人类特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)中 ,纤维化肺组织局部不仅结缔组织生长因子(Connective tissue growth factor,CTGF)水平升高,而且还聚集了大量表达平滑肌肌动蛋白(α-SMA)的肌纤维母细胞。以α-平滑肌肌动蛋白 (α-Smooth muscle actin,α-SM A)为标志蛋白的肌纤维母细胞(Myofibroblasts)是结缔组织损伤修复过程中一过性出现的介于成纤维细胞和血管平滑肌细胞的一类细胞,具有极强的收缩、增殖和分泌细胞外基质的能力,损伤修复完成后肌纤维母细胞也随之消失,因此,正常组织没有肌纤维母细胞。但在慢性疾病过程中肌纤维母细胞可以持续存在,导致细胞外基质沉积并最终引起组织纤维化(Fibrosis)[1]。转化生长因子 (Transforming grow th factor,TGF-β1)、结缔组织生长因子(Connective tissue growth factor,CTGF)肌纤维母细胞与肺纤维化进展过程关系密切。胡永斌等[2]研究表明 TGF-β1能诱导人胚肺成纤维细胞表型活化为肌纤维母细胞。本研究探讨 CTGF促进T GF-β1诱导活化的肌纤维母细胞增殖作用及其分子机制。
材料与方法
1 实验材料 人胚肺成纤维细胞系 HLF,兔抗人 ERK1/2抗体,p-ERK1/2抗体购自南京凯基生物科技发展有限公司生物。 PD98059(ERK1/2活化特异性阻断剂 )购自 invivogen公司。 CTGF、TGF-β1购自Pepro Tech Inc。α-SM A抗体武汉博士德生物技术有限公司。MT T华美生物技术公司。
2 实验方法
2.1 Western蛋白印迹法检测α-SMA蛋白水平待 HLF细胞进入对数生长期,无血清培养液饥饿24h后,加入 TGF-β1(15ng/ml)预处理细胞 48h后再分为对照组,CTGF刺激组(100ng/ml),PD98059+CTGF刺激组(50 μ M PD98059预处理 30 min后再加100ng/ml CTGF),单独 PD98059刺激组,以上各组均刺激 48h。用细胞裂解液裂解细胞,用 Bradford法测定蛋白浓度,等量取 70 μ g总蛋白加入等体积无还原剂的 2倍 SDS上样,用缓冲液混匀,沸水浴 5min。以10%SDS-PAGE电泳分离 (恒压 80V约 100min),转移蛋白至 PVDF膜上,5%无脂奶粉封闭液中室温封闭 1h,与适量α-SM A抗体摇床孵育 (4℃,杂交过夜),PBST漂洗 4次 ,每次 10min,HRP标记二抗(羊抗小鼠 )室温孵育 1h,PBST漂洗 4次,每次 10min.ECL显色,X胶片曝光。 TYPHOON扫描仪成像,采用Imagequant TL软件分析蛋白条带。实验重复 3次。以β-actin为内参。
2.2 MT T法检测细胞增殖 待 HLF细胞进入对数生长期,0.25%胰酶消化后制成细胞悬液,按1500/孔接种于 96孔培养板。培养 24h后,换无血清培养液饥饿 24h后,加入 TGF-β1(15ng/ml)预处理细胞48h后再随机分为对照组:每孔加入含 1%小牛血清的培养液 200 μ l,CTGF刺激组(100ng/ml):每孔加入含CTGF(100ng/ml)的 1%小牛血清培养液 200 μ l,PD98059+CTGF刺激组:(50 μM PD98059预处理 30 min后再加入含 CTGF(100ng/ml)的 1%小牛血清培养液 200 μ l),单独 PD98059刺激组:每孔加入含 50 μ M PD98059的 1%小牛血清培养液 200 μ l。各组均刺激48h后每孔加入 5mg/mlMT T各 20 μ l,培养箱内培养4h后,加入 DMSO室温震荡 20min后,在 Bio Tek酶标仪 490nm处测定每孔的吸光度值。每组各设 4个复孔及 2个空白孔。
2.3 Western蛋白印迹法测定 p-ERK-1/2,ERK-1/2蛋白水平 TGF-β1(15ng/ml)预处理细胞48h后,再用 100ng/ml CTGF刺激细胞,分别于0min、15min、30min、60 min四个时间点检测 p-ERK-1/2、ERK-1/2表达。用细胞裂解液裂解细胞,等量取40μ l蛋白以 10%SDS-聚丙烯酰胺凝胶电泳分离,转移蛋白至 PVDF膜上,5% 无脂奶粉室温封闭 1h,分别与抗 p-ERK-1/2抗体(1∶1000)、ERK-1/2抗体(1∶1000)4℃孵育杂交过夜,ECL显色,X胶片曝光。TYPHOON扫描仪成像,采用 Imagequant TL软件分析蛋白条带,以 p-ERK-1/2与 ERK-1/2比值判断结果。实验重复 3次。
3 统计学处理 本组采用 SPSS13.0软件进行统计分析,计量资料以表示,采用单因素方差分析,以 P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 Western蛋白免疫印迹检测α-SMA蛋白表达见图 1~ 2。 TGF-β1预处理细胞后对照组有α-SMA蛋白表达,CTGF刺激组细胞内α-SM A蛋白水平明显高于对照组(P<0.01),PD98059+CTGF刺激组的α-SMA蛋白表达明显低于 CT GF刺激组(P<0.05),而单独 PD98059刺激组与对照组相比α-SMA水平也无明显变化(P> 0.05),说明 PD98059本身对α-SMA表达无影响。
2 M TT法检测细胞增殖 见附表。CTGF刺激组细胞增殖明显与对照组相比(P<0.01),PD98059+CTGF刺激组与 CTGF刺激组相比增殖明显下降(P<0.05),而单独 PD98059刺激组与对照组相比细胞增殖无明显变化(P> 0.05),说明 PD98059本身对细胞增殖无影响。
3 Western蛋白印迹法测定 P-ERK-1/2,ERK-1/2蛋白水平 见图 3。CTGF刺激细胞 15min时能明显诱导细胞内 ERK-1/2磷酸化与 0min相比(P<0.01)30min时达到高峰,60min时下降到基础水平。

图1 α-SM A蛋白在各组中相对光密度表达 1示对照组;2示 CTGF组;3示 PD98059+CTGF组;4示 PD98059刺激组
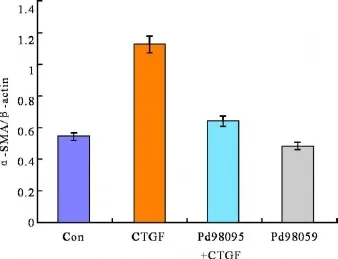
图2 CTGF刺激 TGF-β1预处理的细胞对细胞内α-SM A表达的影响及 PD98059对其阻断作用

图3 p-ERK,ERK相对光密度表达
附表 各组细胞增殖增殖情况(±s)
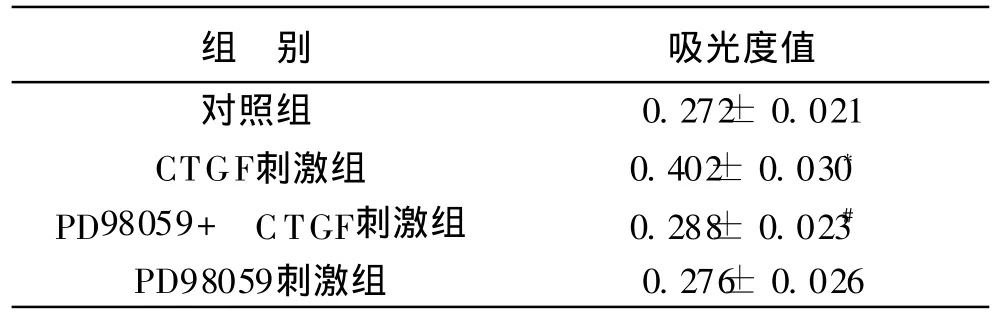
附表 各组细胞增殖增殖情况(±s)
注:*与对照组比较,P<0.01;#与 CTGF组比较,P<0.05
组 别 吸光度值对照组 0.272±0.021 CTGF刺激组 0.402± 0.030*PD98059+ CTGF刺激组 0.288± 0.023#PD98059刺激组 0.276± 0.026
讨 论
肺纤维化的主要病理特征是间质成纤维细胞,肌纤维母细胞大量增殖及细胞外基质大量聚积,其中肌纤维母细胞是产生和分泌细胞外基质的主要效应细胞。另一方面肌纤维母细胞在纤维化部位持续存在还有利于异常的肺泡上皮重建,体外研究[3]表明,IPF中的肌纤维母细胞分泌血管紧张素肽,它能诱导邻近肺泡上皮细胞凋亡。此外,IPF中的肌纤维母细胞还具有其他表型特征,如提高自身的迁移能力,增加自身的收缩性[4]。因此,肌纤维母细胞的存在如否和数量多少被认为是预测慢性纤维化疾病预后的良好指标。在肺组织纤维化慢性进展过程中,肌纤维母细胞的来源既由组织局部成纤维细胞和肺泡上皮上皮细胞在各种炎症因子刺激下不断转化而来,也可来源于肌纤维母细胞的增殖。胡永斌等[2]实验已经证明 TGF-β1能够诱导成纤维细胞转化为肌纤维母细胞。本实验在 TGF-β1诱导下,成纤维细胞转化为肌纤维母细胞后,再以 CTGF刺激可以使α-SM A水平增加,M TT法进一步证实CTGF是通过促进这种转化的肌纤维母细胞增殖而上调α-SMA蛋白。提示 CTGF和 T GF-β1在促进肌纤维母细胞生成的作用环节不同,即 TGF-β1诱导成纤维细胞表型转化生成肌纤维母细胞,CTGF促进肌纤维母细胞增殖。本研究显示 CTGF可促进细胞外基质的主要来源细胞—肌纤维母细胞增殖,说明 CTGF在肺纤维化疾病的发病环节中起重要作用。CT GF促肌纤维母细胞增殖的分子机制是值得我们深入了解的问题。丝裂素活化蛋白激酶(MAPK)转导途径是细胞增殖与分化信号传导的共同通路,是成纤维细胞等许多细胞中多种信号向核内传递的共同途径。其中 ERK1/2及其磷酸化连锁反应在有丝分裂细胞分化的过程中非常关键,是细胞转型和增殖的关键酶。ERK1/2活化是很多细胞通过 G1限制点进入 S期所必须的。我们通过观察 CTGF对肌纤维母细胞内 ERK-1/2信号途径的影响发现 CTGF可以明显活化 ERK-1/2;并且用ERK-1/2活化特异阻断剂 PD98059可以明显阻断CTGF引起的细胞增殖和α-SM A增加。说明 CTGF促肌纤维母细胞增殖效应是通过 ERK-1/2信号途径介导的,这与 Yosimichi等[5]的 CTGF通过 Erk-1/2信号通路促进软骨细胞增殖的报道一致。说明阻断CTGF的信号通路可以有效抑制 CTGF促肌纤维母细胞增殖效应。本研究探讨了 CTGF促进 TGF-β1诱导活化的肌纤维母细胞增殖作用及其分子机制,为CTGF成为干预肺纤维化的药物靶标提供了理论基础。
[1] Badid C,Vincent M,Fouque D,et al.Myofibroblast:a prognosticmarker and target cell in progressive renal disease.Ren Fail,2001,23:543-549.
[2] 胡永斌,初 令,李 翔,等.转化生长因子β1对人胚肺成纤维细胞平滑肌 肌动蛋白表达的影响.中华结核和呼吸杂志,2004,27(7):488-490.
[3] Selman M,Thannickal V J,Pardo A,et al.Idiopathic pulmonary fibrosis.Drugs,2004,64(4):405-430.
[4] Miki H,Mio T,Nagai S,et al.Fibroblast contractility:usual interstitial pneumonia and nonspecific interstitial pneumonia.Am J Respir Crit Care Med,2000,162(6):2259-2264.
[5] Yosimichi G,Nakanishi T,Nishida T,et al.CTGF/HCS24induces chondrocyte differentiation through p38 mitogen-activated protein kinas( p38M APK),and proliferation through ap44/42M APK/extracellularsignal regulated kinase(ERK).Eur JBiochem,2001,268(23):6058-6065.

