藜草花粉特异性致敏哮喘动物模型的制备
西安交通大学医学院第二附属医院呼吸内科(西交 710004)
王胜昱* 孙秀珍 卢家美 张 明 吴媛媛
支气管哮喘是全球范围内最常见的慢性呼吸道疾病,无地域和种族的局限性,也无年龄和性别的差异。它具有慢性反复发作的特点,严重者可危及生命。然而由于支气管哮喘的发病机制复杂,并且相关研究涉及到人体时会受到种种限制,因此有关病因的确定、发病机制的探索、新治疗方法的评价、新药的研究与开发在相当程度上均需要通过动物实验进行,故制备哮喘动物模型可在一定程度上达到研究目的。从气传致敏花粉种类中调查发现,藜草是我国许多地方夏秋季节大气中最常见的气传致敏花粉之一[1]。孙秀珍等[2]研究发现哮喘患者藜草花粉 ID及 sIgE阳性率在 40%以上。因此,构建藜草花粉致敏的哮喘动物模型为今后研究藜草花粉过敏性哮喘的发病机制和探索新的治疗手段打下基础。
材料与方法
1 动物与试剂 清洁级健康 BALB/c小鼠 40只,3~4周龄,雌性,体重 16±2g,购于西安交通大学医学院实验动物中心,按随机数字法分为:①空白对照组、②低剂量组、③中剂量组、④高剂量组,每组 10只,并用苦杏仁酸标记。藜草花粉由本实验室采摘并保存;氢氧化铝凝胶有本实验室自制;IL-4、IFN-γ、IgE、IgG1(ELISA)检测试剂盒购于西安沃尔森生物技术有限公司。
2 藜草花粉粗制变应原诱导小鼠肺部变态反应模型的的建立 空白对照组腹腔注射 PBS100 μ l加氢氧化铝 2mg,低剂量组腹腔注射 100 μ g/100 μ l藜草粗制变应原加氢氧化铝 2mg致敏,中剂量组腹腔注射200 μ g/200 μ l藜草粗制变应原加氢氧化铝 2mg致敏,高剂量组腹腔注射 300 μ g/300 μ l藜草粗制变应原加氢氧化铝 2mg致敏。第 9、17天后加强致敏方法剂量同前。在第 25天空白对照组用 PBS代替变应原滴鼻激发 ,低剂量组采用 100 μ g/10 μ l藜草变应原激发 ,中剂量组采用 200 μ g/20 μ l藜草变应原激发,高剂量组采用300 μ g/30 μ l藜草变应原激发 ,每天 1次 ,连续 3d。最后1天滴鼻后 24h进行以下检查。
3 气管肺泡灌洗(BAL)及取血 小鼠麻醉后,眼窝取血,收集到 Eppendorf管中,3000 rPmin离心20 min,血清转移到另一个干净的 Eppendorf管中,-20℃保存。气管切开和气管插管,注入 PBS 0.4ml,灌洗 3~ 4次,灌洗液回收率> 80%。 BALF经900rPmin离心 10min后,在 1 h内作细胞分离,上清液于-20℃储存,作细胞因子测定。
4 BALF中细胞总数、细胞分类 取离心后的沉淀细胞,用 PBS洗两次,稀释成 1 ml悬液,将细胞悬液混匀后加入血细胞计数板,显微镜下进行细胞计数。另取 0.2ml于洁净光滑载玻片上涂片,以瑞氏染液染色,光学显微镜下进行细胞分类,数 300个细胞,求出各类细胞的百分比。
5 BALF中 IL-4的浓度测定 IL-4的测定按ELISA试剂盒说明书进行。即每孔加入标准品稀释液或待测样品 100 μ l,将反应板充分混匀后置 37℃孕育120min,用洗涤液洗板 4~6次,向滤纸上印干。加入酶标抗体工作液 100 μ l,将反应板充分混匀后置 37℃孕育 30min,洗涤液洗板 4~ 6次,加入底物工作液100 μl,置 37℃暗处反应 15min,加入 100 μl终止液终止反应,30min内用酶标仪在 450nm处测吸光值。所有OD值都应减除空白值后再行计算。以标准品 2000、1000、 500、 250、 125、 62.5、 31.2、 0 pg/ml为横坐标 ,OD值为纵坐标,在坐标纸上作图,画出标准曲线。根据样品 OD值在该曲线图上查出相应 IL-4含量。
6 BALF中 IFN-γ的浓度测定 IFN-γ的测定按 ELISA试剂盒说明书进行。即每孔加入标准品稀释液或待测样品 100 μ l,将反应板充分混匀后置 37℃孕育 120min,用洗涤液洗板 4~6次,向滤纸上印干。加入酶标抗体工作液 100 μ l,将反应板充分混匀后置37℃孕育 30min,洗涤液洗板 4~ 6次,加入底物工作液 100 μ l,置 37℃暗处反应 15 min,加入 100 μ l终止液终止反应,30min内用酶标仪在 450nm处测吸光值。所有 OD值都应减除空白值后再行计算。以标准品2000、1000、500、250、125、 62、31、0 pg/ml为 横坐标 ,OD值为纵坐标,在坐标纸上作图,画出标准曲线。根据样品 OD值在该曲线图上查出相应 IFN-γ含量。
7 肺组织学检查 打开胸腔,分离并取下肺组织,进行病理组织学检查。肺脏再以 10%中性甲醛灌注固定 24h,石蜡包埋,常规切片,进行支气管、肺组织HE染色,以检测肺组织炎症细胞浸润;根据Underwood的标准对肺组织炎症细胞浸润评分,根据血管周围和气道周围细胞浸润情况不同分为 0~ 5分。
8 血清中特异性 IgG11mg/ml的变应原粗浸液用 pH9.6的包被液稀释至终浓度为 10 μ g/ml,加入100 μl/孔到 96孔板中,4℃过夜。 用 PBST(含 0.05%tween)洗板 5次 ,加入封闭液 100 μ l/孔 ,37℃孵 育120min,再用 PBST洗板 5次。将各组小鼠血清按一定比例稀释,分别加入 100 μ l/孔已包被粗制变应原的 96孔酶标板中,37℃孵育 120min,用 PBST洗液洗板 5次,每孔加入已稀释的 HAM A-Ig G1(1∶2000),37℃孵育 120min,PBST洗板 5次,加入含 0.5mg/ml邻苯二胺(OPD)的磷酸-柠檬酸缓冲液,37℃避光显色20min,加入终止液终止反应,30min内用酶标仪在450nm处测吸光值。
9 血清中特异性 IgE 1mg/ml的变应原粗浸液用 pH9.6的包被液稀释至终浓度为 10 μ g/ml,加入100 μl/孔到 96孔板中,4℃过夜。 用 PBST(含 0.05%tween)洗板 5次 ,加入封闭液 100 μ l/孔 ,37℃孵 育120min,再用 PBST洗板 5次。将各组小鼠血清按一定比例稀释,分别加入 100 μ l/孔已包被粗制变应原的 96孔酶标板中,37℃孵育 120min,用 PBST洗液洗板 5次,每孔加入已稀释的 HAM A-IgE(1∶1000),37℃孵育 120min,PBST洗板 5次,加入含 0.5mg/ml邻苯二胺 (OPD)的磷酸-柠檬酸缓冲液,37℃避光显色20min,加入终止液终止反应,30min内用酶标仪在450nm处测吸光值。
10 脾组织匀浆 IL-4和 IFN-γ的产生 将处死的免疫小鼠浸入 75%乙醇中消毒 2~3s,置超净台,再次局部消毒皮肤,无菌条件下摘脾,并依次在 4°条件下研磨、PBS冲洗、用 RIPA裂解液裂解,并在 4°下4000r/m离心 10min,取匀浆液上清。用 ELISA方法测定 IL-4和 IFN-γ,方法同前。
结 果
1 肉眼观察 空白对照组小鼠体重较前增加,食欲 精神好,皮毛光亮,眼睛明亮,大小便正常,无死亡。致敏小鼠后普遍烦躁,聚集成堆,活动减少,可看见腹式呼吸,并且随着剂量增加小鼠反应明显强烈,1~2d后恢复正常。在高剂量组中有两只小鼠死亡。
2 病理变化 见表 1及图 1~5。小鼠肺组织炎症病理评分按低、中、高剂量组依次增高。低、中、高剂量组模型组与空白对照组比较,血管周围和气管周围存在明显的炎症细胞浸润。高剂量组小鼠支气管、血管黏膜下和周围肺组织有明显的炎症细胞浸润,以巨噬细胞和嗜酸性粒细胞为主,大量炎症细胞向小支气管和血管迁移,上皮细胞部分有脱落,肺泡内有水肿,且有黏液上皮化生。中、低剂量组中炎性细胞数量及其分类明显低于高剂量组。而空白对照组气管结构无明显改变,小鼠支气管黏膜上皮 黏膜肌层基本完好,支气管管腔规则,周围无炎症细胞浸润。

表1 小鼠肺组织病理评分(分)
3 BALF中细胞学变化 见表 2。 BALF以巨噬细胞为主,低、中、高剂量组中细胞总数、嗜酸性粒细胞、中性粒细胞、单核细胞、及淋巴细胞比例均明显高于空白对照组(P<0.05)。表明藜草花粉可诱导气管炎症反应。
4 BALF中 IL-4和 IFN-γ的测定 与空白组相比较,低、中、高剂量组小鼠在致敏激发后,BALF中IL-4含量明显升高,而 IFN-γ明显下降,(P<0.05)。提示 BALF中 Th2型细胞因子产生,抑制 Th1型细胞因子分泌。
5 血清中特异性 Ig E和 Ig G1测定 与空白组相比较,低、中、高剂量组小鼠在致敏激发后,小鼠产生抗原特异性 IgE和 IgG1,与空白组相比较有显著性差异(P<0.05)。说明藜草花粉粗制变应原能诱导小鼠产生特异性 Ig E和 IgG1。
6 脾组织匀浆 IL-4和 IFN-γ的测定 与空白组相比较,低、中、高剂量组小鼠在致敏激发后,脾组织中IL-4含量明显升高,而 IFN-γ明显下降(P <0.05)。表明藜草花粉粗制变应原能诱导小鼠脾脏产生 Th2型细胞因子,抑制 Th1型细胞因子分泌。

表2 肺泡灌洗液中细胞学改变
讨 论
支气管哮喘是一种以嗜酸性粒细胞浸润为主的慢性气管炎症性疾病。引起气管炎症的是由肥大细胞、巨噬细胞、嗜酸性粒细胞、中性粒细胞和上皮细胞等多种炎症细胞以及 50余种炎症介质和细胞因子共同参与、相互作用的结果。尽管近年来对支气管哮喘的研究已进入分子和细胞水平,国际上对其防治也制定了规范化指导文件,但全球许多国家和地区哮喘的患病率和病死率均呈上升趋势。
目前已制备出多种变应原的动物模型。 Huston等[3]首先用 OVA制成豚鼠吸入致敏的哮喘模型。Carvalho等[4]在大鼠皮下接种热凝结的 OV A小片段,2~ 3周后用聚合 OV A气管内激发。这一方法不用佐剂,不需加强免疫,能够产生发作期气管高反应性(AHR)并诱导持续的气管 EOS浸润和活化,且具有类似人类哮喘的 Th2独特型的肺组织病理学改变,其缺点是不具备哮喘患者在非发作期持续的 AHR。Carr等[5]给麻醉状态下的小鼠鼻内接种 15 μ l包含1000EID50的 A型流感病毒,接种 4d后观察到气管内有多种炎症细胞聚集,并可见气道上皮细胞广泛变性。Konno等[6]给 BALB/C小鼠气管内滴注 LPS发现支气管平滑肌对乙酰胆碱的反应性显著升高。Ray等[7]将豚鼠在麻醉状态下行气管插管,给予 CO2机械过度通气发现气管阻力增加,肺动态顺应性下降。我国研究者迟磊等[8]则另辟奚径,在大鼠两侧腹股沟、腹、前足趾皮下注射 OVA成功地建立大鼠支气管哮喘模型。另有郝敏麒等[9]将屋尘螨 Dep1和 Dep2用 PBS稀释为 1g/L从而用较少量的螨取液建了 BALB/c小鼠尘螨支气管哮喘模型。
小鼠的免疫及遗传背景较为清楚,品系纯正,可用于小鼠的免疫学及分子生物学试剂来源广泛齐全。小鼠本身的价格相对低廉,所需试剂的量相对较少,易于喂养,操作方便且一个人可独立完成。因此,实验中使用小鼠变应性疾病的模型越来越多。不同品系小鼠对OVA的免疫反应亦不同,BALB/c小鼠致敏后可产生高滴度的 IgE,C57BL/6小鼠只产生低滴度的IgE[10]。本实验选用了 BALB/c小鼠构建哮喘模型,通过对小鼠腹腔注射和滴鼻激发不同剂量藜草花粉粗制变应原,从肺组织病理变化结果发现小鼠肺组织变态反应炎症逐渐加重,巨噬细胞和嗜酸性粒细胞随抗原剂量增加而增加,表现为气管和血管周围出现大量的炎症细胞浸润。BALF中细胞学变化显示:小鼠 BALF存在大量炎症细胞,巨噬细胞和嗜酸性粒细胞随抗原剂量增加而增加,其病理变化与人类过敏性哮喘的病理变化有一定相似。
此外我们在研究中也发现个别老鼠肺部炎症反应不明显,支气管肺泡灌洗液中细胞分类嗜酸性粒细胞不高,可能与老鼠周龄在入组时偏差有关。黄华琼等[11]研究证实小鼠越在生命早期经过敏原激发,肺部炎症和气管高反应性越容易产生;而周龄过大的小鼠肺部炎症反应则不明显。支气管哮喘的特征是 Th1型淋巴细胞反应与 Th2型淋巴细胞反应的失衡。 Th1型淋巴细胞主要分泌 IFN-r等细胞因子,Th2型淋巴细胞主要分泌 IL-4,IL-5等细胞因子。Th2型细胞因子分泌增多,诱导嗜酸性粒细胞聚集,合成 IgE抗体增多,使 Th1型淋巴细胞应答受到抑制。在我们的研究中,高剂量组的脾组织匀浆与肺泡灌洗液中 IL-4明显高于其他组,而 IFN-r却显著降低;血中特异性 Ig E和 IgG1显著上升均表明藜草花粉粗制变应原成功诱导 Th2型淋巴细胞反应。本实验通过制备藜草花粉粗制变应原,腹腔注射与滴鼻激发两种方式成功构建 BALB/C小鼠变态反应气管炎症动物模型,必将会对以后研究藜草花粉所致过敏性哮喘的发病机制、病理生理及其免疫治疗打下基础。
(本文图片见封3)

图1 高剂量组小鼠肺组织内有明显炎细胞浸润(HE×400)
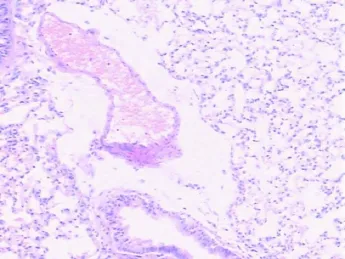
图2 高剂量组小鼠肺组织内可见肺泡内水肿(HE×100)

图3 高剂量组小鼠肺组织内可见上皮化生(HE×400)

图4 中剂量组炎性细胞明显低于高剂量组(HE×400)

图5 低剂量组炎性细胞浸润明显低于高剂量(HE×100)

图6 对照组小鼠肺内结构完好,无炎性细胞浸润(HE×100)
[1] 叶世泰.中国气传致敏花粉的调查[M].北京:北京出版社,1991:29-30.
[2] 孙秀珍 ,李雅莉,张 洁,等.BSA-ELISA法检测血清中草及藜草花粉特异性 IgE.中国公共卫生杂志,2002,3(3):318-319.
[3] Hutson PA,Church M K,Clay TP,et al.Early and latephase brochoconstriction afterallergen challenge of nonanesthetized guineapigs 1. The association of disordeed airway physiology to leukocyte infiltration.Am Rev Respir Dis,1988,137(3):548-557.
[4] Carvalho C,Jancar S,Mariano M,et al.A rat model presenting eosinophilia in the airways,lung eosinophil activation,and pulmonary hyperreactivity.Exp Lung Res,1999,25(4):303-316.
[5] Carr M J,Spalding LJ,Goldie RG,et al.Distribution of immunoreactive endothelin in the lungs of mice during respiratory viral infection.Eur Respir J,1998,11(1):79-85.
[6] Konno S,Asano K,Gonokami Y,et al.Effect of azelastine on endotoxin-induced airway hyperresponsiveness in mice. Int Arch Allergy Immunol,1995,108(3):292-297.
[7] Ray DW, Hernandez C, MunozN,etal.Bronchoconstriction elicited by isocapnic hyperpnea in guinea pigs.J Appl Physiol,1988,65(2):934-939.
[8] 迟 磊,符 州,戴继宏,等.过敏性哮喘大鼠模型的建立.重庆医学,2003,32(4):429-431.
[9] 郝敏麒,徐 军,钟南山.尘螨致敏小鼠肺部变应性炎症模型的建立.中国病理生理杂志,2003,19(1):139-141.
[10] 刘传和,薛全福.支气管哮喘动物模型的研究状况.中华结核和呼吸杂志,2000,23(11):647-649.
[11] 黄华琼,王娇莉,沈华浩.不同致敏和激发时间对哮喘模型的影响.中国病理生理杂志,2008,24(11):2285-2288.

