DNA在SiO2纳米粒子薄膜表面的单分子行为研究
殷晓燕,何彦
(湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
0 引言
随着科学技术的突飞猛进,材料科学在人们生产、生活的各个领域中起着越来越重要的作用,一直是人类社会技术进步,社会发展的基础。所谓纳米材料是指三维空间尺度至少有一维处于纳米量级(1~100 nm)的材料,它是由尺寸介于原子、分子和宏观体系之间的纳米粒子所组成的新一代材料[1],具有比表面积大、表面结合能极强[2]等特点,导致了它具有传统固体材料所不具有的许多特殊性能,如高硬度、高强度、高韧性、高表面活性等等。因此,纳米材料在国防、电子、化工、核技术、航空、冶金、轻工、医药等领域中具有重要的应用价值,故近年来这一领域形成了新的交叉学科研究热点。
纳米膜是薄膜科学的重要研究内容[3~4],也是物理学、电子学、化学、生物学等多学科交叉渗透的研究领域。微电子学、催化化学、仿生电子学、光学、电学等的发展需要在纳米尺度上对功能薄膜进行构筑,实现纳米器件、纳米催化、分子开关及膜传感器等的实际应用。生物分子在固体表面的物理特性和力学行为,以及生物分子对被吸附表面的物理、力学特性的影响越来越受到研究者们的关注,尤其是在分子电子器件、生物分子识别、生物粘附以及自组装、纳米润湿、金属防腐等领域,都是令人感兴趣的课题。生物分子在固体表面的吸附行为在纳米技术领域扮演着重要的角色。
纳米SiO2作为纳米材料中的重要组成部分,是一种无毒、无味、无污染的非金属材料。对电子封装材料、高分子复合材料、陶瓷、橡胶、塑料、玻璃钢、粘结剂、密封胶、涂料等诸多行业产品的提高档次、升级换代带来划时代的意义,SiO2纳米粒子具有很强的应用前景。而SiO2纳米薄膜优越的电绝缘性和工艺的可行性,使之在微电子工艺中具有独特优势。另外,SiO2纳米薄膜可用于制备光学增透膜[5]、传感器敏感薄膜[6]等领域。既然SiO2纳米薄膜有如此重要的作用,因此,很有必要从单分子水平上研究SiO2纳米薄膜的表面性质。
采用了溶胶-凝胶的方法合成了200 nm的SiO2粒子[7],并在洁净的盖玻片表面经旋转成膜法形成薄膜。应用物镜型全内反射荧光显微镜(Total Internal Reflection Fluorescence Microsocpe,TIRFM)和微分干涉显微镜(Differential Interference Contrast Microscope,DIC),以YOYO-1标记的λ-DNA分子为探针,研究了单个DNA分子在SiO2纳米粒子薄膜表面的行为,并在不同的pH值下,考察了pH值对单个DNA分子在SiO2纳米粒子薄膜表面行为(DNA自由运动和吸附)的影响,并用接触角(CA)和原子显微镜(AFM)表征了SiO2纳米粒子薄膜的表面性质。
1 实验部分
1.1 试剂与仪器
浓硫酸(98%)、双氧水、醋酸、醋酸钠、氯化钠、氨水(25%)、无水乙醇和正硅酸四乙酯(Tetraethyl orthosilicate,TEOS)为上海国药集团化学试剂有限公司产品,甘氨酸(Gly)为Sigma(Svt.Louis,USA)产品,λ-DNA(48,502 bp)购于美国的Promega公司,嵌入式染料YOYO-1购于美国的Molecular Probe公司。所用水均为二次蒸馏水。
缓冲液:不同pH的醋酸-醋酸钠缓冲液(pH为4.02,4.42,4.96,5.43,5.96,6.41,6.78,8.20)的离子强度均为25 mmol/L。
SB3200DT超声波清洗机购于宁波新芝生物科技股份有限公司,均胶机购于上海凯美特功能陶瓷技术有限公司,循环水式多用真空泵为郑州长城科工贸有限公司产品,接触角测量仪(JC2000C)购于上海中晨数字仪器有限公司。所有的原子力显微镜(Atomic Force Microscope,AFM)实验均使用多模AFM(SPI3800N-SPA,400,Seiko Instrument)仪器,操作模式为敲击模式,扫描速率为1.00 Hz。
TIRFM是日本尼康公司生产的ECLIPSE TE2000-U倒置显微镜,物镜为60×PlanApo/TIRFM(oil 1.45 NA),油(n=1.515)同为日本尼康公司产品。激发光源为氩离子激光器(488 nm/514 nm),购于上海埃奥激光设备有限公司。所用的相机为CoolSnap HQ2 CCD(Roper Scientific Inc.),像素是1392×1040,曝光时间是100 ms。图像由MetaVue(Roper Scientific Inc.)软件所得,所有图像均由Image J(1.37 V,NIH)进行处理。
1.2 DNA样品的制备
λ-DNA与YOYO-1染料按每5个碱基对(bp)1个YOYO-1的比例制备DNA样品。荧光染料YOYO-1的结构式如图1[8]所示,YOYO-1是一个同型二聚体,它以插入的方式与DNA结合[8]。当YOYO-1与DNA分子结合时因其较大的吸光系数和高荧光量子产率而被广泛应用于DNA的检测与分离[8~9],尤其在水溶液中YOYO-1与DNA的结合体比较稳定,便于实验的实施[10],因此常用于标记DNA分子。DNA样品制备溶液为pH8.20的10 mmol/L Gly-Gly缓冲液,母液浓度是200 pmol/L,在进行单分子荧光检测实验前,所有的溶液进一步稀释至10 pmol/L。
1.3 SiO2纳米粒子薄膜的制备
1.3.1 200 nm SiO2纳米粒子的合成[7]

图1 染料YOYO-1的结构示意图[8]Fig.1 Structural diagram of YOYO-1
将20 mL无水乙醇注入到洁净的三颈烧瓶中,分别加入1.59 mL 25%的氨水和1.63 mL二次蒸馏水,此溶液为A溶液。将1.5 mL正硅酸四乙酯溶于5.3 mL无水乙醇中,混合均匀,此为B溶液。在搅拌A溶液的同时迅速将B溶液倾入A溶液中,在室温下反应约15 h,并不断搅拌。
1.3.2 SiO2纳米粒子薄膜的制备
盖玻片用Piranha溶液(V(H2SO4)∶V(H2O2)=7∶3)浸泡6~7 h,用二次水超声1 h后,吹干备用。
将40 μL的SiO2溶液滴加在用Piranha溶液清洗好的盖玻片(Erie Scientific,USA)表面,经均胶机旋转在盖玻片表面形成单层膜,其旋转时参数如下:300 r/s,6 s;1 500 r/s,6 s。一部分样品直接进行单分子实验,另一部分则在烘箱中干燥7~8 h(70℃)后进行单分子实验。实验中未干燥的SiO2纳米粒子薄膜是指未经过7~8 h(70℃)处理。
1.4 单分子荧光成像实验
单分子实验中,先将表面经均胶机旋转形成SiO2纳米粒子薄膜的盖玻片置于显微镜的载物台上,先用DIC模式观察SiO2纳米粒子薄膜的表面形貌并拍照,在保持单层膜在载物台上位置不变的情况下,将5 μL DNA样品滴于盖玻片上,再将另一片未经过修饰且干净的盖玻片盖在上面,用TIRFM模式观察单个DNA分子在SiO2纳米粒子薄膜表面的行为。为了确保实验结果的可靠性,经过烘干和未烘干的SiO2纳米粒子薄膜需同时进行单分子实验。
1.5 接触角(CA)表征
SiO2纳米粒子薄膜表面的接触角(CA)测量采用接触角测量仪(JC2000C)进行测量。取3 μL二次水滴在SiO2纳米粒子薄膜上,为确保实验数据的可靠性,滴5个不同的部位,同时测量5次取其平均值。
2 结果与讨论
2.1 SiO2纳米粒子的表征
如图2所示,合成的SiO2纳米粒子具有良好的单分散性,且80%以上的SiO2纳米粒子的粒径在200~240 nm左右。
2.2 SiO2纳米粒子薄膜的AFM和CA表征
应用CA值的测量和AFM宏观地表征了烘干的SiO2纳米粒子薄膜表面的亲水性和表面形貌。表1给出了经过烘干的SiO2纳米粒子薄膜表面的接触角为(23.95±2.18)°,说明该表面是超亲水表面,但是与用Piranha洗液清洗的盖玻片的接触角相比要略微大些,说明烘干的SiO2纳米粒子薄膜表面疏水性比洁净的盖玻片表面稍强。SiO2纳米粒子薄膜表面形貌如图3所示,可知盖玻片表面经均胶机旋转形成SiO2纳米粒子薄膜相对比较均匀,但个别地方仍有缺陷。

表1 烘干的SiO2纳米粒子薄膜表面的CA值Tab.1 CA values of dry SiO2Nanoparticle film surface

图2 SiO2纳米粒子的TEM图(A)和粒径分布图(B)Fig.2 TEM image(A)and diameter distribution(B)of SiO2nanoparticles

图3 SiO2纳米粒子薄膜表面的AFM图Fig.3 AFM images of SiO2nanoparticle film surface
2.3 单分子荧光成像
通过DIC模式,在显微镜下可以看到SiO2纳米粒子薄膜的粗略形貌,图4 A-1和B-1分别是烘干和未烘干的SiO2纳米粒子薄膜利用DIC模式拍摄的照片,由图可知,经均胶机旋转形成SiO2纳米粒子薄膜并非完全铺满整个盖玻片表面,盖玻片的有些区域仍然是裸露的玻璃,说明这个薄膜是不完美的,即使薄膜表面仍是有缺陷,这与AFM结果是一致的。为了鉴别DNA的吸附是倾向于盖玻片还是SiO2纳米粒子薄膜,或者是更容易吸附在SiO2纳米粒子薄膜的缺陷中,单分子实验首先选择了一部分为裸露的盖玻片,另一部分为SiO2纳米粒子薄膜的区域以及含有SiO2纳米粒子薄膜缺陷的区域(图4A-1和B-1),在不同的pH值下对DNA进行成像实验,图4给出了在pH=4.96时的成像情况。由图4的A-2,A-3和B-2,B-3中可明显看出,无论SiO2纳米粒子薄膜烘干与否,DNA分子大部分都倾向于吸附在SiO2纳米粒子薄膜表面,但是个别分子也吸附在裸露的盖玻片表面或者SiO2纳米粒子薄膜的缺陷区域,因为在pH=4.96时,仍有个别DNA分子自由运动,当其运动至裸露的盖玻片表面或者SiO2纳米粒子薄膜的缺陷区域时造成吸附。由此证明,SiO2纳米粒子薄膜的个别缺陷或者不完美的情况并不影响整个单分子实验的准确性,数据是可信的。
为了进一步验证SiO2纳米粒子薄膜的不完美是否影响实验数据的准确及可靠性,对于烘干的SiO2纳米粒子薄膜表面,分别计算了DNA分子在其表面成像的整个区域(1392×1040像素)和截取的相对来说比较完美的全部都是SiO2纳米粒子薄膜的小区域(496×449像素)的吸附百分率。图5是DNA在烘干和未烘干的SiO2纳米粒子薄膜表面吸附百分率pH8.20~pH4.02值的变化曲线,由结果可知,无论是大区域还是小区域,其结果相似,由此也可证明SiO2纳米粒子薄膜的个别缺陷或者不完美的情况并不影响整个单分子实验的准确性。在pH=8.20时,DNA分子全部都是自由运动的,随着pH的降低,DNA分子开始在SiO2纳米粒子薄膜表面吸附,且其吸附百分率随着pH值的降低而逐渐增加。DNA的等电点是4~4.5,随着溶液pH值的降低,越来越接近其等电点,DNA表面所带的负电荷就越来越少。而在接近SiO2的pKa值(3)时,SiO2纳米粒子薄膜表面的硅烷醇就会发生质子化作用,使其表面成中性,此时SiO2纳米粒子薄膜表面与DNA之间的静电排斥力也就随之降低,这就有利于DNA分子在其表面的吸附。

图4 pH为4.96时,DNA单分子行为的成像照片,像素均为1392×1040(A-1),(A-2),(A-3)分别为烘干的SiO2纳米粒子薄膜基底的DIC照片,DNA在烘干的SiO2纳米粒子薄膜表面的TIRFM和DIC-TIRFM照片。(B-1),(B-2),(B-3)分别为未烘干的SiO2纳米粒子薄膜基底的微分干涉相差显微镜照片,DNA在未烘干的SiO2纳米粒子薄膜表面的TIRFM和DIC-TIRFM照片Fig.4 DIC image(1),TIRFM image(2)and DIC-TIRFM image(3)of single DNA molecular behavior on the dried(A)and not dried(B)surface of SiO2nanoparticle film at pH4.96.Image sizes are 1392×1040 pixels

图5 DNA在SiO2纳米粒子薄膜表面吸附量随pH的变化Fig.5 Fraction absorption of single DNA molecules at the SiO2nanoparticle film surface as a function of pH
另外,由图5可知,在相同的pH值下,DNA分子在烘干和未烘干的SiO2纳米粒子薄膜表面的吸附百分率是有差别的,后者的DNA吸附百分率略大一点。由于未烘干的SiO2纳米粒子薄膜表面含有一层很薄的水分子层,在低pH下,有利于SiO2纳米粒子薄膜表面的硅烷醇发生质子化,使其表面与DNA分子的经典排斥力更小。对于烘干SiO2纳米膜,从pH8.20到pH4.96,随着pH值的降低吸附率逐渐增加,但是其幅度较小,而当pH值为5.43时,吸附率迅速增大,而从pH5.43开始至pH4.02也是随着pH的降低吸附率逐渐增加,直至完全吸附,其幅度则很大。未烘干SiO2纳米粒子薄膜,其情况类似。
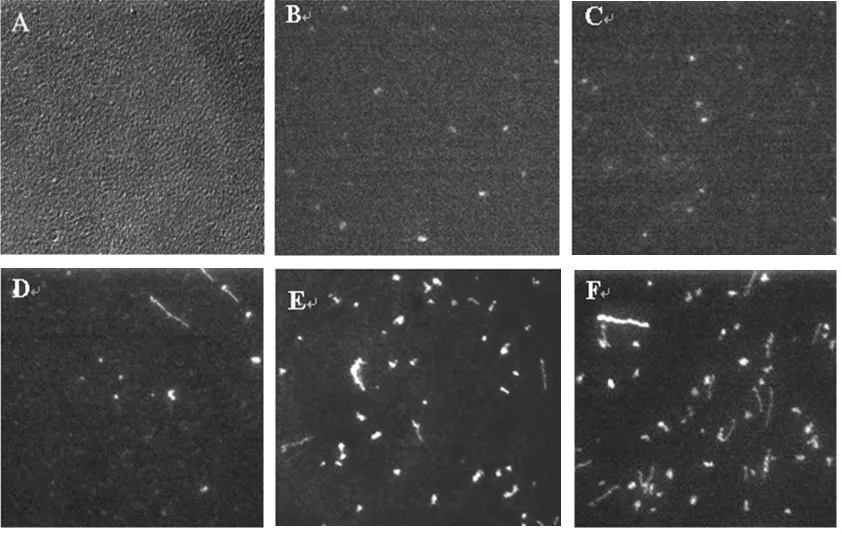
图6 不同pH值下DNA在烘干的SiO2纳米粒子薄膜表面的荧光照片(像素均为496×449(53.22 μm×48.27 μm))(A)为烘干的SiO2纳米粒子薄膜的DIC照片,(B)pH5.96,(C)pH5.43,(D)pH4.96,(E)pH4.42,(F)pH 4.02Fig.6 DIC image(A)and fluorescence images of single DNA molecules on the dried SiO2nanoparticle film surface at pH=5.96(B),5.43(C),4.96(D),4.42(E),4.02(F)
图6给出了DNA分子在不同pH值下,在烘干的SiO2纳米粒子薄膜表面行为的荧光照片,图A是截取的相对来说比较完美的全部都是SiO2纳米粒子薄膜的小区域(496×449像素)部分。通过照片可知,当pH=5.96时,少数DNA分子开始逐渐吸附在SiO2纳米粒子薄膜表面上,且可看到一端吸附,另一端则运动的现象(图6B),但是绝大部分的DNA分子仍然是自由运动的。在pH=5.43时,DNA的吸附百分率增加,并且可以看到DNA分子以短棒的形式吸附在其表面(图6C)。当pH降到4.96时,绝大部分的DNA分子已经吸附在SiO2纳米粒子薄膜表面,不仅有呈短棒状态的DNA分子,还可以看到个别的DNA分子已呈拉伸状态(图6D)。在进行单分子实验的过程中,通过显微镜可以看到DNA分子在SiO2纳米粒子薄膜表面的吸附并不是瞬间完成的,DNA分子的一端先吸附在SiO2纳米粒子薄膜表面,而另一端仍可以运动,随着溶液流动的方向,DNA分子的中部开始吸附在SiO2纳米粒子薄膜表面,最后DNA分子的另一端也吸附在SiO2纳米粒子薄膜表面,导致了DNA分子完全拉伸的状态,也完成了其在SiO2纳米粒子薄膜表面的吸附过程。根据先前文献的研究,DNA分子末端存在着12个未配对的碱基,该区域有较强的疏水性质,因此,DNA分子在SiO2纳米粒子薄膜表面的吸附行为可归结为静电作用和疏水作用的双重作用,但是起主导作用的是疏水作用。在pH=4.42时,DNA分子已经完全吸附在SiO2纳米粒子薄膜表面,且吸附的DNA分子总数明显增加,呈现短棒和完全拉伸的DNA分子个数也增加(图6E)。而当pH进一步降到4.02时,DNA分子则快速的完全吸附在SiO2纳米粒子薄膜表面,且呈现更多已经完全拉伸的DNA分子(图6F)。
无论是在烘干还是未烘干的SiO2纳米粒子薄膜表面,DNA分子的吸附百分率都要比在盖玻片表面的吸附百分率大得多(表2),这主要是由于以下几点原因引起的:第一,SiO2纳米粒子的比表面积大,在相同条件下,接触DNA的机会就大得多;第二,SiO2纳米粒子薄膜的表面活性(硅烷醇的数量)要比盖玻片大得多;第三,SiO2纳米粒子薄膜表面的疏水性比盖玻片强些(表2)。

表2 不同pH值下DNA在不同表面的吸附百分率Tab.2 Percentage adsorption of DNA molecules on various surfaces at different pH
3 结论
应用TIRFM和DIC模式,以YOYO-1标记的DNA分子作为探针,在不同的pH值下,从单分子水平上研究了DNA分子在SiO2纳米粒子薄膜表面的行为,并采用宏观的方法,即接触角和AFM表征了SiO2纳米粒子薄膜表面的性质。单分子实验表明,在pH=8.20时,DNA分子在SiO2纳米粒子薄膜表面全部都是自由运动的,随着pH的降低,DNA分子在SiO2纳米粒子薄膜表面的吸附百分率逐渐增加,直至完全吸附,并呈现拉伸的状态。DNA在SiO2纳米粒子薄膜表面的吸附行为归结为疏水作用和静电引力的双重作用结果,但是起主导作用的则是疏水作用。此外,DNA分子在SiO2纳米粒子薄膜表面的吸附百分率比文献报道的在盖玻片表面的吸附百分率要大得多,这是由于SiO2纳米粒子的比表面积大,表面活性位点多,且疏水性能强的缘故。
[1]李永军,刘春艳.一维无机纳米材料的研究进展[J].感光科学与光化学,2003,21(6):446~468.
[2]Zheng S,Zhang H E,Ross T V,et al.Silica colloidal crystals for enhanced fluorescence detection in microarrays[J].Analytical Chemistry,2007,79(10):3 867~3 872.
[3]Zheng S,Ross E,Legg M A,et al.High-Speed electroseparations inside silica colloidal crystals[J].Journal of the American ChemicalSociety,2006,128(28):9 016~9 017.
[4]孙继红,章斌,徐耀,等.SiO2光学增透膜的制备及光学性能[J].光学技术,2000,26(2):104~106.
[5]Anette L,Christina C,Mats J,et al.Characterization of the binding of the fluorescent dyes YO and YOYO to DNA by polarized light spectroscopy[J].Journal of American Chemical Society,1994,116(19):8 459~8 465.
[6]Rye H S,Yue S,Wemmer D E,et al.Stable fluorescent complexes of double-stranded DNA with bis-intercalating asymmetric cyanine dyes:properties and applications[J].Nucleic Acids Research,1992,20(11):2 803~2 812.
[7]Rye H S,Dabora J M,Quesada M A,et al.Fluorometric assay using dimeric dyes for double-and single-stranded DNA and RNA with picogram sensitivity[J].Analytical Biochemistry,1993,208(1):144~150.
[8]康睿宇,徐国想,曹静雅.纳米SiO2的制备、改性和应用[J].化工时刊,2006,20(10):60~64.
[9]Kang S H,Shortreed M R,Yeung E S.Real-Time dynamics of single-DNA molecules undergoing adsorption and desorption at liquid-solid interfaces[J].Analytical Chemistry,2001,73(6):1 091~1 099.
[10]Mitschke F.Fiber-optic sensor for humidity[J].Optics Letters,1989,14(17):967~969.
[11]Carlsson C,Larsson A,Jonsson M,et al.Optical and photophysical properties of the oxazole yellow DNA probes YO and YOYO[J].The Journal of Physical Chemistry,1994,98(40):10 313~10 321.
[12]李永军,刘春艳.有序纳米结构薄膜材料[M].北京:化学工业出版社,2006,5~18.

