三聚氰胺修饰电极同位镀铋膜测定镉离子
任旺,张英
(四川理工学院化学与制药工程学院,四川自贡643000)
0 引言
重金属镉离子在水体中普遍存在并可长期蓄积,是不可降解的环境污染物,对人体健康造成潜在危害不容忽视[1]。因此,对镉离子的测定具有十分重要的现实意义。测定镉离子常用的方法有石墨炉原子吸收光谱法[2]、原子荧光法[3]和电化学法[4~7]等。电化学法由于简单易行、灵敏度高而引起人们的重视。该文实验中首次采用三聚氰胺修饰玻碳电极,再同位镀铋膜后采用差分脉冲溶出伏安法来测定镉离子的浓度。该修饰电极制备简单,重现性和稳定性较好,抗干扰能力强,能快速、准确测定水样中镉离子含量。
1 实验部分
1.1 仪器与试剂
CHI440A型电化学工作站(上海辰华仪器公司),pHS-3D型酸度计(上海大普仪器有限公司),UP3200H超声波清洗器(熊猫集团南京计量有限公司),AB204-S电子天平(瑞士Metter Toledo公司)。实验用三电极系统,玻碳电极为工作电极,铂电极为对电极,Ag/AgCl电极为参比电极。
聚氰胺(A.R,成都市科龙化工试剂厂),硫酸镉、硝酸铋(A.R,成都金山化学试剂有限公司)。其余所用试剂均为分析纯,实验用水为二次蒸馏水。不同pH的磷酸缓冲溶液(PBS)均用0.1 mol/LNa2HPO4,0.1 mol/L NaH2PO4,0.1 mol/L KCl配制。
1.2 修饰电极的制备
将玻碳电极(φ=2 mm)分别用0.1、0.3和0.05 μm Al2O3粉末在鏖皮上打磨成镜面,用蒸馏水冲洗干净,然后分别用体积比为1∶1的硝酸溶液、无水乙醇和蒸馏水超声清洗1 min。将预处理好的玻碳电极浸没在1.0 mmol/L三聚氰胺溶液(pH8.04 PBS配制),在-1.0~1.0 V电位范围内循环扫描10周(扫速为50 mV/s)即可制得三聚氰胺修饰电极。
1.3 实验方法
取一定体积的硫酸镉标准溶液于电解池中,加0.2 mol/L H2SO4溶液1 mL和1.0×10-4mol/L的硝酸铋溶液0.5 mL,用双蒸水稀至10 mL体积,以-0.9 V为沉积电位沉积400 s,记录-1.0~0.2 V的差分脉冲溶出伏安图(DPV),并记录峰电流大小。
2 结果讨论
2.1 镉离子在三聚氰胺修饰电极上的电化学行为
图1中曲线a和曲线b分别为镉离子和铋离子在三聚氰胺修饰电极(曲线a)和裸玻碳电极上同电位沉积后的溶出伏安曲线(曲线b)。由图1可知,镉在三聚氰胺修饰电极上的溶出峰明显高于裸电极上的溶出峰,表明三聚氰胺修饰电极对镉的溶出有增敏作用。这可能是由于电极修饰三聚氰胺后活性中心增多,并且使镉离子与铋离子在该修饰电极上均匀更沉积,其溶出更彻底,提高了镉离子测定的灵敏度。
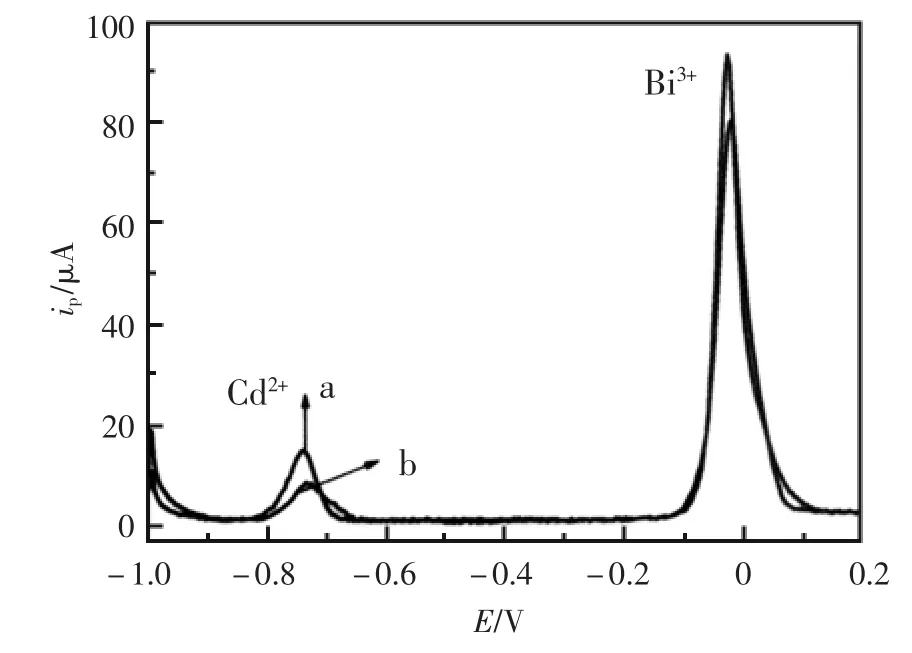
图1 6.0×10-7mol/L镉离子与5.0×10-5mol/L铋离子在三聚氰胺修饰电极(a)、裸电极(b)上的溶出曲线Fig.1 Stripping curves of the PM/GC electrode(a)and GC electrode(b)in 0.02 mol/L H2SO4with 5.0×10-5mol/L Bi3+and 6.0×10-7mol/L Cd2+
2.2 硫酸底液量的选择
如图2所示,曲线a-c分别为加入0.5 mL、1.0 mL和2.0 mL 0.2 mol/L H2SO4时Cd2+(2.0×10-6mol/L)的溶出曲线。从图中可以看出,随着加入硫酸量的增加镉离子的峰电流逐渐减小,但当H2SO4的量过少时测定的基线不稳,测定重现性差。因此,实验中选择1 mL 0.2 mol/L H2SO4的加入量为最佳测定条件。
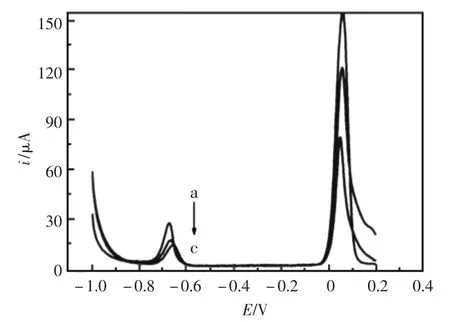
图2 Cd2+在不同浓度H2SO4溶液中的溶出曲线Fig.2 Effect of cH2SO4 on the anodic stripping of Cd at the PM/GC electrode
2.3 沉积时间与沉积电位的选择
采用差分脉冲溶出伏安法测定,其沉积的时间与沉积电位是影响镉离子(2.0×10-6mol/L)溶出峰高的重要因素。由图3A可知镉离子的溶出峰高在100~400 s沉积时间内随时间增加而迅速增大。当沉积时间大于400 s溶出峰增高的趋势逐渐趋于平稳,为了达到快速检测的目的,实验中选择400 s为沉积时间。如图3B所示,在-0.7~-1.1V的沉积电位内随电位负移,镉离子的溶出峰高先增后减,当电沉积电位达到-1.0 V时溶出峰达到最大值,为避免沉积电位太负时其它离子的还原而产生干扰,实验中选择-0.9 V为沉积电位。
2.4 干扰物质
实验结果表明,相对误差在±5%范围内,下列物质对6.0×10-7mol/L Cd2+的测定无干扰,50倍的Cr3+、Mg2+、Ni2+;20倍的Sn2+、Pb2+、Zn2+。实验结果表明该修饰电极具有较好的选择性,可用于废液中Cd2+的测定。

图3 Cd2+溶出峰电流随沉积时间(A)与沉积电位(B)变化关系Fig.3 Variation in anodic stripping peak of Cd at the PM/GC electrode with different(A)deposited time;(B)deposited potential
2.5 工作曲线
如图4所示,在0.02 mol/L的H2SO4和5.0×10-5mol/L的硝酸铋溶液中,镉离子在该修饰电极上的溶出峰电流与其浓度在1.0×10-7~1.0×10-6mol/L的范围内有良好的线性关系,工作曲线回归方程为:ipa(A)=-0.430 8+17.515 7 c(μmol/L),相关系数r=0.990 4,检出限为:5.0×10-8mol/L。

图4 不同浓度镉离子在修饰电极上的DPV曲线及其校准曲线图Fig.4 Strpping curves of PM/GC electrode in 0.02 mol/L H2SO4and 5×10-5mol/L Bi3+containing Cd2+with different concentrations(cCd2+/(μmol/L)):(a)0.1;(b)0.2;(c)0.4;(d)0.6;(e)0.8;(f)1.0)
2.6 电极的稳定性
新制备的三聚氰胺修饰电极置于0.02 mol/L的H2SO4的空白溶液中,连续循环扫描20周,峰电流基本不变;对6.0×10-6mol/L Cd2+平行测定10次,镉离子溶出峰的响应电流无明显变化,相对标准偏差为2.7%,说明修饰电极有良好的重现性和稳定性。
2.7 样品分析
取2 mL水样于比色管中,加0.2 mol/L H2SO4溶液1 mL和1.0×10-4mol/L的硝酸铋溶液0.5 mL,加入一定量硫酸镉标准溶液,用双蒸水稀至10 mL体积,按前述分析方法进行溶出伏安测定。计算回收率,结果见表1。

表1 水样中镉离子的加标回收测定结果(n=5)Tab.1 Determination of Cd2+in water samples with PM/GC electrode
3 结论
三聚氰胺修饰电极能在大量金属离子共存条件下对镉离子进行选择性的检测。该方法灵敏度高,电极制备简单,稳定性和重现性好,有一定的应用前景。
[1]陈志良,莫大伦,仇荣亮.镉污染对生物有机体的危害及防治对策[J].环境保护科学,2001,27(4):37~39.
[2]陈世忠,陆登波.悬浮体制样石墨炉原子吸收光谱法直接测定琥珀中微量镉[J].光谱学和光谱分析,2006,26(10):1 928~1 930.
[3]陈明丽,邹爱美,王建华.氢化物发生原子荧光法测定纯铜中镉[J].分析化学,2007,7(9):1 339~1 342.
[4]Wang J,Lu J,H ocevar S B.Bismuth-coated carbon electrodes for anodic stripping voltammetry[J].Anal Chem,2000,72(14):3 218~3 222.
[5]公维磊,杜晓燕,王舒然,等.预镀铋膜修饰铂电极差分脉冲溶出伏安法测定痕量铅和镉[J].分析化学,2008,6(2):177~181.
[6]Wang J,Lu J,Kirgoz A,et al.Bismuth as an electrodemate rial in the simultaneous determination of Pb(Ⅱ)and Cd(Ⅱ)in poplar(populus)leaves by SWASV[J].Anal Chim Acta,2001,434(1):29~34.
[7]Wang J,Hocevar S B,Deo R P,et al.Carbon-fiber microsensor for in vivo monitoring of trace zinc(Ⅱ)based on electrochemical stripping analysis[J].Electrochem Commun,2001,3(7):352~356.

