西妥昔单抗联合FOLFOX4与单用FOLFOX4方案治疗晚期结肠癌临床疗效观察
魏阳 周行 谢华 王理扬 刘超 赵新 姚文秀
结肠癌晚期预后较差,是死亡率较高的恶性肿瘤,FOLFOX4化疗方案是治疗晚期结肠癌的标准方案之一,但由于肿瘤耐药性及化疗相关的严重不良反应存在,常导致患者治疗失败[1]。西妥昔单抗是人鼠嵌合性IgG1型单克隆抗体,作用靶点为表皮生长因子受体(EGFR),研究表明其能有效抑制EGFR高表达,从而抑制肿瘤进展[2]。选择我院2005年6月~2009年9月收治的26例晚期结肠癌患者作为治疗组,采用西妥昔单抗联合FOLFOX4化疗方案进行化疗,同时选择另外26例晚期结肠癌患者作为对照组,给予单用FOLFOX4化疗方案化疗,并对两组患者的临床疗效及不良反应进行了统计学分析,现将结果报道如下。
1 临床资料与方法
1.1 一般资料 入组患者为2005年6月~2009年9月我院收治的晚期结肠癌患者52例,均经病理组织学检查确诊。其中男31例,女21例。患者年龄34~76岁,平均年龄58岁。病理分类为高分化腺癌19例,中分化腺癌27例,低分化腺癌4例,粘液腺癌2例。患者都有CT可评估客观疗效的肿瘤病灶。患者血、尿常规、肝肾功能、心电图正常,无重要器官功能严重损害,无化疗禁忌症。KPS评分≥60,患者预计生存期≥3个月。
1.2 方法 采用非随机对照研究,将全部患者分成治疗组和对照组,两组患者在一般情况、病史资料上差异均无显著性,患者总化疗周期数相似。所有患者均签署知情同意书,随机分为治疗组和对照组,每组各26例。治疗组:西妥昔单抗先于化疗药物前使用,两者相隔1h以上。在西妥昔单抗给药前30min,常规给予西米替丁0.4g静滴、苯海拉明20mg肌注、地塞米松5~10mg静推。首次静滴西妥昔单抗400mg/m2,持续静脉滴注120min,以后每周250mg/m2,持续静脉滴注60min,妥昔单抗使用6~12次,平均使用8次。联合奥沙利铂85mg/m2,静滴,2h,d1;CF200mg/m2,静脉泵入,2h,d1、d2;5-FU400mg/m2,静脉推注,d1、d2;5-FU600mg/m2,静脉泵入,22h,d1,d2。14天为一个周期。化疗期间每天上、下午各静脉推注恩丹西酮8mg/次。对照组:采用FOLFOX4方案化疗。L-OHP85mg/m2,静脉注射,2h,d1;CF200mg/m2,2h,d1,d2;5-FU400mg/m2,静脉推注d1、d2;5-FU600mg/m2,静脉泵入,22h,d1,d2。14天为一个周期。化疗期间每天上、下午各静脉推注恩丹西酮8mg/次。
1.3 疗效评价及毒副反应 每位入组患者至少完成4个周期化疗,如患者4个周期内病情进展明显,并证实为PD者停止治疗。接受治疗后,每周行血常规检查,每周期行心电图、肝肾功能检察,每4周期行胸片、腹部B超、盆腔B超等常规检查,必要时行CT、MRI及全身骨扫描。复查入组患者肿瘤变化,再进行疗效判定。患者总化疗周期不超过12个,平均9.6个化疗周期。
疗效评价标准:按RECIST制定的抗肿瘤药物近期客观疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)以及进展(PD)。总有效率(RR)为CR+PR的例数占所有病例的百分比。
毒副反应:按照WHO颁布的评定标准进行评价,分为0~Ⅳ度。神经毒性按Levis专用感觉神经毒性分级标准判定,分成四级。密切观察患者体温、血压、心率及胃肠道反应等,复查患者血常规及肝、肾功能指标。重点观察记录化疗过程中常见的骨髓抑制、白细胞减少、血小板减少、皮疹、过敏反应、腹泻、恶心呕吐、神经毒性等毒副反应。
1.4 统计分析 采用SPSS12.0统计软件包分析处理。数据值用均数±标准差()表示,有效率及毒副反应比较均用x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组方案的近期临床疗效分析 入组患者均完成4个以上化疗周期,均可评价其近期临床疗效。两组方案治疗晚期结肠癌的临床有效率(CR+PR)分别为53.8%(14/26)和38.5%(10/26),其中西妥西单抗联合FOLFOX4化疗方案治疗晚期结肠癌患者,临床疗效明显优于单用FOLFOX4化疗方案。两组差异有统计学意义(P<0.05),见表1。
2.2 毒副反应 不良反应按WHO抗癌药物毒性反应分度标准分为Ⅰ~Ⅳ度,神经毒性按Levis分级标准判定。患者出现的主要毒副反应有骨髓抑制(白细胞减少、血小板下降)以及皮疹、过敏反应、腹泻、恶心呕吐、肝肾功能损害、神经毒性等。患者出现的毒副反应大多比较轻微,以Ⅰ~Ⅱ度为主,Ⅲ~Ⅳ度少见。其中消化道反应以恶心呕吐较多,主要为I~II度,差异无统计学意义;两组患者在心肌毒性及肝损害方面,均比较轻微;差异无显著性意义;两组患者出现外周感觉神经毒性比例均较高(76.9%,73.1%),但程度较轻,均为Ⅰ~Ⅱ度且恢复较快;两组患者出现骨髓抑制程度较轻,差异无统计学意义。治疗组患者出现较大范围的痤疮样皮疹(86.2%),是应用西妥昔单抗治疗的典型毒副反应,通常发生在用药后的前3周,多见于颜面部,少数可见于胸背部、颈部及四肢,治疗组皮疹发病率明显高于对照组,差异极显著,但出现3、4级严重皮疹患者较少,经对症治疗后未影响临床用药。毒副反应统计分析结果见表2。

表1 两组患者近期临床疗效比较(n,%)
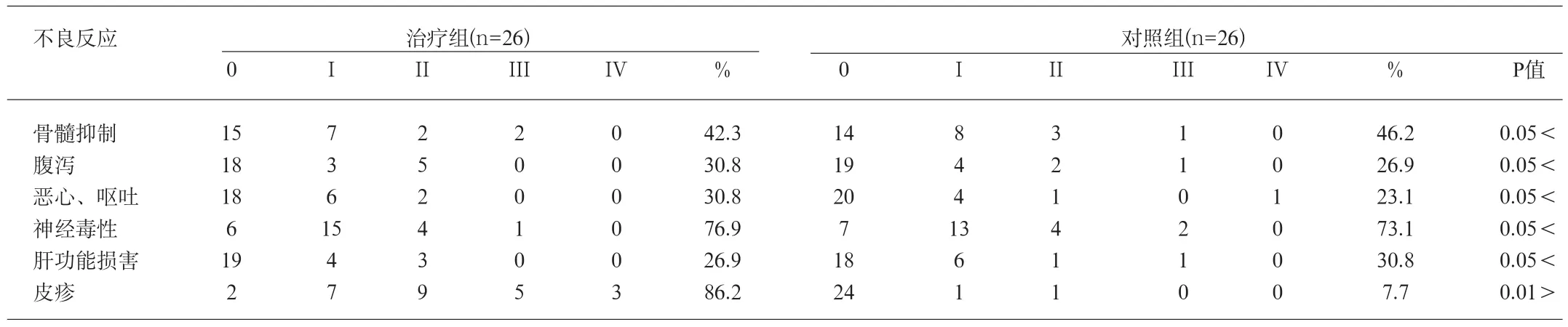
表2 治疗组与对照组临床毒副反应分析(n,%)
3 讨论
结肠癌晚期患者临床治疗的主要措施为化疗,常用的化疗药物包括3大类,即5-FU及其衍生物、第三代铂类及拓扑异构酶Ⅰ抑制剂等[3]。但患者个体差异及严重的毒副反应,在一定程度上限制了化疗药物的临床应用,甚至导致化疗失败。随着肿瘤分子靶向治疗研究的日益深入,靶向治疗药物毒性低、靶向性好、效能高等优势得以展现,在改善晚期患者的生活质量及控制肿瘤进展方面显示出广阔前景[4-5]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是人表皮受体(HER)家族重要成员。EGFR在上皮来源的恶性肿瘤例如头颈部肿瘤、结直肠癌中高度表达,并且与肿瘤细胞侵袭、转移以及肿瘤血管生成等恶性表现密切相关[6]。国内外研究发现,EGFR高表达的患者预后较差,因此阻断EGFR参与的信号传导,对抑制肿瘤细胞新生血管的形成,控制其侵袭及转移有重要意义,也是肿瘤临床治疗的一个理想靶点[7]。西妥昔单抗(Cetuximab,C225)可以特异性阻断EGFR的IgG1单克隆抗体,它可竞争性抑制内源性配体与EGFR的结合,阻断EGFR激活,从而抑制EGFR依赖性肿瘤细胞增殖、转移、侵袭以及血管生成[8-9]。基础研究表明,西妥昔单抗对结直肠癌细胞株具有明显的抑制作用,可有效抑制肿瘤细胞生长[10]。临床研究也发现西妥昔单抗可增强顺铂、泰素、阿霉素、伊利替康及紫杉类抗肿瘤药物的抗肿瘤作用,并可恢复耐药细胞对抗肿瘤药物的敏感性,同时可增强肿瘤的放疗作用[11]。
本研究采用非随机对照研究,共入组经组织病理学证实的结肠癌患者52例,其中26例患者入选治疗组,采用西妥昔单抗联合FOLFOX4化疗方案化疗,另外26例患者为对照组,单用FOLFOX4化疗方案进行化疗,观察比较两组患者接受治疗后的近期疗效和不良反应,并对研究结果进行了统计分析。我们发现,在临床治疗有效率方面,本研究入选的晚期结肠癌患者均未做EGFR表达检测,因此治疗有效率比有文献报道的EGFR阳性表达结肠癌患者有效率低[12]。本研究中西妥西单抗联合FOLFOX4化疗方案一线治疗晚期结肠癌,近期疗效明显优于单用FOLFOX4化疗方案,治疗组与对照组的临床有效率(CR+PR)分别为53.8%(14/26)和38.5%(10/26),两组差异有统计学意义(P<0.05)。在毒副反应方面,研究表明,痤疮样皮疹是应用西妥昔单抗治疗后特征性表现,皮疹的严重程度与治疗的有效率以及患者生存时间呈正相关[13]。这种痤疮样皮疹最常见于患者面部、上胸部及后背,其临床表现为多发滤泡或脓疱样皮肤损害,西妥昔单抗对该类患者的抗癌有效率较强。我们研究发现,在用药后的前3周,治疗组患者出现较大范围的痤疮样皮疹(86.2%),治疗组皮疹发病率明显高于对照组,差异极显著,但患者3、4级严重皮疹发病率较低,经对症治疗后未影响临床用药。其它主要毒副反应有骨髓抑制、腹泻、恶心呕吐、肝功能损害以及神经毒性等,大多比较轻微,两组患者都以Ⅰ~Ⅱ度为主,Ⅲ~Ⅳ度较少见。其中消化道反应以恶心呕吐较多,主要为I~II度,两组差异无统计学意义;在心肌毒性及肝损害方面,两组均比较轻微,差异无显著性意义;两组患者出现外周感觉神经毒性比例均较高(76.9%、73.1%),但程度较轻,均为Ⅰ~Ⅱ度且恢复较快;两组出现白细胞减少及血小板下降患者不多,差异无统计学意义。本研究表明, 西妥西单抗联合FOLFOX4化疗方案治疗结肠癌晚期患者,临床疗效明显优于单用FOLFOX4化疗方案,患者临床疗效较高,生活质量也有较大改善,毒副反应可以耐受。
西妥昔单抗是肿瘤分子靶向治疗的最新研究成果之一,其对头颈部肿瘤、结、直肠癌患者的个体化治疗意义重大。本研究与国内外临床研究结果相近,再次证实了一线使用昔妥西单抗联合化疗可提高治疗有效率,延缓生命,疗效安全,在结肠癌的临床治疗中值得推广。
[1]Camp E R,Summy J,Bauer T W,et al.Molecular Mechanisms of Resistance to Therapies Targeting the Epidermal Growth Factor Receptor[J].Clin Cancer Res,2005,11(1):397-405.
[2]Ng M,Cunningham D.Cetuximab(Erbitux)-an emerging targeted therapy for epidermal growth factor receptor-expressing tumours[J].IntJ Clin Pract,2004,58(10):970-976.
[3]Bokemeyer C,Bondarenko I,Makhson A,et al.Cetuximab plus 5-FU/FA/oxaliplatin (FOLFOX4) versus FOLFOX4 in the first-line treatment of metastatic colorectal cancer (mCRC):OPUS,a randomized phase Ⅱ study[J].J Clin Oncol,2007,25(18Suppl):4035-4052.
[4]Tabernero J,Van Cutaem E,Diaz Rubio E,et al.Phase Ⅱ trial of cetuximab in combination with fluorouracil,leucovorin,and oxalip latin in the first-line treatment of metastatic colorectal cancer[J].J Clin Oncol,2007,25(33):5225-5232.
[5]Vincenzi B,Santini D,Tonini G.New issues on cetuximab mechanism of action in epidermal growth factor receptor-negative colorectal cancer:the role of vascular endothelial growth factor[J].J Clin Oncol,2006,24(12):1957-1958.
[6]Cunningham D,Humblet Y,Siena S,et al.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan refractory metastatic colorectal cancer[J].N Engl J Med,2004,351(4):337-345.
[7]Tsuchihashi Z,Hanna N,Janne P A.Responsiveness to cetuximab without mutations in EGFR[J].N Engl J Med,2005,353(2):208-209.
[8]Skvortsov S,Sarg B,Loeffler-Ragg J,et al.Different proteome pattern of epidermal growth factor receptor-positive colorectal cancer cell lines that are responsive and nonresponsive to Cetuximab antibody treatment[J].Mol Cancer Ther,2004,3(12):1551-1558.
[9]Folprecht G,Lutz M P,Schiffski P,et al.Cetuximab and irinotecan/5-fluorouracil/folinic acid is a safe combination for the firstline treatment of patients with epidermal growth factor receptor expressing metastatic colorectal carcinoma[J].Ann Oncol,2006,17(3):450-456.
[10]Saltz L B,Kies J,Abbruzzese N,et al.The presence and intensity of the cetuximab-induced acne-like rash predicts survival in studies across multiple malignancies[J].Proc Am Soc Clin Oncol,2003,22:204.
[11]Tabernero J,Pfeiffer P,Cervantes A.Administ ration of cetuximab every weeks in the treatment of metastatic colorectal cancer:an effective,more conveient alternative to weekly administ ration[J].Oncologist,2008,13(2):113-119.
[12]Vincenzi B,Santini D,Russo A,et al.Angiogenesis modifications related with cetuximab plus irinotecan as anticancer treatment in advanced colorectal cancer patients[J].Ann Oncol,2006,17(5):835-841.
[13]Aurelien R,Valerie B,Gerard M,et al.KRAS mutation signature in colorectal tumors significantly overlaps with the cetuximab response signature[J].J Clin Onco1,2008,26(13):2228-2230.