白术和黄芪种子试管内萌发试验研究
洪森荣,尹明华,叶利民,李 玲
(上饶师范学院生命科学学院,江西 上饶 334001)
白术(AtractylodesmacrocephalaKoidz.)系菊科植物,其干燥根茎具有健脾益气、燥湿利水、止汗安胎之效,主治脾虚食少、腹胀、水肿、胎动不安等症[1]。栽培中常用种子或块根繁殖,但都难以在短期内大面积种植[2],黄芪(Astragalusmembranaceus(Fisch.)Bge.)属于豆科黄芪属的多年生草本植物[3]。黄芪具有增强机体免疫力功能、强心降压、降血糖、利尿、抗病毒等作用,国内外市场对其需要量越来越大[4]。目前对于黄芪的研究主要集中于其多糖、黄酮等有效成分的提取及其应用价值的研究,对黄芪组织培养的研究报道较少[4-7]。初步研究了白术和黄芪种子的试管内萌发,以期为白术和黄芪无菌体系建立、快速繁殖以及白术和黄芪的产业化生产提供理论依据。
1 材料与方法
1.1 试验材料
白术种子和黄芪种子购于浙江省景宁县梧桐乡药材专业合作社,原产地为安徽亳州。
1.2 试验方法
1.2.1 不同消毒方式对白术种子萌发的影响 配置1/2 MS培养基(大量元素减半,其他基本成分不变),加入30 g/L蔗糖和7.5 g/L琼脂,pH值调为5.8~6.0。用聚乙烯封口膜封好,贴上标签。放入高压灭菌锅内灭菌(温度:120℃,时间:20min)。灭菌冷却后备用。挑选成熟饱满的白术种子,分成3组,放入超净工作台内依次进行消毒,消毒方式设置如下:(1)用75%酒精消毒30 s,无菌水浸洗1次;再用0.1%HgCl2消毒1min,无菌水浸洗1次。(2)用75%酒精消毒30 s,无菌水浸洗1次;再用0.1%HgCl2消毒5 min,无菌水浸洗1次。(3)用75%酒精消毒30 s,无菌水浸洗1次;再用0.1%HgCl2消毒10 min,无菌水浸洗1次。材料消毒以后,接种在1/2 MS培养基上,放入光照培养箱中培养,培养条件为:光照时间12 h/d,光照强度1 200~1 400 lx,温度(25±1)℃,湿度60%~80%。每天观察种子萌发情况并记录种子萌芽、生根、出苗的时间以及种子污染情况,45 d时统计白术种子的萌发率、污染率。萌发率=(出芽的种子粒数/总接种数)×100%,污染率=(污染粒数/总接种粒数)×100%。
1.2.2 培养基无机盐水平对白术种子萌发的影响挑选成熟饱满的白术种子,放入超净工作台内进行消毒,种子消毒方法用75%酒精消毒30 s,无菌水浸洗1次;再用0.1%HgCl2消毒5 min,无菌水浸洗1次。材料消毒以后接种在不同无机盐水平的培养基上,培养基设置如下:(1)MS;(2)1/2MS;(3)1/4 MS。培养基中加入蔗糖30 g/L、琼脂7.5 g/L,pH调节为5.8~6.0,用封口膜封口,高压灭菌锅中灭菌。每个瓶中接入5~6粒种子不等。接种后放入光照培养箱中培养。每天观察种子萌发、生根情况,45 d时统计萌发率。
1.2.3 不同消毒方式和培养基类型对黄芪种子试管内萌发的影响 配置固体和半固体培养基,固体培养基中加入琼脂7.5 g/L,半固体培养基加入琼脂3.5 g/L。封口膜封口并灭菌。挑选饱满黄芪种子放入工作台内消毒,消毒方式设置如下:(1)用75%酒精消毒20 s,无菌水浸洗1次;再用0.1%HgCl2消毒5~8min,无菌水浸洗1次。种子消毒后接入固体和半固体培养基中;(2)用75%酒精消毒20 s,无菌水浸洗1次;再用0.1%HgCl2消毒10~15 min,无菌水浸洗1次。种子消毒后接入固体和半固体培养基中。每支试管接入3~10粒黄芪种子不等,接种后放入光照培养箱中培养。每天观察黄芪种子发芽情况。15 d时统计其萌发率。
1.3 数据处理
试验为单因子试验,数据均取平均值。
2 结果与分析
2.1 消毒方式对白术种子萌发的影响
种子接入培养基4 d后,就出现种子污染情况,用75%酒精消毒30 s再用0.1%HgCl2消毒1 min的种子最先出现污染,长出白色绒毛状菌体,圆形菌落,菌落随时间不断扩大,最后布满整瓶,菌体由白色变为墨绿色,最后变成黑色。接入的种子有轻微的褪色,种子在逐渐胀大,但30 d后,无一粒种子萌发,45 d时开始有种子发芽并生根。由表1可知用0.1%HgCl2消毒时间越短,白术污染率越高,但种子消毒时间过长或过短对白术种子的萌发都不利。因此,白术种子最佳的消毒方式是:75%酒精消毒30 s再用0.1%HgCl2消毒5min。
2.2 无机盐水平对白术种子萌发的影响

表1 消毒方式对白术种子萌发和污染的影响(45 d)
白术种子接到不同无机盐水平培养基上,有轻微的褪色,种子也有一定胀大,但一直没有萌发迹象,到45 d时开始出现种子萌发。无机盐浓度过低对白术种子萌发不利。无机盐水平为1/4MS时,种子萌发率为0;无机盐水平为MS和1/2 MS时,白术种子萌发率相对较高,分别为3.5%和3.7%,总体上白术种子在试管内的萌发率较低。
2.3 消毒方式和培养基类型对黄芪种子试管内萌发的影响
黄芪种子培养2 d后,用0.1%HgCl2消毒5 min的种子接到半固体培养基上的最先有种子发芽,4 d后,其他种子也有发芽,萌发情况统计如表2所示,从表2中可知,半固体培养基中种子萌发率高于固体培养基,用0.1%HgCl2消毒10~15min对黄芪种子适合。
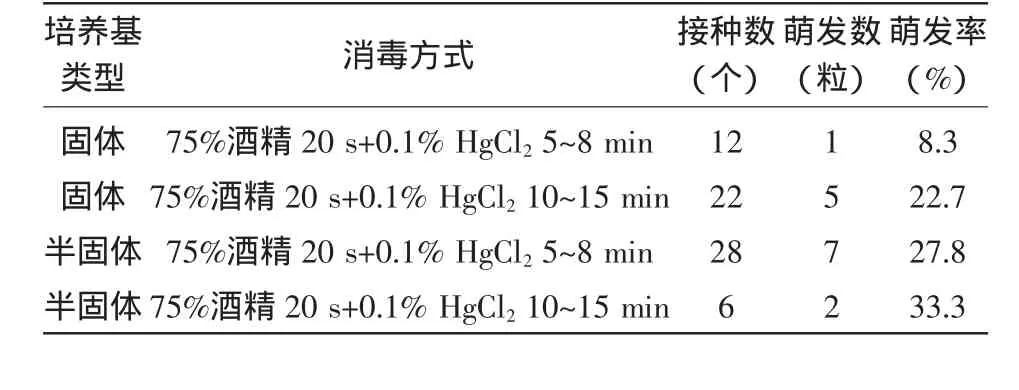
表2 消毒方式和培养基类型对黄芪种子试管内萌发的影响(15 d)
3 讨论
本试验对于白术萌发的初步研究表明,用0.1%HgCl2对白术消毒5min的消毒效果最好,污染率较低。但1/2 MS培养基上的种子萌发率仅为3.7%。因此,在本试验中,白术种子总的萌发率较低,究其原因可能有以下几点:首先是因为白术种子外表皮有一层茸毛,如果消毒液没有完全浸透种子,茸毛中的细菌无法杀死,种子易污染,从而影响种子萌发。其次是因为种子体型较大,种子萌发需要吸收一定量的水分通过吸胀阶段才能萌发,本试验采用固体培养基水分不足,导致实验后期培养基干裂,种子无法吸水导致萌发率低。另外可能是因为本试验所购买的白术种子本身活力低,萌发率不高。但李慧[2]把白术种子在流水中冲4~6 h,剥去种皮,用0.2%HgCl2浸泡20 min后白术种子萌发率很高。本试验也表明,培养基中添加琼脂量的多少对黄芪种子的萌发有影响,加入琼脂量少的半固体培养基,黄芪种子萌发率高,而添加琼脂量多的固体培养基,培养基易硬化,影响了养分和水分的吸收,导致黄芪种子萌发率低。因此,采取半固体培养基对于黄芪种子萌发有利。本试验结果可以为白术和黄芪试管苗无菌体系的建立提供理论依据。
[1] 彭晓波.白术的炮制与应用 [J].中国现代药物应用,2009,3(21):115-116.
[2] 李 慧.白术的组织培养[J].特种经济动植物,2002,(7):23-24.
[3] 伍春莲.黄芪愈伤组织的培养及蛋白质含量的测定[J].西华师范大学学报,2009,30(2):138-139.
[4] 暴宪斌,沈俊兰.黄芪的药理作用及临床研究进展[J].山西中医,2006,22(6):48-49.
[5] 陈兰兰,高山林,赵慧娜.蒙古黄芪组织培养及同源四倍体的诱导与鉴定[J].药物生物技术,2006,13(6):413-417.
[6] 攀锐锋,梁 冰,李海燕.黄芪属植物生物学特性及组织培养技术研究进展[J].东北农业大学学报,2006,(2):32-35.
[7] 包英华,苏格尔.蒙古黄芪不同外植体愈伤组织中黄芪甲甙含量比较[J].蒙古大学学报,2003,(4):78-80.
[8] 王 忠.植物生理学 [M].北京:中国农业出版社.2002.212-213.

