朱鹮新城疫病毒陕西分离株F基因的克隆与序列分析*
郑亚红,张 鹏,杨增岐*,韩青松,张淑霞,党如意
(1.西北农林科技大学动物医学院,陕西杨陵712100;2.尉氏职业中等专业学校,河南尉氏475500)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的禽类的一种高度接触性、致死性的病毒性传染病[1]。世界动物卫生组织(OIE)将其列为必须报告的动物传染病[2],在我国被列为一类动物疫病。NDV的宿主范围非常广泛,野生鸟类被认为是NDV的重要储存宿主[1]。目前,除家禽外,至少236种鸟可自然或实验性感染NDV,它们作为病毒携带者在NDV的传播中发挥作用[3]。近年来,许多特禽、珍禽因感染NDV而发病、死亡的报道不断出现,如鸽、鹤鹑、鹤鸽、鸵鸟等。2001年范光丽等[4],2003年曲红利等[5],2006年贾文孝等[6]先后对朱鹮新城疫进行了报道。朱鹮是当今世界濒危的鸟类之一,目前,尽快控制新城疫对朱鹮种群的危害是当前朱鹮保护工作的一项紧迫任务。
NDV是禽副黏病毒科、禽病毒属的成员,基因组是一个单链、负股的RNA,从5′到3′的基因顺序为L基因、HN基因、F基因、M基因、P基因、NP基因[7]。F基因编码的F蛋白不仅能促进病毒囊膜与宿主细胞膜融合,而且能促进相邻宿主细胞之间发生融合。不同毒株F基因的序列有差别,这些差别主要集中在F蛋白的裂解位点区(112~117),强毒株在这一区域的序列是112R/K-R-Q-R/K-R-F117,而弱毒株的相应序列是112G-R/K-Q-G/S-L117[8]。为了解朱鹮NDV的分子生物学特性及致病性,本研究对一株朱鹮源NDV陕西省分离株的F基因重要功能片段进行了RT-PCR扩增,测定了其氨基酸序列,与GenBank登录的NDV代表毒株F基因相应片段进行了同源性比较,并构建了遗传进化树,以期为朱鹮新城疫的分子流行病学调查和防控提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 病毒 朱鹮新城疫病毒陕西分离株由西北农林科技大学禽病研究室2006年分离保存。
1.1.2 主要试剂 NDV阳性血清、AIV阳性血清(H5、H9)等均由西北农林科技大学禽病研究室提供;非免疫鸡胚购自杨凌绿方生物工程公司;Trizol试剂盒购自美国Invitrogen公司;RNA酶抑制剂、Taq DNA聚合酶、dNTPs、DNA Marker、pMD18-T克隆载体试剂盒购自宝生物工程(大连)有限公司;DH5α感受态细胞由西北农林科技大学禽病研究室制备;其他试剂均为国产分析纯化学试剂。
1.2 方法
1.2.1 病毒的增殖 将病毒接种于9日龄~11日龄非免疫鸡胚,以尿囊腔接种,每胚0.2 mL,弃24 h内死胚,收集24 h~96 h后死亡鸡胚的尿囊液,按参考文献[9]进行血凝试验(HA)和血凝抑制试验(HI),其血凝价在25以上的,加双抗,后在—20℃保存备用。
1.2.2 HA与HI试验 用NDV和禽流感病毒(AIV)H5、H9标准阳性血清按文献[9]标准操作。
1.2.3 引物设计 根据GenBank登录的F48E9标准毒株(AY508514)NDV F基因核苷酸序列,用primer5.0设计了一对特异性引物,F1:5′-ATGGGCTCCAGA(T/C)CT TCTAC-3′,F2:5-CTGCCACTGCTAGTTGTGATAATCC-3′,由上海生工生物工程技术服务有限公司合成,预期扩增片段长度为535 bp。
1.2.4 RNA的提取 根据T rizol试剂盒说明书操作,提取病毒RNA。
1.2.5 RT-PCR反应
1.2.5.1 反转录 根据MBI公司Fermentas反转录试剂盒说明书操作,合成cDNA。
1.2.5.2 PCR扩增 取上述cDNA 2 μ L,分别加入ExTaq 10×缓冲液2.5 μ L,dNTPS 2.0 μ L(2.5 mmol/μ L),上游引物F1(20 pmol/L)1 μ L,下游引物F2(20 pmol/L)1 μ L,Ex TaqDNA聚合酶0.5 μ L(5 U/μ L),补灭菌超纯水至25 μ L,充分混匀并瞬时离心,进行PCR反应。PCR程序如下:94℃变性5 min;94℃变性1 min 90 s,55℃1 min,72℃1 min 40 s,30个循环;72℃延伸10 min。反应结束后取PCR产物5 μ L,于15 g/L琼脂糖凝胶电泳,观察所扩增片段的大小,并拍照。
1.2.5.3 RT-PCR产物的纯化回收 将RT-PCR产物在15 g/L琼脂糖凝胶中电泳,切下目的条带,按北京鼎国生物技术有限责任公司的DNA快速纯化/回收试剂盒说明书回收目的片段,置—20℃保存备用。
1.2.6 目的基因的克隆与鉴定
1.2.6.1 目的基因的克隆 将纯化回收的PCR产物与pMD18-T载体连接,连接产物转化DH5α大肠埃希菌。在含氨苄青霉素的选择培养基上37℃培养过夜后,挑取单菌落在含氨苄青霉素选择培养液中扩大培养10 h。
1.2.6.2 重组菌液PCR和双酶切 以1.2.6.1所得的菌液为模板,用PCR方法进行阳性克隆鉴定。筛选阳性克隆抽提质粒,用EcoRⅠ和HindⅢ进行酶切鉴定。将鉴定为阳性的克隆送北京奥科测序公司进行序列测定。
1.2.7 序列分析 将测序结果在NCBI网站上进行在线比对;从GenBank下载具有代表性序列,利用DNA Star软件对NDV/Crested ibis/ShX/China/2006分离株的F基因片段与GenBank中登录的多株NDV相应基因片段进行核苷酸及氨基酸序列同源性比较,绘制系统发育进化树。
2 结果
2.1 病毒的增殖与鉴定
所收集尿囊液的HA为阳性,血凝价为28。在HI试验中,NDV标准阳性血清的HI为阳性,AIV(H5和H9)标准阳性血清的HI均为阴性,表明病毒增殖成功,将其命名为NDV/Crested ibis/SHX/China/2006(简称Crested ibis)。
2.2 F基因的RT-PCR扩增
经RT-PCR扩增,获得1条535 bp的特异性扩增条带,与预期扩增的目的片段大小相符(图1)。
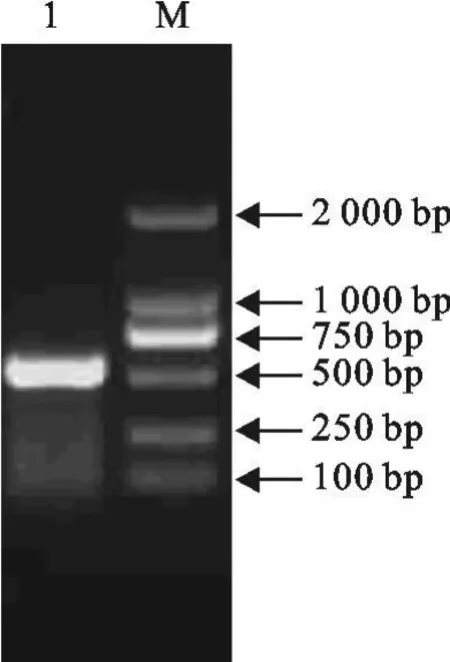
图1 NDV分离株F基因的RT-PCR扩增结果Fig.1 The results of amplification of NDV F gene by RT-PCR
2.3 F基因的克隆及鉴定
以菌液为模板,用RT-PCR方法进行阳性克隆鉴定,得到约535 bp的特异性片段,与预期结果相符(图2)。重组质粒用EcoRⅠ和HindⅢ进行双酶切,切出535 bp的特异性片段,与预期扩增片段大小相符(图3)。

图2 重组质粒菌液PCR鉴定结果Fig.2 The results of identifying the positive plasmid by bacterium PCR
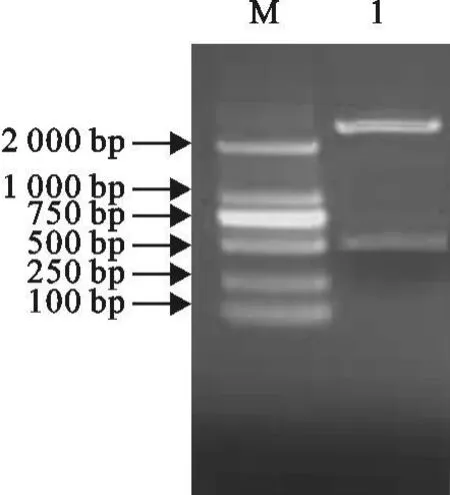
图3 重组质粒限制性酶切鉴定结果 Fig.3 The results of identification of recombinant plasmid by restriction endonuclease digestion
2.4 F基因部分片段核苷酸及推导的氨基酸序列同源性分析
重组质粒的测序结果表明,分离株F基因片段的长度为535 bp,与预期扩增片段长度相符。应用DNA Star软件推导其氨基酸序列,将SHXLG毒株的F基因的核苷酸序列与GenBank中登录的新城疫代表毒株进行同源性比较,F基因核苷酸序列同源性在84.0%~98.7%之间(图4);氨基酸同源性在83.8%~96.6%之间(图5);其中与JS-5-01-Go(登录号:AF456442)株核苷酸和氨基酸的同源性较高,分别为98.7%~96.6%。
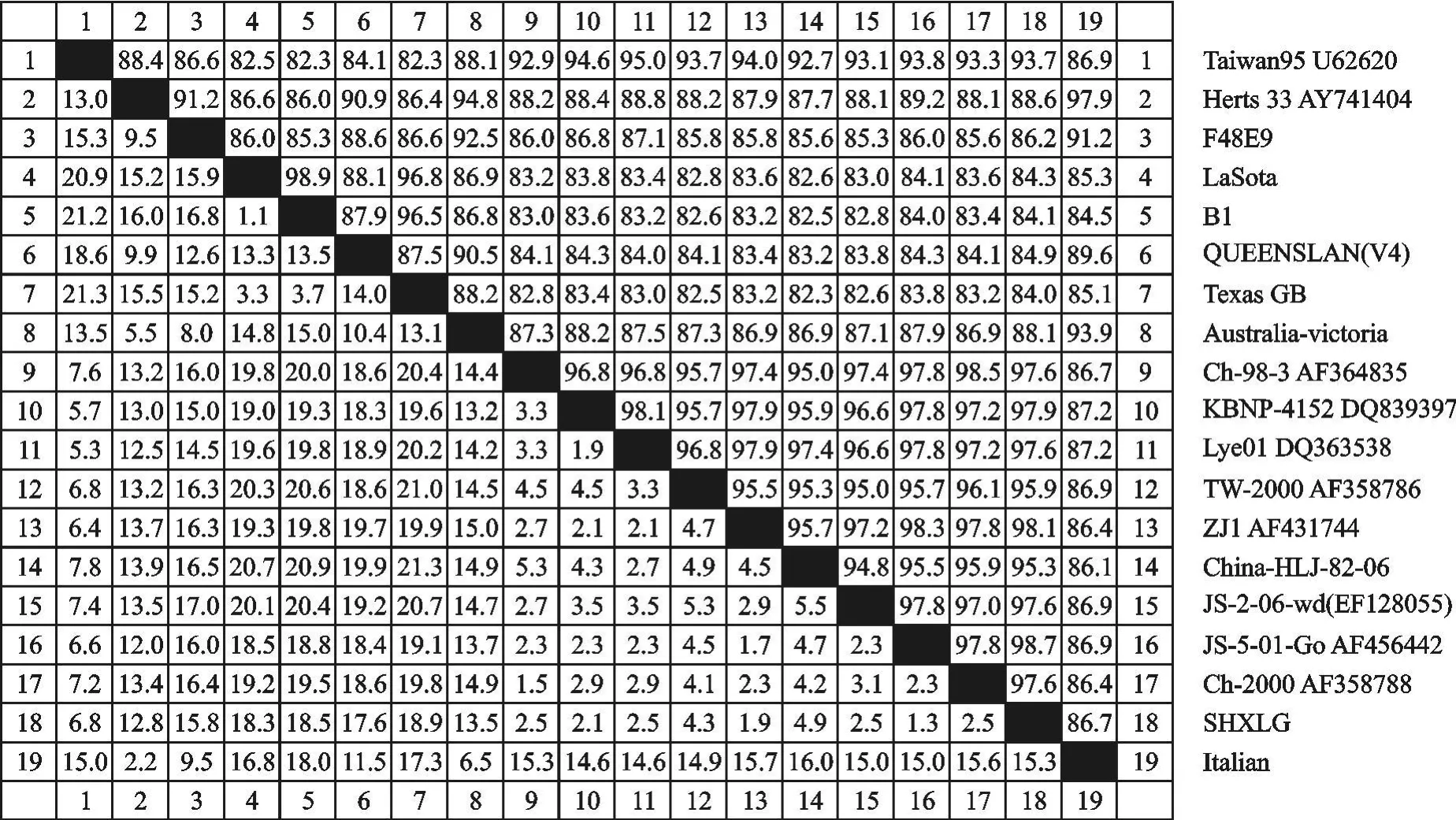
图4 朱鹮NDV分离株和参考毒株F基因核苷酸序列的同源性Fig.4 Homology of the nucleotide sequence of F gene of NDV/Crested ibis/ShX/China/2006 and reference strains(%)
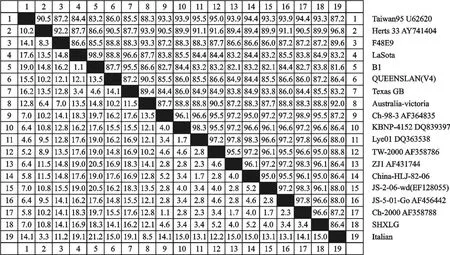
图5 朱鹮NDV分离株和参考毒株F蛋白氨基酸序列的同源性Fig.5 Homology of amino acid sequences of F protein of NDV/Crested ibis/ShX/China/2006 and reference strains(%)
对SHXLG毒株F蛋白裂解位点区(112~117)的研究,决定NDV毒力强弱与F蛋白裂解位点区112位~117位氨基酸序列组成有关[10],强毒株区的氨基酸序列为Arg-Arg-Gln-Arg/Lys-Arg-Phe;弱毒株区的氨基酸序列为Gly-Arg/Lys-Gln-Gly/Ser-Arg-Leu;NDV SHXLG株F基因在此区氨基酸序列为Arg-Arg-Gln-Lys-Arg-Phe(表1);其F蛋白的101位为K(懒氨酸)和121位为V(缬氨酸)两个特征性氨基酸,这在分子水平上证明了NDV SHXLG为NDV强毒株。
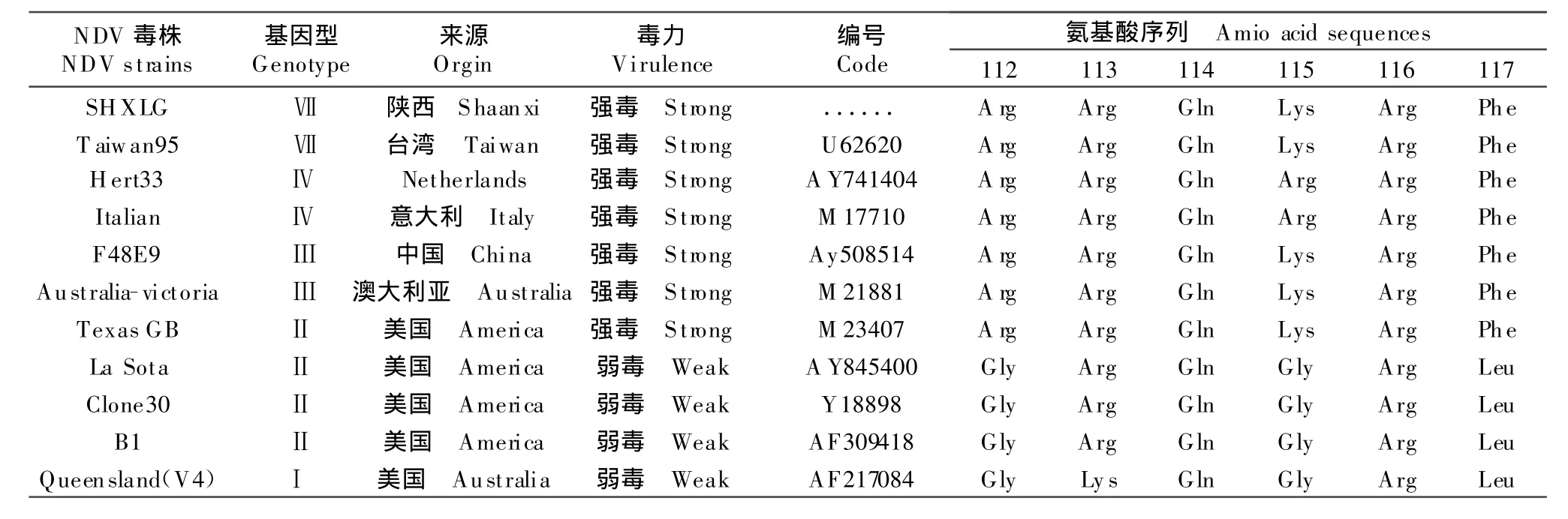
表1 本研究中应用的新城疫毒株来源及其F蛋白裂解位点(112~117)的氨基酸组成Table 1 Origin of NDV strains used in this study and the composition of the amino acid sequences of cleavage site(112-117)of F protein
2.5 F基因片段进化树的构建
应用NDA Star软件将NDV/Crested ibis/SHX/China/2006分离毒株的F基因序列与国内外已发表的NDV相应片段序列进行同源性比较,利用MegAlign软件绘制NDV的系统发育进化树。结果显示,NDV/Crested ibis/SHX/China/2006分离株与JS-5-01(登录号:AF456442)在同一系统进化上亲缘关系较近,同属于基因Ⅶ型(图6)。

图6 NDV分离株与参考毒株F基因系统进化树Fig.6 Phylogenetic tree of of F gene of NDV/Crested ibis/ShX/China/2006 and reference strains
3 讨论
本研究所用病毒接种鸡胚后,鸡胚在36 h~60 h死亡,死胚全身广泛出血,头部、颈部、肢端最严重。笔者通过对NDV陕西朱鹮分离毒株的F基因核苷酸和推导氨基酸的序列分析发现,所分离的毒株存在一定数量的无义突变,分离毒株F蛋白的裂解位点为112R-R-Q-K-R-F117,符合强毒株的分子特征,表明此次分离到的朱鹮NDV陕西分离株为强毒株。应用NDA Star软件将NDV/Crested ibis/ShX/China/2006分离毒株的F基因序列与国内外已发表的NDV相应片段序列进行同源性比较,发现此毒株与参考毒株的核苷酸、氨基酸同源性分别为84.0%~98.7%、83.8%~96.6%;其中NDV/Crested ibis/ShX/China/2006与JS-5-01(登录号AF456442)同源性较高,其核苷酸、氨基酸同源性分别为98.6%和96.6%;与疫苗株La Sota株核苷酸和氨基酸的同源性分别为84.3%和84.9%;与国内标准强毒F48E8核苷酸和氨基酸同源性为86.2%和87.2%,与其同源性较低。从各方面分析表明,分离到的朱鹮NDV陕西分离株与传统的疫苗株在基因水平上存在一定的差异。
研究表明,目前在我国部分地区流行的NDV的主导基因型是基因Ⅶ型。如中国台湾学者[11]对1984年至1998年间中国台湾分离株进行遗传进化分析,结果表明这些分离株均归于基因Ⅶ型。刘华雷等[12]分析了我国部分地区的8株NDV,结果7株属于基因Ⅶ型。曹殿军等[13]在分析国内NDV分离株时发现,30株NDV分离株中有15株(1997年—1999年分离的14株及1991年分离的1株)属于基因Ⅶ型,其余15株则分别属于另外7个基因型。吴艳涛等[14]对1997年—2001年从江苏、浙江两省发病鹅群分离的11株NDV毒株进行分析,发现10株归入基因Ⅶd型,另一株归入基因Ⅵ型。本研究中根据Lomniczim等建立的方法对NDV分离株F基因重要功能区片段进行了克隆和序列分析,将此毒株与近期国内外发表的一些有代表性的参考毒株所构建的基因进化树表明,此毒株与基因Ⅶ型NDV的代表株Taiwai95株在进化树同属一个大分支,该分离株应属于基因Ⅶ型毒株,与近年来在我国家禽中流行的NDV主要基因型相一致,此分离株与JS-5-01-GO(登录号:AF456442)有较高同源性,说明朱鹮NDV与鹅源NDV、鸡源NDV之间存在较为密切的亲缘关系。
为防止NDV对朱鹮的侵袭,建议对朱鹮生活场所周围禽类加强管理,搞好预防免疫措施,防止将疫病传染给朱鹮种群。朱鹮保护观察站要密切观察朱鹮种群的表现及发病情况,定期对朱鹮进行血清学监测,了解朱鹮体内新城疫抗体水平的动态变化,随时做好免疫预防的准备,以防患于未然。
[1] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:743-750.
[2] 世界动物卫生组织.诊断试验和疫苗标准手册[M].3版.农业部畜牧兽医局,译.北京:中国农业科技出版社,1996:113-146.
[3] 杨瑞梅.东北地区新城疫分子流行病学研究[D].甘肃兰州:甘肃农业大学,2003.
[4] 范光丽,周宏超,杨鸣琦,等.幼龄朱鹮新城疫病的病理学观察[J].西北农林科技大学学报,2001,29(6):79-82.
[5] 屈红丽,姜焕宏,朱华萍,等.朱鹮新城疫的诊治[J].中国兽医科技,2003,33(2):61-62.
[6] 贾文孝,赵合平,赵光明,等.朱鹮新城疫与大肠杆菌混合感染[J].中国兽医杂志,2007,43(3):63.
[7] Kattenbelt J A,Stevens M P,Gould A R.Sequence variation in the Newcastle disease virus genome[J].Virus Res,2006,116(1-2):168-184.
[8] Toyoda T,Sakaguchi T,Imai K,et al.Structural comparision of the cleavage activation site of the fusion[J].Virology,1987,158:242-247.
[9] 李健强,李六金.兽医微生物学实验实习指导[M].陕西西安:陕西科学技术出版社,1999:114-118.
[10] Aldous E W,Alexander D J.Detection and differentitation of Newcastle disease virus strains(avian paramyxovirous type I)[J].Avian Pathol,2001,30:117-128.
[11] Yang C Y,Shieh H K,Lin Y L,et al.Newcastle disease virus isolated from recent outbreaks in Taiwan phylogenetically related to viruses(genotypeⅦ)from recent outbreaks in Western Europe[J].Avian Diseases,1999,43:125-130.
[12] 刘华雷,王永坤,严维巍,等.中国部分地区新城疫病毒行病学研究[J].中国预防兽医学报,2001,23(1):29-32.
[13] 曹殿军,郭 鑫,梁 荣,等.我国部分地区NDV的分子流行病学研究[J].中国预防兽医学报,2001,23(1):29-32.
[14] 吴艳涛,倪雪霞,万洪全,等.我国部分地区不同动物来源新城疫病毒的分子流行病学研究[J].病毒学报,2002,18(2):264-269.

