半定量RT-PCR检测猪延髓中色氨酸羟化酶2基因表达方法的建立*
马红娜,邓衔柏*,马勇江,何 敏,习欠云,宁章勇,张桂红,卢培成,张曼玉
(1.华南农业大学兽医学院,广东广州510642;2.广东科贸职业学院,广东广州510430;3.华南农业大学动物科学学院,广东广州510642)
色氨酸羟化酶2(tryptophan hydroxylase 2,TPH-2)是色氨酸羟化酶的亚型之一,该基因优先在脑干中表达,负责合成中枢5-羟色胺(5-hydroxytryp tamine,5-HT),代表神经性TPH基因[1]。TPH-2为中枢5-H T合成的限速酶,具有专一性,在组织中含量较低,且具有不稳定性。TPH-2基因单核苷酸多态性与精神疾病有某种程度的联系,目前国内外有TPH-2基因单核苷酸多态性与抑郁症及自杀行为研究的报道[2-5],对色氨酸羟化酶的研究已经成为热点。
应激是动物在生存过程中受到各种各样刺激后产生的非特异性适应性反应。适度应激可使机体度过短期恶劣环境,适应能力得到提高,但强烈应激可影响多种生理活动和行为,长期应激会使机体神经内分泌失调,免疫力下降,引起胃肠道疾病,甚至不良精神变化。当体内受到心理、生理等刺激时可伴有脑内5-HT合成及代谢的改变。在一般研究TPH的试验中,都会有驱赶动物的可能。在猪的饲养管理过程中,常发生驱赶应激的现象。这种驱赶应激是否对延髓中的TPH-2有影响,所以本试验选择比运动性疲劳温和的驱赶应激来研究中枢TPH-2的变化。
对于TPH-2的定性和定量,较常用的是免疫印迹、免疫细胞化学和免疫沉淀方法[6]。但这些方法难以及时、快速地检测到机体内TPH-2的表达。鉴于此本试验拟采用RT-PCR技术对TPH-2进行半定量检测,建立半定量检测TPH-2的表达方法。
1 材料与方法
1.1 材料
1.1.1 试验用动物 试验所用的仔猪延髓组织采自广州市增城区某猪场。分别选出相同日龄,体重相似的仔猪20头,随机分为两组,一组为驱赶应激组,一组为直接处死组,驱赶组驱赶应激后立刻处死5头,直接处死组直接处死5头。
1.1.2 试剂和仪器 Trizol(Invitrogen),EXTaqDNA聚合酶宝生物工程(大连)有限公司,TaqDNA聚合酶宝生物工程(大连)有限公司,DL2000 Maker(TAKARA),反转录试剂盒(MBI),DEPC,溴化乙锭,琼脂糖等试剂。低温离心机,超净工作台,核酸分析仪,PCR仪,凝胶成像仪,电泳仪。
1.2 方法
1.2.1 延髓组织RNA的提取
1.2.1.1 裂解 取约0.1 g延髓组织放入研钵内,在液氮中将组织充分研磨成粉状后,倒入1.5 mL EP管中,加入1 mL T rizol溶液,充分振荡混匀。室温孵育10 min,4℃12 000 r/min离心5 min,弃沉淀。
1.2.1.2 分离 按1 mL T rizol加入200 μ L氯仿的比例加入RNA专用氯仿,剧烈振荡15 s,冰上静置2 min,4℃12 000 r/min离心15 min。
1.2.1.3 沉淀 取上清层到一个新1.5 mL EP管中,加入500 μ L RNA专用异丙醇,颠倒混匀,4℃孵育10 min,4℃12 000 r/min离心10 min。
1.2.1.4 洗涤 弃上清,向管中加入1 mL冰浴的750 mL/L乙醇洗涤沉淀,4℃7 500 r/min离心7 min,弃去上清。
1.2.1.5 溶解 RNA适度干燥后,用30 μ L无RNA酶水溶解。用10 g/L琼脂糖凝胶电泳检测其质量,核酸分析仪测量其浓度,以便在反转录的过程中进行定量。若暂时不用,可保存在—70℃中。
1.2.2 反转录 用反转录试剂盒将总RNA反转录为cDNA,cDNA可直接用于PCR扩增。
1.2.3 RT-PCR扩增反应
1.2.3.1 引物序列 应用Primer Premier5.0软件,按照引物设计的基本要求,设计β-actin和TPH-2基因扩增引物。β-actin和TPH-2基因扩增长度分别为102 bp和398 bp。所有引物均由英俊公司合成,使用前将引物稀释至10 mmol/L。
1.2.3.2 退火温度 β-actin和TPH-2基因在其引物Tm±5℃的范围内设温度梯度。两对引物的Tm不同,需分别扩增,筛选出各自最佳的退火温度。
1.2.3.3 Mg2+浓度筛选 在标准PCR反应条件下,选择不同Mg2+浓度(分别为1.25、1.50、2、2.5、2.75 mmol/L)扩增。扩增产物琼脂糖凝胶电泳,根据产量和特异性,确定最适合的Mg2+浓度。
1.2.3.4 循环数确定 选择适当的循环数,使扩增产物处在平台期前的线性增长范围内,并在琼脂糖凝胶上清晰可见和定量。所检测的目的RNA和内标β-actin最佳循环次数须在同一范围。基因TPH-2和β-actin的PCR反应体系为:2.5 μ L cDNA产物,0.5 μ L Taq酶,TPH-2基因(或β-actin基因)上下游引物各2 μ L,dNTP 4 μ L,5 μ L 10×buffer,MgCl2(25 mmol/L)待定,终体积50 μ L。反应程序如下:94℃5 min;94℃30 s,退火温度待定,30 s,72℃30 s(23、25、27、30、35个循环);72℃7 min,4℃保存。
1.2.4 凝胶电泳、凝胶成像和定量分析 PCR扩增产物50 μ L与6×Loading buffer混匀,吸取6 μ L到20 g/L琼脂糖凝胶电泳,点上DL 2 000 Marker,以确定扩增产物片段的大小。80 V电泳15 min,溴化乙锭(EB)染色,凝胶成像系统拍照,并用Gelpro凝胶分析软件分析。结果用TPH-2基因和β-actin电泳带IOD的比值表示。
1.2.5 数据分析 用SPSS10.0版统计软件处理,数据以均数±标准差表示,采用配对t检验和X2检验。检验水准为α=0.05。
2 结果
2.1 延髓组织总RNA的提取
采用Trizol法提取全部延髓组织总RNA。各取3 μ L,经10 g/L琼脂糖凝胶电泳检测其质量,延髓组织总RNA的28 S rRNA、18 S rRNA条带清晰明亮,无拖带现象,且28 S rRNA的亮度是18 S rRNA的二倍,表明提取的RNA样品较为完整,基本无降解。用核酸分析仪测定RNA的浓度,其OD260/OD280比值均在1.8~2.0,说明样品的纯度较高,定量后可用于后续的试验(图1)。

图1 总RNA提取结果Fig.1 The ex traction result of total RNA
2.2 退火温度的确定
在进行退火温度梯度试验时,将β-actin引物的温度设置在38℃~52℃,β-actin目的片段长度为102 bp,TPH-2引物的温度在40℃~50℃,目的片段为398 bp。经过对PCR产物电泳结果的分析得出,TPH-2基因片段扩增的最佳退火温度为45℃;内参β-actin基因片段扩增的最佳退火温度为45℃(图2)。
2.3 Mg2+浓度对扩增效率的影响
Mg2+是影响Taq酶扩增效率的重要因素,一般在1.25 mmol/L~2.75 mmol/L,但扩增效率因序列不同而有不同。应用分析软件对电泳条带IOD值进行分析时发现,在2 mmol/L时扩增效率及特异性良好;Mg2+浓度在1.5 mmol/L~2.5 mmol/L时对β-actin基因特异性引物的扩增效率影响不是很明显。故试验选用2 mmol/L Mg2+浓度进行TPH-2基因和β-actin基因的扩增(图3和图4)。
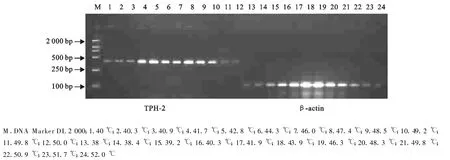
图2 TPH-2和β-actin退火温度的确定Fig.2 Determination of Tm of TPH-2 and β-actin
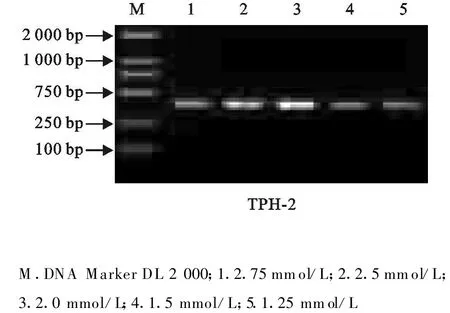
图3 不同Mg2+浓度下TPH-2 PCR产物电泳结果Fig.3 Electrophoretic result of TPH-2 PCR product at different Mg2+concentration
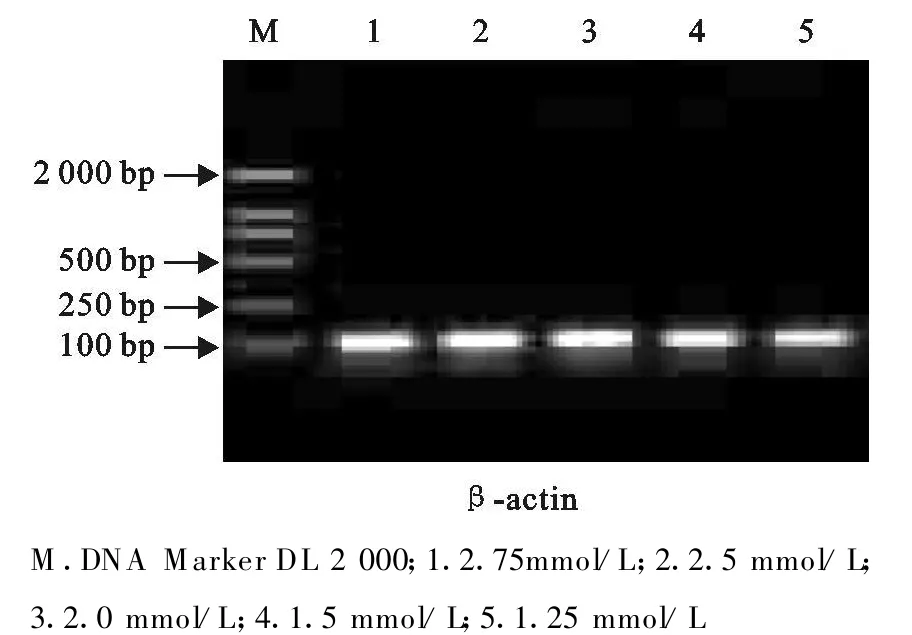
图4 不同M g2+浓度下β-actin产物电泳结果Fig.4 Electrophoretic result of β-actin PCR product at different Mg2+concentration
2.4 PCR循环数的确定
为使半定量结果更加准确,试验分别用5个不同循环数(23、25、27、30、35个循环)对目的基因进行扩增,分析扩增产物的20 g/L琼脂糖凝胶电泳结果,以条带亮度作为选择循环数的根据。从图5可见TPH-2基因中30个和35个循环所得条带亮度已基本一致,表明扩增进入平台期,TPH-2基因在25个循环时扩增的不同样本cDNA,条带明暗度有差异,可见此时处于线性增长期(图6)。β-actin在27个循环时进入平台期,两个扩增循环数需保持一致,因此确定25个循环为扩增循环数(图7)。
2.5 RT-PCR结果
β-actin基因RT-PCR扩增后20 g/L琼脂糖凝胶电泳结果显示各条带亮度基本一致(图8)。图9为TPH-2基因RT-PCR扩增后20 g/L琼脂糖凝胶电泳结果,可见条带亮度有差异,可用来作为刺激对TPH-2基因表达的半定量检验。

图5 TPH-2扩增循环数确定Fig.5 Determination of amplification cycles of TPH-2

图6 TPH-2在25个循环时的扩增 Fig.6 Amplification result of TPH-2 gene
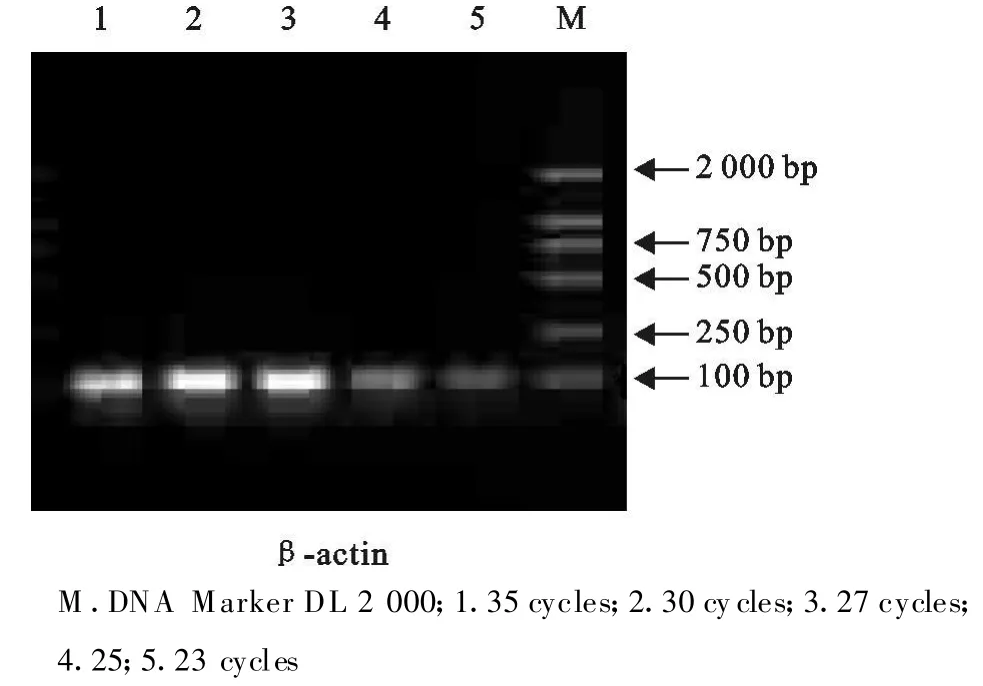
图7 β-actin扩增循环数确定Fig.7 Determination of amplification cycles of β-actin
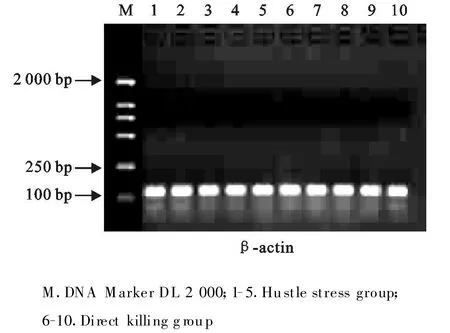
图8 β-actin 20 g/L琼脂糖凝胶电泳图Fig.8 Electrophorog ram of β-actin 20 g/L agarose

图9 TPH-2 20 g/L琼脂糖凝胶电泳图Fig.9 Electrophorogram of TPH-2 20 g/L agarose
2.6 试验数据统计
利用Gelpro凝胶成像系统软件分析得出β-actin、T PH-2基因PCR产物的灰度值,TPH-2的灰度值分别除以β-actin的灰度值,得出相对灰度值(表1)。
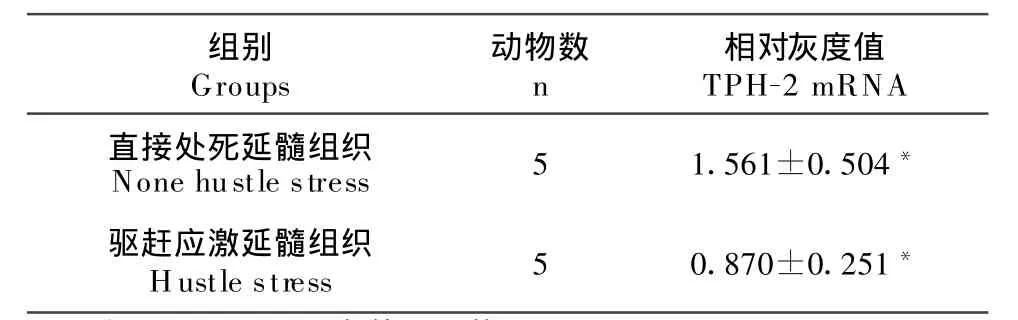
表1 TPH-2 mRNA在延髓组织及其驱赶应激组织中表达量的差异Table 1 The diferences gene ex pressions of TPH-2 between none hustle stress and hustle stress
2.7 TPH-2及β-actin基因相对表达量与驱赶应激的关系
半定量得出的相对灰度值,经统计分析其结果为P>0.05,TPH-2基因在两组延髓组织中表达差异不显著,灰度分析表明,TPH-2 mRNA在直接处死延髓组织及其配对驱赶应激延髓组织中表达量有差异,TPH-2 mRNA在驱赶应激的延髓组织中表达上调。表明驱赶应激对TPH-2基因mRNA表达量的有影响但影响不显著。
3 讨论
3.1 关于TPH
TPH为5-H T合成的关键酶和限速酶,直接决定着神经元内5-HT的含量。5-HT又称血清素(serotonin),它既是重要的单胺类神经递质,又是一种血管活性物质,在中枢神经系统中分布广泛,几乎参与生物体所有的生理活动和行为功能的调控,包括情感、认知、感觉,以及内分泌功能、胃肠道功能等。TPH的生理活性和表达水平的正常与否影响着5-H T的合成量,可以增强或减弱5-HT及其代谢物的作用强度,进而影响它在中枢神经系统的功能。TPH分为TPH-1及TPH-2,其中T PH-2对中枢5-HT的合成具有重要作用[7]。因而TPH-2基因也成为与5-HT功能紊乱相关的精神疾病遗传学研究中的一个重要的候选基因,并日益受到关注及重视。
色氨酸羟化酶是5-H T合成的关键酶和限速酶,其活性和其合成速度直接决定着神经元内5-H T的含量。在此次试验中,色氨酸羟化酶转录有上调趋势,5-HT有可能会增加,当增加达一定程度时就会引起机体不适。中枢神经系统5-HT含量及功能异常可能导致呕吐、引起精神病和偏头痛等多种疾病。但5-HT、色氨酸羟化酶、呕吐现象之间的联系的报道很少,需进一步研究证明。
3.2 有关TPH-2的RT-PCR检测
在酶的表达分析中,常用的有实时荧光定量PCR、Northern blot、免疫印迹、免疫细胞化学、免疫沉淀等定量技术,但这些方法费时费力,费用较高,且需要特殊仪器。半定量逆转录多聚酶链反应因其费用低、技术操作相对简便、快速,近年来被广泛地应用于RNA表达研究中[8-11]。这种方法将mRNA反转录成cDNA,然后进行PCR扩增,通过测定PCR产物的量,可以推出各样品中特异mRNA的相对含量。
虽然RT-PCR检测快速简单,但受很多因素影响[12]:①总RNA和cDNA的质量,在用RT-PCR法来对mRNA进行半定量时,只有在总RNA未被降解的情况下,才能保证其中mRNA的完整性和反转录的cDNA的质量,从而能够真实的反映起始模板中基因表达量的差异。为达到这一要求,从采集样本到反转录都要保证无RNA酶污染,尽量减少RNA的降解。检测总RNA的完整性是必要的,浓度不高,完整性差的样本尽量弃用,以免影响试验结果。有时为避免样品中DNA残留造成的假阳性的影响,在反转录时,需用DNA酶消除残存在样品中的DNA。②引物的选择,引物的好坏往往是PCR反应成败的关键,做半定量检测时,引物特异性要高,否则会影响反应结果。③PCR循环数的确定,PCR扩增反应是酶促反应,遵循酶促反应定律。产物与模板有一个线性关系,RT-PCR技术就是利用这一点来对目的基因中mRNA表达进行定量。表达丰度不同的基因半定量分析的PCR循环数不同。选择合适的循环数不仅能使扩增产物在琼脂糖凝胶上清晰可见和定量,也可使扩增反应在到达平台期前的线性范围内进行,这样半定量的结果就更加准确。
总之,半定量RT-PCR是一种粗略地估计基因表达的相对变化的方法,若要精确地计算基因的表达量还需利用实时荧光PCR等技术方法。由于多数研究并不是检测转录水平微小的变化或确切的表达量,而是检测其表达水平变化差异是否显著。所以,随着该技术的日趋成熟与完善,半定量分析mRNA水平的方法将成为研究者的强有力的研究手段。在本试验中,TPH-2 mRNA在驱赶组和直接处死组的两组延髓组织中表达差异不显著,在驱赶应激的延髓组织中表达上调。表明驱赶应激对TPH-2基因mRNA表达量有影响但影响不显著,为下一步对色氨酸羟化酶的研究提供依据和技术支持。
[1] Walther D J,Peter J U,Bashammakh H S,et al.Synthesis of serotonin by a second try ptophan hydroxylase isoform[J].Science,2003,299:76.
[2] Zill P,Preuss U W,Koller G,et al.SNP-and haplotype analysis of the tryptophan hydroxy lase 2 gene in alcohol-dependent patients and alcohol-related suicide[J].Neuropsychopharmacology,2007,32:1687-1694.
[3] Lopez Delara C,Brezo J,Rouleau G,et al.Effect of tryptophan hydroxylase-2 gene variants on suicide risk in major depression[J].Biol Psychiatry,2007,62:72-80.
[4] 张玉琦,袁国桢,李桂林,等.TPH2基因rs7305115单核苷酸多态性与抑郁症自杀未遂的关联研究[J].中国神经精神疾病杂志,2007,33:103-105.
[5] 陈壮飞,曾 勇,许秀峰,等.云南汉族、基诺族色氨酸羟化酶2基因rs1386494、G1463A多态性与精神分裂症的关联研究[J].中华临床医师杂志,2009,3(1):72-82.
[6] Stacey A S,Timothy J G,David M T,et al.Differential tissue distribution of try ptophan hydroxylase isoforms 1 and 2 as revealed with monospecific antibodies[J].Brain Research,2006,1085:11-18.
[7] 张秀劼,曾 勇.色氨酸羟化酶2与精神疾病的分子遗传学研究[J].医学综述,2008,14(12):1791-1793.
[8] 王树俊,曹新广,陈小兵,等.RT-PCR法检测SHH和PTCH在食管鳞状细胞癌中的表达[J].临床肿瘤学杂志,2009,14(2):115-117.
[9] 金海敏,孟庆勇.半定量RT-PCR法检测T LR4在人大肠癌中的表达[J].现代实用医学,2009,21(7):682-684.
[10] 彭晓玲,兰 玲,马亚珍,等.高致病性禽流感RT-PCR快速诊断方法的建立[J].动物医学进展,2009,30(1):40-42.
[11] 文英会,崔保安,刘内生,等.一例猪流感的RT-PCR诊断[J].中国畜牧兽医,2009,36(1):102-103.
[12] 劳荃蘅,黄锡霞,田可川,等.用半定量RT-PCR法检测BⅢB4基因在绵羊皮肤组织中的mRNA表达[J].新疆农业科学,2009,46(2):443-448.

