外科围术期营养药应用情况调查分析
袁 波,张 萍,黄 芳(1.复旦大学药学院,上海 0103;.同济大学附属第十人民医院,上海0007)
自1952年法国外科医师Rbert Aubaniac首先解决高渗糖的胃肠外营养(parenteral nurition,PN)途径,20世纪70年代法国Solassol等研究首次将乳化脂肪、氨基酸、葡萄糖与电解质的混合液用于肠外营养,而我国1979年北京已有正式论文报告,1985年出现应用PVC材料的3 L袋装的全营养液,肠外营养学科如今发展已几十年,挽救了很多严重营养不良患者的生命。但是随着营养药在临床的广泛应用,其不合理应用现象日渐突出,导致药品不良反应增多,治疗失败,以及患者经济负担加重等。因此合理使用营养药对于有效控制和治疗患者营养受损状态,降低药品不良反应发生率以及降低医药费用有着重大意义。为了解我院营养药的使用情况,抽查了我院2010年4月外科手术住院病历1 889份。现将用药结果以及用药情况进行系统性分析,为我院提供营养药应用的准确信息,为营养药的规范管理及合理使用提供参考,为医院制定相关整改措施提供依据,从而达到提高医院整体用药水平的目的[1,2]。
1 资料与方法
1.1 调查对象
抽取我院2010年4月出院的外科病历2 453例,其中行手术治疗的1 889例,并且有257份病历在住院期间应用了营养支持药。
1.2 调查方法
对其中应用营养药、行手术治疗的257份病历,根据患者的性别、年龄、诊断、病历号、手术名称、营养药选择、联合用药、用药时间、用法用量等进行记录,然后根据评价标准进行合理性分析及统计,见表1。

表1 围术期营养药使用合理性评价标准Tab1 Evaluation criteria for the rationality of perioperative use of nutritional supplement
1.3 参考标准
《临床肠内及肠外营养操作指南(草案)》(2004年版,简称“操作指南”)、《ESPEN Guidelines on Parenteral Nutrition:Surgery》(2009 年版,简称“ESPEN Guidelines”)。
2 结果
2.1 一般情况
257份病历中,男性143例,女性114例,年龄最大78岁,最小9岁,平均57.6岁,≥65岁82例;住院天数:最多24 d,最少3 d,平均11.2 d,257例手术分布科室及营养支持途径见表2。

表2 257例手术分布科室及营养支持途径Tab 2 Distribution of clinical department and the nutritional support approach for the 257 surgical cases
2.2 营养药使用情况
营养药包括胃肠内营养药和胃肠外营养药,我院所使用的品种共计10个品种,以整蛋白质或蛋白质游离物为氮源,渗透压接近等渗(300~150 mmol·L-1)的肠内营养乳剂 TPFD,因口感较好,口服或管饲均可,且适用于血糖值较高的患者,得到临床医师和患者的青睐,连续3年列销售金额排序的前列,见表3。主要由氮源、脂肪、糖类、维生素和矿物质组成的短肽型肠内营养混悬液,因成分明确,营养全面,可根据患者的病理、生理需要来增减营养素成分或改变其比例,从而达到治疗效果,且无需消化即可直接或接近直接吸收,一般配方中不含膳食纤维和乳糖,适用于乳糖不耐受者,其应用量也呈逐年稳步上升。
2.3 营养药治疗不合理使用情况
围术期使用营养药治疗的病历中存在着部分不合理现象见表4。
3 讨论
3.1 围术期营养支持使用的临床指征不严
围术期的营养支持治疗是为了尽可能地减少手术后并发症的产生,最大限度地减轻负氮平衡,维持肌肉、免疫和感知功能,促进术后恢复。目前术前严重营养不良的评价指标为:(1)6个月内体重减轻 >10% ~15%;(2)BMI<18 kg·m-2;(3)血清白蛋白 <30 g·L-1。以上指标是评价是否开始营养支持治疗的重要证据。还有研究证明低白蛋白血症是术后感染导致死亡的重要风险因素[3];术后不能正常进食超过14 d的患者死亡率会大幅增加[4]。
在本次所调查的病例中,有62份病例(24.12%)在进行营养支持治疗时未进行入院营养状况评估,由于我院主要为神经外科和SICU患者使用营养药,而该类患者由于入院时多处于危重、昏迷状态,无法进行有效的现场问答评估,但是医师也可根据患者的其他病理、生理指征,完成相应的评估,作为用药依据。
在调查中还发现有12份病例(4.67%)检查了白蛋白指标,但检测值正常却仍然使用营养支持药,其中1例还同时连续4 d使用白蛋白10 g·d-1,没有考虑到白蛋白的补充仅限于低蛋白血症型营养不良,加重了患者的经济负担。
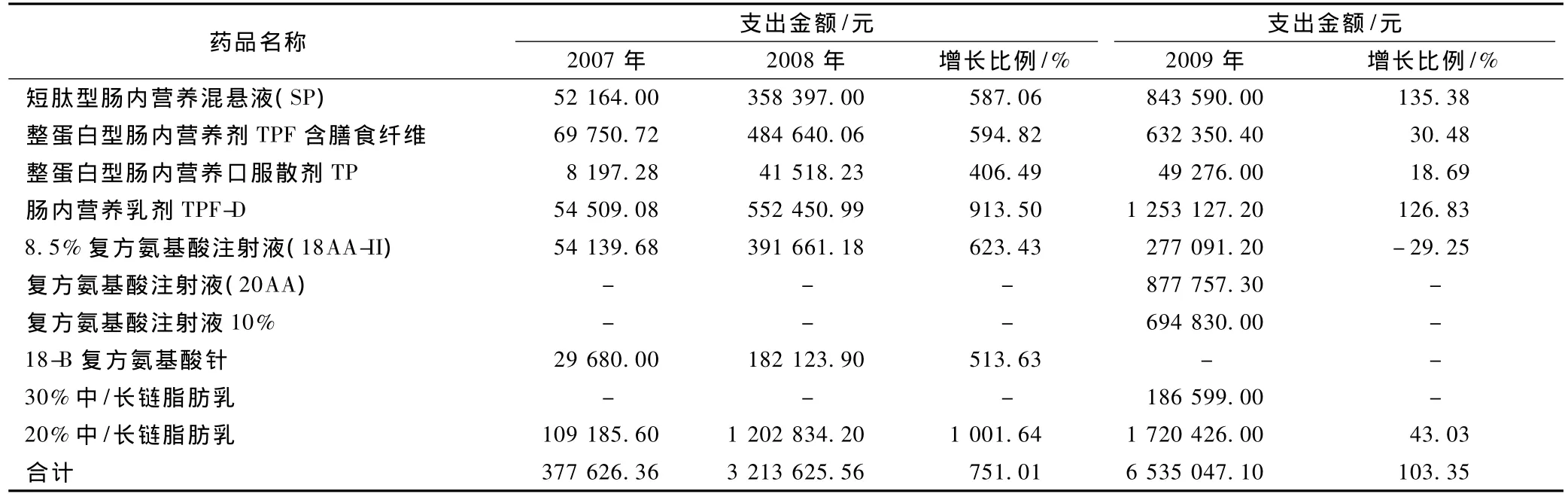
表3 2007—2009年胃肠外营养药使用情况Tab 3 Use of parenteral nutritional supplement in 2007-2009

表4 围术期使用营养药不合理内容结果统计Tab 4 Contents of the irrationality in the perioperative use of nutritional supplement
3.2 患者使用营养药的剂型配比不当
由于术前进行营养支持治疗应达到7~10 d[5],造成住院时间的延长和住院费用的增加,建议患者进行口服免疫调节治疗[6,7]。而在我院入院的神经外科手术患者,由于多数无法进行择期手术,因此无法在入院前进行口服营养治疗,在其他可以进行择期手术的患者中,有15位需要营养支持的患者在入院前没有进行任何营养补充。
术后胃肠道功能损伤或7 d内不能恢复正常进食的患者,建议进行胃肠内营养支持或混合肠外营养支持,其比例应为6∶4[8,9],在本次所调查的病例中,有 53 份病例在使用营养支持治疗时未注意到肠内和肠外剂型的配比,只使用静脉营养输液。
3.3 患者使用营养药的能量来源比例不当
葡萄糖、蛋白质和脂肪乳是人体3种主要的营养要素,葡萄糖是人体主要的能量来源,氨基酸用于蛋白质消化和吸收障碍、蛋白质摄取不足或消耗过多导致的营养不良,脂肪乳用于营养受损时补充必需脂肪酸。在总热量中比例为蛋白质∶脂肪∶葡萄糖=20∶30∶50,在不需要蛋白质作为热量来源时,葡萄糖∶脂肪 =50∶50 或 60∶40,甚至可达到 70∶30。但医师在确定营养素需要量时应当根据疾病状况、体重与体成份组成、生理功能变化等方面进行个体化评估,制定合理化配方。
有文献建议患者术前补充富含碳水化合物的饮料,不仅能够减轻胰岛素抵抗、术后高甘油三酯症状、蛋白质丢失情况,同时还可缓解焦虑、术后恶心和呕吐,甚至在心脏外科手术中还具有心血管保护作用,对于不能进食的患者,葡萄糖输液速度为 5 mg·kg-1·min-1[10],口服的碳水化合物时最好混合有浓度为12.5%的麦芽糊精,输液葡萄糖浓度宜为20%。人体一般日常能量需求为 25 cal·kg-1·d-1,严重应激状态下位30 cal·kg-1·d-1,蛋白质的需求量为 1.5 g·kg-1·d-1。
而在本次所调查的病例中,有45份病例中的患者主要能量来源为脂肪乳剂和氨基酸制剂,碳水化合物严重不足,能量比例为 80∶20,与“操作指南”及“ESPEN Guidelines”中推荐的标准不符合。
3.4 营养药物使用的禁忌证
肠外营养的基本适应证是胃肠道功能障碍或衰竭者,主要包括胃肠道梗阻、胃肠道吸收功能障碍、重症胰腺炎、高分解代谢状态(大面积烧伤、严重复合伤、感染等)以及严重营养不良患者,但长期使用肠外营养制剂会导致脂肪肝和胆汁淤积[11],尤其对心功能和呼吸功能不全的患者更加有害[12],特别是在肠外营养中使用脂肪乳剂时更需要注意脂肪代谢紊乱患者禁用,但在调查中发现1例患者入院前已出现高脂血症,但仍然在使用脂肪乳剂。
4 结论
分析近3年来我院营养支持药的使用情况,尽管其用药金额在医院整体用药金额所占比例不大,但年增张幅度较大,因此其在临床的合理使用更需要引起我们的关注,无论是肠内还是肠外营养支持,首先要做好患者的营养状态评估,围术期患者按照NRS2002评分大于或等于3分即有营养不良风险,方可进行营养支持,然后根据患者个体的营养状态制定合理的营养支持方案,通过本次的调查发现了某些问题,尤其是患者营养状态评估和个体化营养方案制定方面有不少缺陷,同时对我院外科围术期使用营养药的情况有了基本的了解,可为我院临床药师开展工作提供有益的借鉴。
[1] 王 炜,陈利欣,多力昆.我院围术期抗菌药物应用情况调查与分析[J].中国医院用药评价与分析,2010,10(1):27.
[2] 彭元香.门诊外伤患者抗菌药物的应用分析[J].中国医院用药评价与分析,2007,7(4):264.
[3] MacKay G,Fearon K,McConnachie A,et al.Randomized clinical trial of the effect of postoperative intravenous fluid restriction on recovery after elective colorectal surgery[J].Br J Surg,2006,93(12):1469.
[4] Griesdale DE,de Souza RJ,van Dam RM,et al.Intensive insulin therapy and mortality among critically ill patients:a meta-analysis including NICE-SUGAR study data[J].CMAJ,2009,180(8):821.
[5] Bozzetti F,Gavazzi C,Miceli R,et al.Perioperative total parenteral nutrition in malnourished,gastrointestinal cancer patients:a randomized,clinical trial[J].JPEN J Parenter Enteral Nutr,2000,24(1):7.
[6] Braga M,Gianotti L.Preoperative immunonutrition:costbenefit analysis[J].JPEN J Parenter Enteral Nutr,2005,29(1 Suppl):S57.
[7] Bozzetti F,Gianotti L,Braga M,et al.Postoperative complications in gastrointestinal cancer patients:the joint role of the nutritional status and the nutritional support[J].Clin Nutr,2007,26(6):698.
[8] Hammerlid E,Wirblad B,Sandin C,et al.Malnutrition and food intake in relation to quality of life in head and neck cancer patients[J].Head Neck,1998,20(6):540.
[9] ASPEN Board of Directors and the Clinical Guidelines Task Force.Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients[J].JPEN J Parenter Enteral Nutr,2002,26(1 Suppl):1SA.
[10] Breuer JP,von Dossow V,von Heymann C,etal.Preoperative oral carbohydrate administration to ASA IIIIV patients undergoing elective cardiac surgery[J].Anesth Analg,2006,103(5):1099.
[11] Noblett SE,Snowden CP,Shenton BK,et al.Randomized clinical trial assessing the effect of Doppler-optimized fluid management on outcome after elective colorectal resection[J].Br J Surg,2006,93(9):1069.
[12] Patiño JF,de Pimiento SE,Vergara A,et al.Hypocaloric support in the critically ill[J].World J Surg,1999,23(6):553.

