银杏叶提取物磷脂复合物大鼠体内药动学研究
陈志鹏, 孙 俊, 刘 丹, 肖衍宇, 蔡宝昌*
(1.南京中医药大学,江苏省中药炮制重点实验室,江苏 南京210029;2.中国药科大学,药剂教研室,江苏南京210009)
银杏叶提取物(Ginkgo Biloba Extract,GBE)的主要活性成分为银杏黄酮和银杏内酯[1],现代药理研究表明GBE对心血管系统有着广泛而显著的作用[2-4],具有活血化瘀通络的功效[5]。由于银杏黄酮脂溶性低,小肠透过性差,生物利用度低,大大降低了临床疗效。文献报道[6,7],天然活性成分与磷脂分子间通过氢键等电荷迁移力作用可以形成磷脂复合物(phytosomes或 phospholipid complex),其活性较原化合物有明显的改善,可以有效地提高天然活性成分在体内的吸收,显著地增加其生物有效性。本课题组在前期研究中成功制备银杏叶提取物磷脂复合物(Ginkgo biloba extract phospholipid complex,GBP),体外研究表明,GBP能一定程度的改善其理化性质,本研究以GBE为参比制剂,以槲皮素、山柰酚及异鼠李素为指标性成分,进一步研究GBP中GBE在大鼠体内的药动学过程,为中药有效部位难溶性成分的开发提供参考。
1 试验材料
1.1 试药 槲皮素(批号100081-200406,纯度 >98%)、山柰酚(批号110861-200405,纯度 >98%)、异鼠李素(批号110860-200406,纯度>98%)均购自中国药品生物制品检定所;GBE(邳州富伟生化制品有限公司,含银杏黄酮≥24%,银杏内酯≥6%);甲醇(色谱纯),磷酸(分析纯)。
1.2 仪器 Shimadzu LC-20A高效液相色谱仪(日本岛津公司);数显恒温水浴锅HH-6(国华电器有限公司);涡漩混合器XH-C(金坛市医疗仪器厂);TGL-16台式高速离心机(金坛市医疗仪器厂);METTLER TOLEDO AL104电子天平(梅特勒-托利多仪器上海有限公司)。
1.3 试验动物 ♂性SD大鼠12只,体重180~220 g,由南京中医药大学动物中心提供(合格证号:SYXK(苏)2002-0008)。
2 试验方法
2.1 GBP的制备 依据文献[8]采用溶剂法制备GBP。取等量的GBE、磷脂,加入无水乙醇溶解,混匀,室温下在磁力搅拌器搅拌2 h,40℃减压干燥,真空干燥过夜即得。
2.2 体内分析方法的建立
2.2.1 色谱条件 色谱柱:Hedera ODS-2柱(4.6 mm ×250 mm,5 μm);流速:1 mL/min;检测波长:370 nm;柱温:30℃;流动相:甲醇-0.4%磷酸(60:40);进样量:20 μL。
2.2.2 血浆处理方法 取血浆样品0.2 mL置10 mL离心管中,加入0.2 mL 25%HCl,80℃水浴加热1 h,加入1 mL乙酸乙酯涡旋3 min,3 000 r/min离心10 min,吸取上层有机相,再加乙酸乙酯1 mL重复上述操作,合并两次上层有机相,于50℃水浴上用氮气吹干后用200 μL甲醇溶解,12 000 r/min离心10 min,取上清液进样。
2.2.3 血浆标准曲线的制备 精密称取槲皮素,山柰酚及异鼠李素对照品适量,用甲醇溶解稀释成含槲皮素 40 μg/mL、山柰酚 31.2 μg/mL、异鼠李素20.8 μg/mL的混合溶液,再用甲醇稀释成含槲皮素0.4、0.8、1.6、4、8、20、40 μg/mL,山柰酚 0.312、0.624、1.248、3.12、6.24、15.6、31.2 μg/mL,异鼠李素 0.208、0.416、0.832、2.08、4.16、10.4、20.8 μg/mL的系列混合标准溶液。取160 μL空白大鼠血浆,分别加入不同浓度标准溶液40 μL,分别得到槲皮素浓度为 0.08、0.16、0.32、0.8、1.6、5、8 μg/mL,山柰酚浓度为 0.062 4、0.124 8、0.249 6、0.624、1.248、3.12、6.24 μg/mL,异鼠李素浓度为0.041 6、0.083 2、0.166 4、0.416、0.832、2.08、4.16 μg/mL的血浆样品,按“2.2.2”项下操作,以血浆中槲皮素、山柰酚、异鼠李素浓度为横坐标,峰面积为纵坐标,进行回归分析,得标准曲线。
2.2.4 专属性考察 空白血浆、空白血浆加混标,大鼠灌胃GBE、GBP的血浆样品分别按2.2.2项下操作,记录色谱图。
2.2.5 方法学考察 配制槲皮素浓度为0.08、0.8、8 μg/mL;山柰酚浓度为 0.0624、0.624、6.24 μg/mL;异鼠李素浓度为 0.041 6、0.416、4.16 μg/mL低、中、高3个浓度的混合标准血浆样品5份,按2.2.2项下操作后进样分析,由标准曲线方程求出样品浓度,同时将相同浓度的标准品溶液直接进样,将经过提取所得的色谱峰面积与未经处理直接进样所得的色谱峰面积比较,计算绝对回收率。同样配制上述三种浓度的标准品溶液,测定其日内日间精密度。
2.3 药物动力学试验
2.3.1 给药方法 取大鼠12只,随机分为2组,实验前禁食12 h,自由饮水,按20.3 mg/kg槲皮素、14.7 mg/kg山柰酚、3.2 mg/kg异鼠李素的剂量,A组灌胃GBE;B组灌胃GBP,并分别于给药后10、20、30、45、60、90、120、240、360、480、600、720 min 经眼眶取血置于涂有肝素的离心管中,3 000 r/min离心10 min,分离血浆,-20℃冷冻保存。按“2.2.2”项下操作后,用HPLC分析,将所得数值代入标准曲线求得血浆药物浓度。
2.3.2 药物动力学参数计算 用3P97软件对血药浓度-时间数据进行房室模型进行拟合,计算药物动力学参数。
3 实验结果
3.1 分析方法的建立
3.1.1 方法专属性 由图1可见,在拟定色谱条件下,血浆样品中槲皮素、山柰酚和异鼠李素与内源性物质分离良好,均达基线分离且无杂质峰干扰。
3.1.2 标准曲线的制备
槲皮素标准曲线为:A=37 237c-1 383.1,r=0.998 7,表明槲皮素在0.08~8 μg/mL范围内与峰面积线性关系良好。
山柰酚标准曲线为:A=33 311c-1 226.4,r=0.999 2,表明山柰酚在0.062 4~6.24 μg/mL 范围内与峰面积线性关系良好。
异鼠李素标准曲线为:A=18 803c-694.54,r=0.998 9,表明异鼠李素在0.041 6 ~4.16 μg/mL范围内与峰面积线性关系良好。
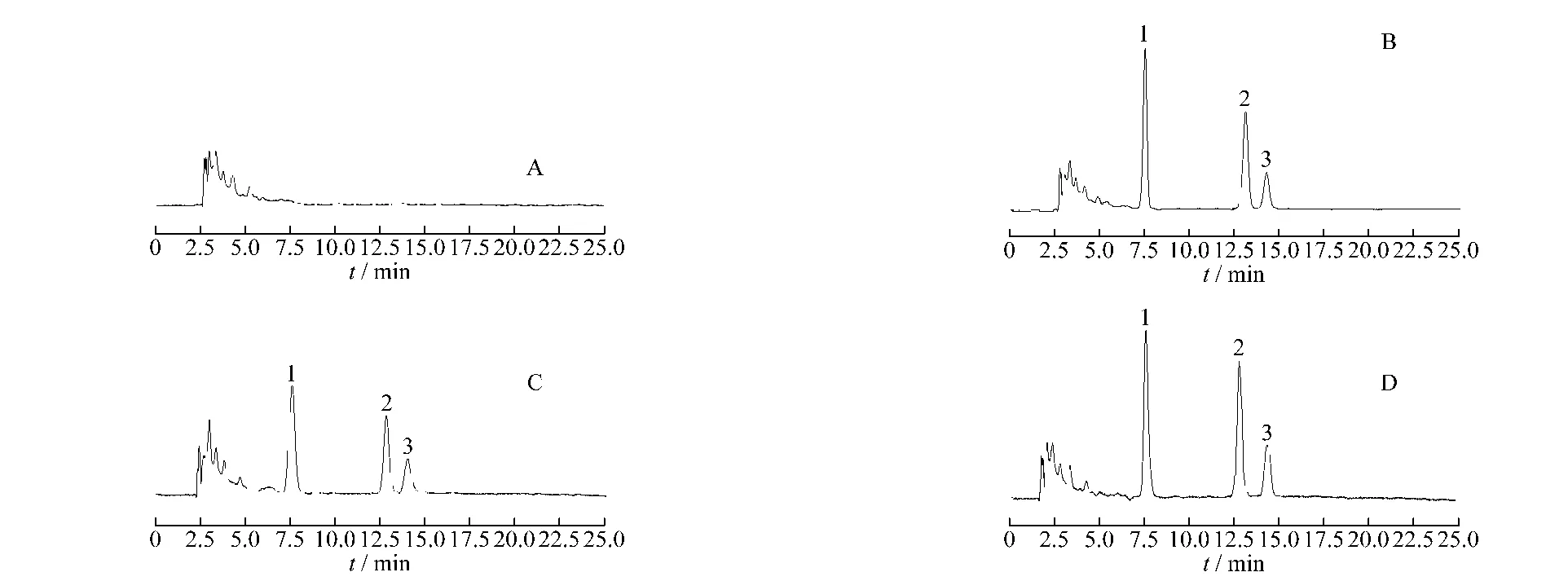
图1 A.空白血浆 B.含槲皮素(0.32 μg/mL)、山柰酚(0.249 6 μg/mL)及异鼠李素(0.166 4 μg/mL)的血浆标准品C.大鼠灌胃GBE后240 min的血浆样品 D.大鼠灌胃GBP后240 min的血浆样品 1.槲皮素2.山柰酚3.异鼠李素Fig.1 A.blank plasma B.blank plasma spiked with quercetin(0.32 μg/mL),kaempferol(0.249 6 μg/mL)and isorhamnetin(0.166 4 μg/mL)C.plasma sample at 240 min after oral administration of GBE D.plasma sample at 240 min after oral administration of GBP.1.quercetin 2.kaempferol3.isorhamnetin
最低定量限分别为 0.056、0.048、0.039 μg/mL(S/N≥10)。
3.1.3 方法学考察 本检测方法中,槲皮素、山柰酚、异鼠李素的平均回收率为82.14%、83.17%和82.96%,低、中、高3种浓度回收率结果见表1,低、中、高3种浓度槲皮素、山柰酚、异鼠李素的日内、日间差都在10%以内。符合生物样本分析测试的要求。
3.2 药动学研究
3.2.1 大鼠分别灌胃GBE和GBP后,槲皮素、山柰酚及异鼠李素血药浓度-时间曲线见图2。

表1 槲皮素、山柰酚及异鼠李素在大鼠血浆中的回收率(n=6)Table 1 Recovery of quercetin,kaempferol and isorhamnetin in rat plasma.(n=6)
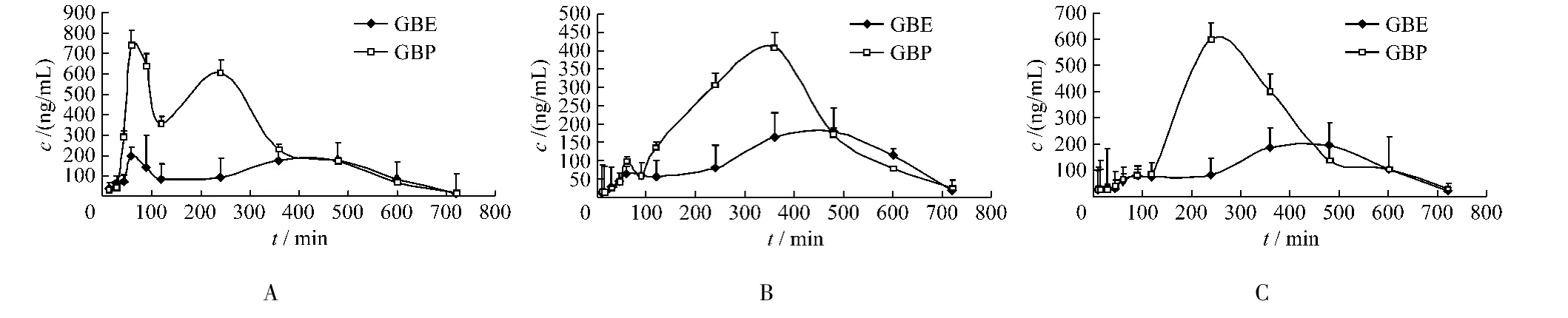
图2 大鼠口服GBE和GBP后槲皮素(A)、山柰酚(B)及异鼠李素(C)的血药浓度经时曲线(n=6)Fig.2 The plasma concentration-time curve of quercetin(A),kaempferol(B)and isorhamnetin(C)in rats after oral administration of GBE and GBP(n=6)
3.2.2 药物动力学参数 大鼠灌胃给予GBE和GBP后所得槲皮素、山柰酚及异鼠李素浓度数据用3P97软件进行房室模型拟合,以AIC为判据,得出槲皮素、山柰酚及异鼠李素在大鼠体内的药代动力学过程均符合一室模型,主要药物动力学参数见表2。
4 讨论
银杏黄酮主要以槲皮素、山柰酚及异鼠李素及其与糖结合而成苷的形式存在,因此测定大鼠血浆中槲皮素、山柰酚,异鼠李素之前先对其苷元进行水解。前期研究考察5个比较关键的水解因素,如:水解液中盐酸的浓度,水解液的体积,水解温度,水解时间以及萃取的次数,以样品的回收率为指标评价制备过程的可行性。最后得出最佳提取工艺,即往0.2 mL的血浆中加入等体积的25%HCl,在水浴中80℃加热60 min后,3种苷元水解完全,回收率最高。此外,有报道用β-葡萄糖醛酸酶及硫酸酯酶水解血浆样品[9],但是两者的价格均较昂贵,所以我们选择了便宜又方便的盐酸来水解样品。前期研究中还比较液-液萃取法及蛋白质沉淀法,发现液-液萃取法的回收率较高。对于萃取溶剂,我们考察了乙酸乙酯,氯仿以及乙醚,结果发现乙酸乙酯萃取的效果最好,故选择乙酸乙酯作为我们的萃取溶剂。
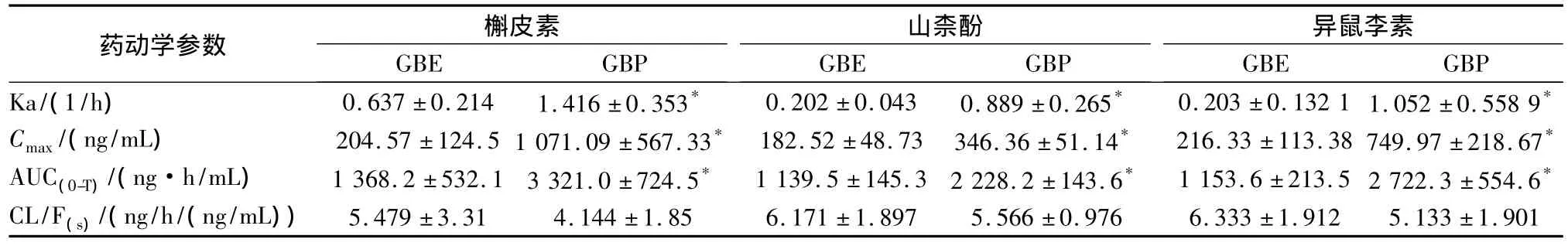
表2 大鼠体内槲皮素、山柰酚及异鼠李素主要药动学参数(n=6)Table 2 The main pharmacokinetic parameters of quercetin、kaempferol and isorhamnetin in rats(n=6)
本实验通过研究大鼠灌胃GBE和GBP后,槲皮素、山柰酚及异鼠李素的药物动力学特征及生物利用度,考察GBP的体内行为。结果显示,与GBE相比GBP生物利用度有显著的提高,3种指标性成分的AUC均提高2倍以上,此外,吸收速率常数和Cmax均有显著的增加,显示,制备成磷脂复合物后,GBP的吸收速率显著高于GBE。
在研究中发现GBE的体内存在明显双峰现象,推测是由于肝肠循环、胃肠循环或者是药物在体内的分布造成。马越鸣[10]发现地西泮在体内也存在双峰现象,结果显示其在体内同时存在肝肠循环及胃肠循环,而胃肠循环是导致出现第二个峰的主要原因;也有报道黄芩苷在体内存在存在双峰的原因是肝肠循环[11];有报道粉防己碱在大鼠体内出现双峰是归结于它在体内的分布[12],而银杏黄酮出现双峰的原因有待于进一步研究。
[1]Beek T V.Chemical analysis of Ginkgo biloba leaves and extracts[J].J Chromatogr A,2002,967(1):21-55.
[2]戴 伟,陈学智,王小莉,等.银杏提取物及银杏黄酮调节大鼠血脂的效果研究[J].上海预防医学杂志,2003,15(6):2621-2625.
[3]耿秀芳,孙晓丽,王洪刚,等.银杏叶总黄酮降压作用的实验与临床研究[J].中国中药杂志,2002 ,27(8):606-608.
[4]章红燕,侯桂兰,何福根.银杏叶总黄酮和银杏内酯对心脑血管作用的研究进展[J].浙江临床医学,2008,10(4):543-547.
[5]中国药典[S].2005:281.
[6]翟光喜,娄红祥,邹立家,等.药物磷脂复合物的研究进展[J].中国药学杂志,2001,36(12):800-803.
[7]吴建梅,陈大为,孙 波,等.天然活性成分磷脂复合物药学研究概述[J].中国药学杂志,1998,33(1):9-11.
[8]孙 俊,陈志鹏,蔡宝昌.银杏叶提取物磷脂复合物的制备[J].中华中医药学刊,2009,27(12):2671-2673.
[9]田 杨,蒋学华,兰 轲,等.HPLC测定大鼠血浆中的山奈酚[J].华西药学杂志,2008,23(3):357-359.
[10]马越鸣,孙瑞元.地西泮血浆浓度的第二峰与肠胃循环[J].中国药理学报,1993,14(3):218-221.
[11]Xing Jie,Chen Xiaoyan,Zhong Dafang.Absorption and enterohepatic circulation of baicalin in rats[J].Life Sci,2005,78(2):140-146.
[12]孟德胜,胡友梅.粉防己碱在小鼠药时曲线中的双峰现象[J].中国临床药学杂志,1999,8(5):303-305.

