粟米草中抗肿瘤的活性成分研究
刘可越, 刘海军, 吴家忠, 高春华, 刘建云, 李雪芹, 周 斌
(1.九江学院基础医学院,江西省高等学校系统生物学临床应用重点实验室,江西 九江332000;2.江西科技师范学院,江西南昌330000)
粟米草是番杏科植物Mullugo pentaphylla L.,为东南亚国家的传统草药,具有清热解毒、抗菌利湿的功效,主治腹痛泄泻、疮疖肿毒、风疹等症[1]。我国粟米草药用资源丰富,主要分布于江西省及华南大部分地区,以全草入药。现代医学研究表明,粟米草具有抗癌、杀精、抗心律失常、降压等药理作用[2-5]。埃及科学家曾报道粟米草根中具有能显著抗癌的化学成分,其抑制肿瘤细胞增殖活性 IC50仅为0.018 μmol/L。而粟米草在民间常作为治疗疮痈肿毒,“痈症”即包括现代医学的肿瘤疾病,因此用粟米草治疗肿瘤有一定开发价值。然而近年来并未见其抗肿瘤方面的相关报道,因此为了探讨其抗肿瘤的活性,充分利用丰富的药源,笔者对粟米草的化学成分进行系统研究,并采用四甲基偶氮唑盐比色法(MTT法)和琼脂糖凝胶电泳法研究化合物体外对Hela肿瘤细胞增殖的影响。以期为粟米草抗肿瘤作用及其机理的深入研究和探索中药粟米草在肿瘤治疗应用方面的前景提供依据。
1 实验部分
1.1 材料与仪器
粟米草药材采自江西省九江市庐山周边,经鉴定为粟米草属(Mullugo)植物粟米草(Mullugo pentaphylla L.),标本保存于九江学院基础医学院庐山特色药用植物研究所。熔点用X-4显微熔点测定仪测定,温度计未校正;质谱用Thermo Finnigan LCQ advantage型质谱仪测定;核磁共振氢谱、碳谱用Bruker AV-400核磁共振仪测定;RE-52AA型旋转蒸发仪;CO2培养箱(Thermo Forma);层析用硅胶为青岛海洋化工厂产品,Sephadex LH-20柱层析填料购于Pharmacia公司。所用试剂均为分析纯。紫杉醇为北京四环医药科技股份有限公司产品;胎牛血清为杭州四季青生物工程材料公司产品,RPM11640和胰蛋自酶购自美国GIBCO公司,SDS为美国Biotec公司产品;倒置显微镜(德国Leica公司);酶联免疫检测仪(美国Bio-Rad公司)。肿瘤细胞株:人子宫颈癌细胞株Hela(购自中国科学院上海细胞生物所)。
1.2 提取与分离
粟米草干燥全草3 kg,切成1~2 cm小段,用10倍量80%乙醇加热回流提取2次,每次2 h。合并提取液,减压回收溶剂,得乙醇提取物浸膏90.5 g。该醇提物悬浮于水中,以石油醚(60~90℃)、乙酸乙酯、水饱和正丁醇萃取,回收有机溶剂,得各部位萃取物。取石油醚部位萃取物15 g,硅胶柱层析,以石油醚-乙酸乙酯系统(20∶1→1∶1)梯度洗脱,得9个组分(Fr.P1-9)。其中Fr.P3(3.0 g),Fr.P4(2.3 g)和Fr.P9(3.6 g)分别经硅胶柱色谱,以石油醚-乙酸乙酯系统(15∶1→2 ∶1)洗脱,得化合物1(22 mg)、2(10 mg)、3(25 mg)。取乙酸乙酯部位萃取物26 g,硅胶柱层析,以石油醚-乙酸乙酯系统(5∶1→0∶1)梯度洗脱,得8个组分(Fr.E1-8)。Fr.E1组分经Sephadex LH-20柱色谱,以甲醇洗脱,得化合物4(15 mg)。Fr.E8组分经减压回收溶剂分别出现颗粒状沉淀,经PHPLC纯化的化合物5(12 mg)。
2 结构鉴定
化合物1:白色片状结晶(石油醚-乙酸乙酯5∶1),mp 288~289℃,与表木栓醇对照品薄层色谱Rf值及显色行为一致。13C-NMR(100 MHz,CDCl3)∶16.38(C-1),35.31(C-2),72.53(C-3),49.38(C-4),37.64(C-5),41.74(C-6),17.23(C-7),53.39(C-8),37.12(C-9),61.58(C-10),35.43(C-11),30.26(C-12),38.67(C-13),39.56(C-14),32.63(C-15),36.02(C-16),30.05(C-17),42.55(C-18),35.65(C-19),28.34(C-20),32.88(C-21),39.62(C-22),11.60(C-23),15.59(C-24),18.12(C-25),18.60(C-26),20.10(C-27),32.06(C-28),34.99(C-29),31.78(C-30)。其熔点、色谱行为及13C-NMR(CDCl3)资料均与文献报道[6]一致,结果该化合物鉴定为表木栓醇。
化合物2:白色颗粒状结晶(石油醚),mp 82~84℃。红外光谱显示其为长链脂肪醇特征谱峰。EI-MS m/z∶453[M+1]+,421,153,125,97,83,71,57,43。质谱显示直链脂肪醇特征裂解,确定该化合物为三十一烷醇。
化合物3:白色针晶(乙酸乙酯),mp 140~141℃,硫酸显色呈绿色。与β-谷甾醇对照品薄层色谱Rf值及显色行为一致,1H-NMR(CDCl3)与13C-NMR(CDCl3)资料与文献报道[7]一致,确认其为 β-谷甾醇。
化合物4:黄色粉末(氯仿-甲醇),mp 258~259℃,EIMS m/z 433[M+1]+。1H NMR(400 MHz,DMSO-d6)δ ∶8.01(2H,d,J=8.6 Hz,H=2′,6′),6.83(2H,d,J=8.6 Hz,H=3′,5′),6.76(1H,s,H-6),6.25(1H,s,H-3),4.65(1H,d,J=9.9 Hz,Glc H-1).13C NMR(100 MHz,DMSO-d6)δ:163.91(C-2),101.86(C-3),181.93(C-4),158.92(C-5),98.32(C-6),162.28(C-7),103.92(C-8),160.81(C-9),104.56(C-10),121.68(C-1′),128.90(C-2′,6′),116.12(C-3′,5′),161.63(C-4′),Glu 信号 C-1″~C-6″:79.32,73.56,71.27,70.53,81.65,61.56. 以上波谱资料与文献[8]中牡荆素报道一致,确认其为牡荆素。
化合物5:淡黄色针晶(石油醚-乙酸乙酯),mp 316~317℃,Mg-HCl反应阳性,与槲皮素对照品薄层色谱Rf值及显色行为一致,ESI-MS m/z(%)∶303[M+1]+。13C-NMR(DMSO-d6)δ:146.90(C-2),122.09(C-3),176.16(C-4),156.17(C-5),93.56(C-6),164.32(C-7),98.32(C-8),160.95(C-9),103.21(C-10),135.93(C-1′),115.84(C-2′),147.89(C-3′),145.24(C-4′),115.39(C-5′),120.26(C-6′)。13C-NMR(DMSO-d6)数据均与文献报道[9]一致,化合物鉴定为槲皮素。
3 化合物对肿瘤细胞增殖的体外抑制作用
3.1 肿瘤细胞抑制率的测定
人宫颈癌Hela细胞株培养于含10%胎牛血清的RPMI1640培养基中,培养基内含青、链霉素各100 U/mL,5%CO2,37℃培养箱中培养,每3~4 d传代一次。样品以DMSO溶解,用细胞培养基稀释,DMSO稀释后最终浓度小于0.05%。将HeLa等肿瘤细胞株悬液接种于96孔培养板,每孔50 μL(含1×104个细胞),分别加入空白对照磷酸盐缓冲液(PBS)、溶剂对照(二甲基亚砜)、阳性对照(紫杉醇)以及不同浓度单体化合物(10、50、80、100、150、200、300、500 μg/mL),每组均设3个复孔。置于饱和湿度、37℃和5%CO2培养箱中培养48 h,于培养结束前4 h,各培养孔加入5 mg/mL MTT 10 μL,培养结束后,弃去培养上清液,每孔加入反应停止液150 μL,静置1 h,用酶联免疫检测仪检测各孔吸光度(OD)值,测定波长λ=570 nm,并计算肿瘤细胞抑制率。增殖抑制率(%)=(1-含药孔OD平均值/对照孔OD平均值)×100%。
3.2 DNA琼脂糖凝胶电泳分析[10]
将对数生长期的Hela细胞接种于培养皿中,3个皿内加入化合物5,同时做空白对照,分别于12 h、24 h、48 h后取出。收集细胞,以PBS洗3次,加Tris饱和酚沉淀蛋白,加酚离心抽提,取上清液,加入冷无水乙醇,析出DNA,用2%琼脂糖凝胶电泳,紫外光下观察结果并拍照。
4 实验结果
4.1 对肿瘤细胞的增殖的影响
结果表明:化合物1、4、5对宫颈癌细胞Hela均显示出一定的抑制作用,其中化合物4、5抑瘤作用较显著。见表1。

表1 化合物抗肿瘤活性筛选结果
4.2 DNA琼脂糖凝胶电泳分析
结果显示:Hela细胞在化合物5的作用下,分别处理24 h、48 h和72 h后,细胞凋亡时基因组DNA被特异性核酸内切酶水解成小分子片段,经DNA琼脂糖凝胶电泳可见明显的梯状条带;而对照组Hela细胞DNA完整,具体见图1。
5 讨论
5.1 宫颈癌是最常见妇科恶性肿瘤之一,世界每年新发病例约50万,我国发病率和病死率约占世界的1/3[11]。宫颈癌治疗手段通常包括手术、化疗及放疗。但化疗药物的毒副作用及对机体的损害制约了其临床应用。而中药中存在着毒副作用小的天然生物活性物质,具有广阔的开发前景。实验证明粟米草中含有的化合物可抑制宫颈癌Hela细胞的增殖作用,从活性的角度说明粟米草抗癌方面具有进一步开发价值,为应用粟米草治疗癌症提供了理论依据。
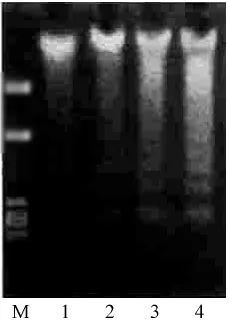
图1 化合物5处理后的Hela细胞的DNA琼脂糖凝胶电泳现象
5.2 恶性肿瘤的发生是多基因突变的细胞失控性生长,细胞增殖失控和凋亡受阻是其发生、发展的主要原因[12],有效诱导肿瘤细胞凋亡是肿瘤治疗的新方法之一[13]。本研究表明槲皮素素可体外诱导人宫颈癌Hela细胞凋亡呈时间依赖关系。DNA凝胶电泳确证槲皮素作用Hela细胞72h出现典型“梯形”DNA条带。上述结果提示槲皮素可能通过诱导细胞凋亡有效抑制人宫颈癌Hela细胞的生长。需要分离粟米草中更多的化学成分,研究其体外及体内的抗肿瘤活性,为将粟米草开发成新型抗肿瘤药物提供依据。
5.3 牡荆素和槲皮素化合物结构母核均为黄酮体,差异是取代基位置不同,并且牡荆素为碳苷,槲皮素为氧苷。牡荆素和槲皮素的抗癌作用已有不少报道[14-16]。笔者前文报道过黄酮苷与苷元抗肿瘤的构效关系,初步总结母核相同的黄酮氧苷一般较苷元抑制肿瘤细胞增殖的作用弱。黄酮碳苷和氧苷抗癌作用与其结构有何关系是值得进一步探讨的问题。
[1]谢宗万.全国中草药汇编[M].北京:人民卫生出版社,2000:597.
[2]刘可越.粟米草属植物资源、成分及药理作用研究进展[J].时珍国医国药,2009,20(2):397-398.
[3]姚果原,卢琦华.粟米草提取物(MP876)的抗乌头碱及其对大鼠血浆和心肌cAMP的影响[J].中药药理与临床,1991,7(7):11-16.
[4]李雪芹,高春华,刘建云,等.粟米草提取物对自发性高血压大鼠的降压作用[J].山东医药.2005,17(6):8-12.
[5]汪开治.埃及科学家发现粟米草根含杭癌化合物[J].浙江林业科技,2006,26(2):33.
[6]刘可越,张铁军,高文远,等.紫菀中三萜及甾体化合物的研究[J].天然产物研究与开发,2006,18(1):4-6.
[7]陈 屏,杨峻山.蒲葵籽化学成分研究[J].中草药,38(5):665-667.
[8]张 桢,刘光明,任艳丽,等.算盘子的化学成分研究[J].天然产物研究与开发,2008,20(3):447-449.
[9]刘可越,刘海军,吴家忠,等.款冬花中抑制肺癌细胞增殖活性成分研究[J].复旦大学学报(自然科学版),2009,(1):122-126.
[10]张卓然.培养细胞学与细胞培养技术[M].上海:上海科学技术出版社,2004:41-138.
[11]曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1997:1747.
[12]Waggoner S E.Cervical cancer[J].Lancet,2003,361(9376):2217-2225.
[13]Dunne A L,Price M E,Mot hersill C,et al.Relationship betweenclonogenic radiosensitivity,radiation-induced apoptosis and DNA damage/repair in human colon cancer cells[J].Br J Cancer,2003,89(12):2277-2283.
[14]Dia F,Chavez D,Lee D,et al.Cytotoxic flavone analogues of vitexicarpin,a constituent of the leaves of Vitex negundo[J].J Nat Prod,2003,66(6):865-867.
[15]侯 敢,黄迪南,祝其锋.槲皮素对 Hela细胞细胞周期和RNA聚合酶活性的影响[J].广东医学院学报,2001,19(3):163-165.
[16]柯尊金,丁心喜,董文奎.槲皮素对人膀胱癌B IU287细胞增殖和凋亡的影响[J].实用癌症杂志,2008,23(2):116-119.