紫杉醇脂质体联合顺铂治疗晚期非小细胞肺癌的临床观察
阮新建 季锡清 刘 畅 郭 智 张 侠
肺癌已成为危害人类健康最常见的肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的80%~85%,由于其恶性程度高、发展速度快,30%~40%的NSCLC患者在确诊时已属晚期[1],失去了手术的机会,因此化疗成为晚期非小细胞肺癌(NSCLC) 的主要治疗手段。2004年9月~2008年12月,我们应用紫杉醇脂质体联合顺铂(DDP)治疗晚期(ⅢB~Ⅳ期)NSCLC 43例,取得了较好的疗效,现报告如下。
1 资料与方法
1.1 一般资料
43例均为无法手术切除或是手术后复发、发生远处转移的晚期NSCLC患者,均经病理学或细胞学检查确诊。男性28例,女性15例;年龄42~69岁,中位年龄54岁;初治者19例,复治者24例;按TNM分期:ⅢB 15 例,Ⅳ期28 例;病理类型:鳞癌21例,腺癌17例,大细胞癌3例,肺泡细胞癌2例;全组患者KPS评分≥60分,血常规、肝肾功能基本正常,无其他并发症。近期4周内未用过放、化疗。
1.2 治疗方法
43例均采用紫杉醇脂质体联合DDP方案化疗;紫杉醇脂质体135 mg/m2加入5%葡萄糖液500 ml中,静脉滴注3 h,第1天;DDP 25 mg/m2加入生理盐水500 ml中,静脉滴注,第1~3天;使用紫杉醇脂质体前30 min应行预处理(地塞米松5~10 mg静脉注射;苯海拉明50 mg肌注;西咪替丁300 mg静脉注射),用药期间密切观察患者呼吸、心率、血压变化。所有患者化疗期前均常规给予5-HT3受体拮抗剂以减轻胃肠道反应,化疗后注意监测血常规、生化等指标的变化,如化疗后白细胞低于3×109/L或中性粒细胞低于1×109/L时,应给予粒细胞集落刺激因子(G-CSF)治疗,正常后停用。21天为1个周期,每化疗2个周期对客观观察病灶进行影像学如CT或MRI检查,以评价疗效。
1.3 疗效及不良反应的判断标准[2]
按照美国癌症研究所制定的RECIST疗效评估方法行客观疗效判定:完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),有效以CR+PR计算。毒性评价标准按照(美国)抗癌药物不良反应的分度标准进行观察和判断,分为0~Ⅳ度。
1.4 统计学方法
所有数据采用SPSS11.0统计软件处理,计数资料率的比较采用χ2检验。
2 结果
2.1 近期疗效
全组共化疗138个周期,平均3.2个周期,均可评价疗效。其中CR 0例,PR 16例,SD 20例,PD 7例,总有效率(RR)为37.2%;初治者有效率为47.4%;复治者有效率为29.2%,两者比较,有统计学意义(P<0.05),见表1。
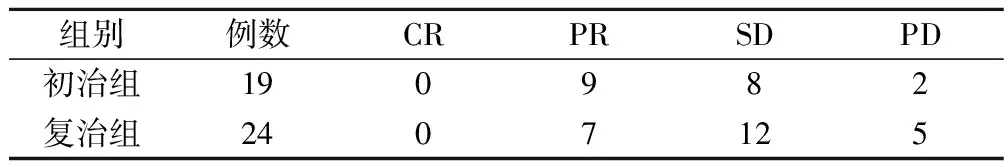
表1 初治组与复治组疗效比较(例)
2.2 不良反应
全部43例患者接受用药后的不良反应主要为骨髓抑制、胃肠道反应、周围神经毒性;骨髓抑制三系均有表现,但以白细胞减少为主为重,多数为Ⅰ、Ⅱ级,Ⅲ、Ⅳ级14例(32.6%);胃肠道反应主要表现为恶心、呕吐、便秘、腹泻等。由于及早对不良反应进行了预处理,多数患者症状轻微,且经积极对症处理可缓解;周围神经毒性主要表现为麻木,麻刺感,可耐受且停药后症状逐渐消失。全组患者无过敏反应发生,无治疗相关性死亡,见表2。
3 讨论
原发性支气管肺癌简称肺癌,其发病率和死亡率在男性居恶性肿瘤的第一位,在女性居第二位。由于早期多无症状,一经发现多为晚期,此类患者主要采用以化疗为主,辅以放疗和支持治疗的综合治疗。随着研究的进展,有meta分析表明,含铂方案的化疗较最佳支持治疗能明显延长晚期NSCLC的生存时间。目前局部晚期或转移性NSCLC标准的一线化疗方案是以铂类为基础,联合吉西他滨、紫杉醇、多西他赛、长春瑞滨等第三代新药,其有效率17%~21%,到进展时间3.3~4.5个月,中位生存期7.4~8.2个月,1年生存率31%~36%,2年生存率10.5%~15.7%[1]。

表2 紫杉醇脂质体联合顺铂毒副反应发生情况
紫杉醇是从紫杉树皮中提取后人工半合成新型的抗微管类药,主要作用机制是促进微管蛋白聚合,抑制微管解聚将癌细胞阻滞在G2期和M期,从而阻碍细胞分裂和增殖,促使癌细胞萎缩而发生凋亡,达到抗肿瘤的目的。因其作用机制独特,其单药对非小细胞肺癌的有效率3%~24%,是近十年来肿瘤专家公认的最有希望的广谱抗癌药之一。DDP被认为是治疗肺癌最重要的药物之一,单药有效率在16%~20%[3]。因此紫杉醇与顺铂联合治疗晚期非小细胞肺癌,其作用机制不同又相互补充,具有优势,是克服耐药的最佳方案之一。有报道,紫杉醇联合顺铂治疗晚期肺癌的有效率为26%~42%,中位生存期为8~10个月,1年生存率为36%[4]。但传统的紫杉醇制剂由于自身及溶媒的特点,可引起较严重的过敏反应及心血管毒性,严重时有生命危险,因此,需要比较烦琐的包括使用激素在内的预处理,一定程度上限制了诸如糖尿病、胃溃疡、高血压等患者的广泛使用。从20世纪90年代起,国内外学者开始进行紫杉醇脂质体研究,作为靶向给药新剂型,脂质体是以纯天然原料卵磷脂为材料,是由具有类生物膜结构的磷脂双分子构成的小囊泡,在体内降解无毒,无致敏性,进人体内后主要被单核一吞噬细胞内皮系统吞噬,激活机体的自身免疫功能,主要在肝脏、脾脏、肺脏和骨髓等组织器官中累积,减慢药物的消除速度,延长药物的作用时间,提高治疗指数,减少治疗剂量和降低药物毒性。将紫杉醇用卵磷脂等包被,改变了溶媒,从而避免了传统的紫杉醇制剂溶于聚氧乙烯蓖麻油复合溶媒带来的毒副作用,特别是过敏反应的发生,并保持其抗肿瘤活性[5]。国内已有文献报道[6,7]紫杉醇脂质体与传统紫杉醇相比,疗效相近,但药物毒性反应及不良反应明显减轻。
本组43例采用紫杉醇脂质体联合顺铂治疗晚期肺癌有效率37.2%,显示其优越性,且初治者较复治者有较好疗效。其主要毒副作用为骨髓抑制,以中性粒细胞减少为主,Ⅲ、Ⅳ级骨髓抑制,经粒细胞集落刺激因子皮下注射后很快恢复;虽然化疗前给予积极5-HT3受体拮抗剂等预处理,但仍有46.5%患者出现Ⅰ~Ⅱ级恶心、呕吐等消化道反应,所以在整个化疗期间应密切观察病情变化,及时对症处理;其他不良反应轻微,经对症处理后可耐受,无过敏反应发生,无治疗相关性死亡,与国内文献报道相似[8]。综合上述,紫杉醇脂质体拓宽了紫杉醇在晚期肺癌患者中的应用范围,联合顺铂治疗晚期肺癌具有疗效好、不良反应轻的优势,值得临床推广应用。
[1] 张 力.晚期非小细胞肺癌的二线治疗进展〔J〕.中国肺癌杂志,2008,11(1):4.
[2] 江 滨,陈书长.抗肿瘤药物临床应用指南〔M〕.北京:中国协和医科大学出版社,2005:679.
[3] Kim YH,Kjm J S,Choi YH,et al.Phase II study ofdocetaxel and cisplatin combination chemotherapy inmetastatie orunre-sectable loealized non-small-cell lung cancer〔J〕.Int J Clin Oncol,2002,7(2):117.
[4] KlauberN,Paeangi S,Flynn E,et al.Inhibition of angiogenesis and breast cancer in mice by the microtubule inhibitors 2-me-thoxyestradiol and Taxal〔J〕.Cancer Res,1997,57(1):81.
[5] 郭仁宏,王金万.紫杉醇脂质体的研究进展〔J〕.中国肿瘤,2008,17(8):698.
[6] 贾晋伟,吴亚梅,郭述良,等.紫杉醇脂质体与传统紫杉醇联合顺铂治疗老年非小细胞肺癌对比研究〔J〕.第四军医大学学报,2008,29(17):1604.
[7] 王佳蕾,洪小南,印季良,等.紫杉醇脂质体与紫杉醇治疗非小细胞肺癌64例和乳腺癌62例的疗效〔J〕.中国新药与临床杂志,2006,25(1):1.
[8] 孔繁宏,董庆芬,曹晓刚,等.紫杉醇脂质体联合顺铂治疗晚期非小细胞肺癌的临床观察〔J〕.实用癌症杂志,2007,22(5):513.

