117Snm(188Re、153Sm)-EDTMP的制备及在小鼠体内的生物分布比较
何佳恒,蒋树斌,杨玉青,王关全
中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900
骨无机相主要成分为磷酸配合物-羟基磷灰石,前期研究表明,磷(膦)类配体(配合物)对其有较强的趋附性[1-5]。20世纪80年代,人们合成了EDTA的膦酸衍生物乙二胺四甲基膦酸(EDTMP),并制备了153Sm-EDTMP[6]。90年代罗顺忠等[6-7]在对153Sm-EDTMP的研究中发现该配合物有很高的亲骨性并能高度聚集在骨损伤部位。邓候富等[7]用153Sm-EDTMP成功治疗了多例转移性骨肿瘤患者。几种用于骨肿瘤核素的物理性质列入表1。镧系元素153Sm有比较优良的核性质:半衰期为46.3 h,β射线能量适合治疗(0.805 MeV(21%)、0.702 MeV(46%)、0.632 MeV(33%)),可杀死癌细胞,主要的γ射线能量适中(0.103 MeV(28.2%)),适宜于γ照相机和SPECT显像。从20世纪80年代开始,186Re和188Re就引起了人们的极大兴趣,目前研究较多的是186Re-HEDP[8-9]。现在,以膦酸配体为基础,人们正研究一系列186,188Re-膦酸配体配合物作潜在的骨肿瘤治疗药物,但研究距临床尚有一定的距离。117Snm有最低能量的电子但仍能穿透大约30个细胞直径,这对于产生疗效而又不伤及红骨髓已经足够。为了突破骨髓抑制效应,同时保持或提高骨病灶浓集比例,人们将关注热点在近十年内转向了117Snm及其标记化合物[10-14],一系列含此核素的化合物被研究。
鉴于配体EDTMP良好的骨趋附性,本工作拟选用上述2种性质优良的亲骨核素188Re、117Snm[8,10,15]对EDTMP进行标记,比较3种配合物117Snm(188Re、153Sm)-EDTMP在小鼠体内的分布,评价188Re(117Snm)-EDTMP作为骨肿瘤治疗药物的可能性。其中117Snm-EDTMP属国内外首次研究,未见文献报道。

表1 几种用于骨肿瘤核素的物理性质Table 1 Physical characteristics of radio nuclides used for palliation of bone tumor
1 实验部分
1.1 主要试剂及仪器
117Snm(188Re、153Sm),中国工程物理研究院核物理与化学研究所提供;其余化学试剂均为国产分析纯或化学纯;实验所需用水均为二次蒸馏水。
FJ-2021型γ放射免疫计数器,国营二六二厂;红外光谱仪、元素分析仪、熔点测定仪由中国科学院成都有机研究所提供;CAPINTEC CRC-15R放射性活度测量仪,美国丹佛仪器公司;Helix Apex双探头SPECT仪,以色列Elscint公司。
昆明种小白鼠,一级,体重(18±2) g,雌雄各半,均由四川大学华西医学中心动物实验中心提供。
1.2 实验方法
1.2.1EDTMP的制备 在三颈瓶中加入乙二胺、亚磷酸、浓盐酸,在回流搅拌下,水浴加热至95 ℃左右,经恒压进样器缓慢滴加36%甲醛水溶液,体系经如下Mannich反应[16]制得EDTMP:

产品经红外、元素分析表征。
1.2.2153Sm-EDTMP的制备 采用文献[17]报道的直接标记法。在反应器中,加入一定量的EDTMP和153SmCl3,调节体系pH,使反应在一定的温度环境(室温或沸水浴)下进行。

1.2.4117Snm-EDTMP的制备 采用文献[3-4]报道的方法制备。将EDTMP溶于水,调节pH值至7左右,然后加入117Snm(Ⅱ),加入配体和117Snm(Ⅱ)的摩尔比为10∶1。充分反应后,加入H2O2(n(H2O2)∶n(117Snm(Ⅱ))=10∶1),待其完全氧化后,加热以赶走多余的H2O2。
1.2.5117Snm(188Re、153Sm)-EDTMP的稳定性及亲脂性
(1) 标记化合物的稳定性
将制备好的配合物分别置于室温(约25 ℃)、37 ℃,用纸层析法检测放化纯度随时间的变化。
(2) 标记化合物的亲脂性
采用文献[20]中水/正辛醇法测定各配合物的脂水分配系数。将标记配合物用生理盐水缓冲液(pH=7)稀释至3 mL,再加入3 mL正辛醇,振荡离心后,取2 mL下层的水相至测量管中放置测量计数。在有机相中再加入3 mL生理盐水振荡离心,弃去水相,如此反复不少于5次,最后取2 mL有机相测量计数。分配系数Kow=co/ca=No/Na。其中,co为配合物在正辛醇相中的浓度;ca为配合物在水相的浓度;No为正辛醇相中放射性总计数;Na为水相中放射性总计数。
1.2.6动物实验 对于每种配合物,分别取75只小白鼠,随机分成3组,每组再随机分成5批,每批5只。每组通过尾静脉注射0.1 mL相同剂量的标记物(18.5 kBq)。于不同时间将小鼠断头处死,取感兴趣脏器称量,测其放射性,计算每克组织摄入放射性占总注入剂量的百分比(%ID/g)。
2 结果和讨论
2.1 EDTMP的表征
EDTMP的熔点分析结果为201.3 ℃。
元素分析结果如下:N,5.92%;C,15.31%;H,4.71%;P,25.81%。计算值:N,6.17%;C,15.86%;H,4.83%;P,27.31%。图1是采用Gaussian优化的EDTMP结构。
EDTMP的红外光谱示于图2。

图1 经过Gaussian优化的EDTMP结构Fig.1 Optimized structure by Gaussian program

图2 EDTMP的红外光谱图Fig.2 IR spectrum of EDTMP
2.2 配合物的制备
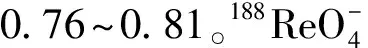
在生理盐水中,水解Sn在原点,四价Sn配合物在前沿(Rf为0.8~0.95);在丙酮中,水解Sn和四价配合物都在原点。
在153Sm-EDTMP的合成中,弱碱性介质有利于配合物的生成,但碱性过高会造成Sm3+的水解而使配合物不稳定,要达到98%的标记率,pH≥5即可,考虑动物实验的需要,选择pH=8~9。标记选择在沸水浴中进行。在选择配体量时发现,在pH≈8时,如果配体量较少,标记率会随配体量的增加而上升,当标记率已较高(大于96%)时,配体的增加几乎不会提高配合产率。

EDTMP与117Snm(Ⅳ)的标记条件温和,在常温下反应15 min即可获得标记率大于95%的配合物。配体量和酸度对溶液的外观影响很大,为了避免Sn的水解,需要配体与117Snm的摩尔比大于10,待充分反应后缓慢调节溶液的酸度至7左右。否则配体量不足容易导致多余的Sn水解。调节溶液的酸度要尽量避免将溶液的酸度调到碱性,需要缓慢从酸性调节到7左右备用。因为在碱性条件下,Sn的配合物也很容易水解,并且随着碱性增大,配合物的水解程度加剧。水解形成的微小胶状物(117SnmO2·xH2O·yEDTMP(x≥0,y≥0))很容易滞留在动物的肝部,对非靶组织造成不必要的损伤,使靶向组织的疗效受到影响。
2.3 配合物的稳定性和亲脂性
153Sm-EDTMP的稳定性结果表明,在pH=4时,放化纯在7 d时略有下降,但仍不低于96%;而在pH=7和9时,即使放置了7 d放化纯也在98%左右,说明153Sm-EDTMP在较宽的pH范围内有很高的体外稳定性;可适当增加配体用量来提高标记物的稳定性;配合物在37 ℃的恒温水浴中放置7 d后测得其放化纯仍大于95%。
将117Snm-EDTMP在室温下放置5 d后放化纯仍高于95%;将标记率大于95%的标记物放置在37 ℃的恒温水浴槽中,8 h后测其放化纯仍大于95%。
188Re-EDTMP在室温下放置5 d后放化纯由95%降到93.2%;放置在37 ℃的恒温水浴槽中,8 h后测得其放化纯保持在90%左右。
以上结果显示,3种配合物较好的体外稳定性为进一步的生物性质研究提供了保证。
配合物153Sm-EDTMP、117Snm-EDTMP和188Re-EDTMP的Kow分别为2.6×10-3、1.3×10-3和1.8×10-3,表明三者都是亲水性的,利于它们在骨骼上的吸附。
2.4 117Snm(153Sm、188Re)-EDTMP
153Sm-EDTMP、117Snm-EDTMP、188Re-EDTMP的小鼠体内分布分别列于表2—表4。经过比较,可以看出,153Sm-EDTMP在骨骼上的摄取极高,在其它组织中的摄取趋于本底;117Snm-EDTMP的小鼠体内分布与153Sm-EDTMP趋势比较一致,在靶向组织(脑骨和四肢骨)上的浓集率较高,但在肝脏上有一定的浓集,可能是由于有部分胶体形成。
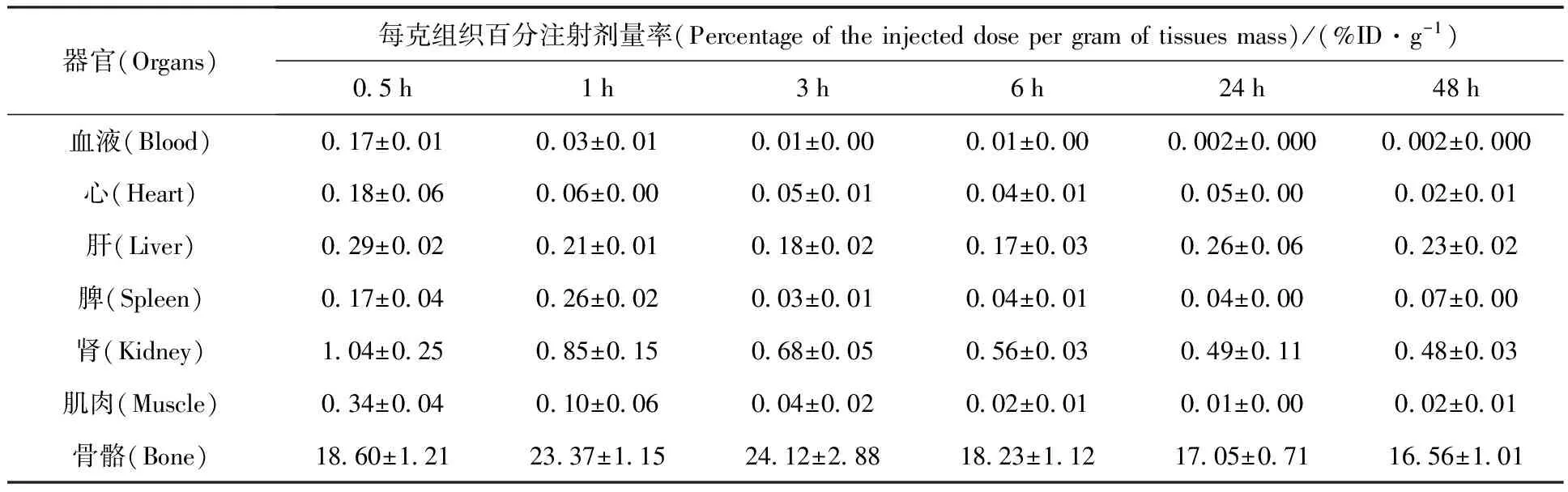
表2 153Sm -EDTMP在小鼠体内分布Table 2 Biodistribution of 153Sm -EDTMP in normal mice
注(Note):n=5

表3 117Snm-EDTMP在小鼠体内分布Table 3 Biodistribution of 117Snm-EDTMP in mice
注(Note):n=5

表4 188Re-EDTMP在小鼠体内分布Table 4 Biodistribution of 188Re-EDTMP in mice
注(Note):n=5
188Re-EDTMP在小鼠体内骨摄取率在0.5 h就达到最高值(12.50±0.91)%ID/g,而后下降较快,在48 h时仅为7.13%ID/g,说明188Re-EDTMP的体内稳定性较差,容易被洗脱;血清除较快,6 h时血液残余为(0.42±0.14)%ID/g,48 h残余为(0.05±0.01)%ID/g;药物主要通过肾排泄,但药物在肾的摄取仍不是很高,24 h时为(0.71±0.31)%ID/g,为骨摄取的8.93%。
表5列出了几类配合物在进入小鼠体内不同时相下在骨上的摄取率数据。从表5可以看出,本工作研究的117Sn(Ⅳ)-EDTMP在靶组织(骨)上的摄取率在相同时相上虽然不及目前临床应用的153Sm-EDTMP,但平均水平均高于国外正在进行临床研究的117Sn(Ⅳ)-DTPA,表现出潜在研究的价值。当然,为了减少实验误差,117Sn(Ⅳ)-DTPA的数据也是通过本次实验与117Sn(Ⅳ)-EDTMP在相同实验条件下获得的,其在小鼠体内的分布趋势与文献[21]报道一致。

表5 骨上的浓集率Table 5 Bone uptake in mice of various compounds
注(Note):n=5
3 结 论
本工作通过合成得到配体EDTMP,制备出标记率较高的117Snm(188Re、153Sm)配合物。3种配合物的体外稳定性均较好,属于亲水性配合物。小鼠体内分布结果表明,3种配合物均主要被骨摄取,但是188Re-EDTMP的体内稳定性较差,容易被洗脱;117Snm-EDTMP的小鼠体内分布与153Sm-EDTMP趋势比较一致,在靶组织(脑骨和四肢骨)上的浓集率较高,表现出可用于骨肿瘤治疗的可能性,值得进一步研究,但需要解决胶体形成问题。
[1] John W T, Leonard I W, Antoine A V. High Specific Activity [Samarium-153] EDTA for Imaging of Experimental Tumor Models[J]. J Nucl Med, 1989(30): 202.
[2] 何佳恒,陈雅宏,肖沣峰,等.酶解沉积放射性肿瘤药物前体的合成研究[J].化学研究与应用,2007, 19(8):886-888.
[3] 何佳恒,王关全,蒋述斌,等.117mSn-TTHMP的制备及生物性质研究[J].化学研究与应用,2006,18(10):1 162-1 166.
[4] 何佳恒,罗顺忠,杨玉青,等.117Snm标记HEDTMP的研究[J].核化学与放射化学,2002,24(4):236-239.
[5] HE Jiaheng, LUO Shunzhong, JIANG Shubin,et al. Preparation and Properties of117mSn(Ⅳ)-TTHMP ininVitroand in Small Animals[J]. NST, 2007, 6: 1-5.
[6] 罗顺忠,蒲满飞,李玉谦,等.骨肿瘤治疗药物的研究.153Sm-EDTMP的生物性质评价[J].核化学与放射化学,1991,(13):233-237.
[7] 邓候富,谭天序,匡安仁,等.新的骨显像及骨肿瘤治疗剂153Sm-EDTMP的初步应用[J].中华核医学杂志,1992,(12):27-30.
[8] Oh S J, Won K S, Moon D H, et al. Preparation and Biological Evaluation of188Re-Ethylenediamine-N,N,N′,N′-Tetrakis(Methylene Phosphonic Acid) as a Potential Agent for Bone Pain Palliation[J]. Nucl Med Commun, 2002, 23(1): 75-81.
[9] Chakraborty S, Das T, Uuui P R, et al.177Lu Labelled Polyaminophosphonates as Potential Agents for Bone Pain Palliation[J]. Nucl Med Commun, 2002, 23(1): 67-74.
[10] Zeevaart J R, Jarvis N V, Louw W K A, et al. Metal-Ion Speciation in Blood Plasma Incorporating the Tetraphosphonate:N,N-Dimethyl Enephonate-1-Hydroxy-4-Amin-Opropily-Denediphos-Phonate (APDDMP) in Therapeutic Radiopharmaceuticals[J]. J Inorg Biochem, 2001, 83(1): 57-65.
[11] Krishinamurthy G T, Swailem F M, Walsh T K. Pharmaco-Kinetics of Sn-117m(4+) DTPA in Patients With Multiple Metastatic Bone Pain[J]. Nucl Med, 1995, 117: 30-36.
[12] Karelin Y A, Efimov V N, Filimonov V T, et al. Radionuclide Production Using a Fast Flux Reactor[J]. Appl Radiat Isot, 2000, 53: 825-827.
[13] Qaims M, Dohler H. Production of Carrier-Free117Snm[J]. J Appl Radiat, Int Isot, 1984, 35(7): 645-648.
[14] Zeevaare J R, Louw W K A, Kolar Z I, et al. A Thermodynamic Approach, Using Speciation Studies, Towards the Evaluation and Design of Bone-Seeking Radiopharmaceuticals Asillustrated for117Snm(Ⅱ)-PEI-MP[J]. J Radioanal Nucl Chem, 2003, 257(1): 83-89.
[15] 何佳恒,李首建.117Snm在肿瘤治疗中的应用[J].化学研究与应用,2007,19(6):583-588.
[16] 印永嘉,顾月姝,陈德昌,等.大学化学手册[M]. 山东:科学技术出版社,1985:2-7.
[17] LUO Shongzhong, PU Manfei, QIAO Jian, et al. Preparation of Bone Tumor Therapeutic Radiopharmac-Euticals153Sm-EDTMP[J]. J Radio Nucl Chem, 1992, 160 (2): 443-448.
[18] Kazuyuki Hashimoto. Synthesis of a188Re-HEDP Complex Using Carrier-Free188Re, and a Study of Its Stability [J]. Appl Radiat Isot, 1998, 49(4): 351-356.
[19] Arteaga M C, Ferro F G, Pedraza L M, et al. Labelling of Re-ABP With188Re for Bone Pain Palliation [J]. Appl Radiat Isot, 2001, 54(3): 435-442.
[20] 王连生,韩朔睽.分子结构、性质与活性[M].北京:化学工业出版社,1997: 8-15.
[21] Swailem F M, Krishinamurthy G T, Srivastava S C, et al.InVivoTissue Uptake and Retention of Sn-117m(4+) DTPA in Human Subject With Metastatic Bone Pain and in Normal Mice[J]. Nucl Med Bilo, 1998, 25: 279-287.

