125I/111In标记的抗EGFR单克隆抗体Panitumumab的制备及其在正常鼠体内的生物分布
刘 妍,靳存敬,杨素娟,贾 兵,王 凡,刘昭飞,2,*
1.北京大学 医学同位素研究中心,北京 100191 2.北京大学 基础医学院 放射医学教研室,北京 100191
EGFR(表皮生长因子受体,epidermal growth factor receptor)是具有配体依赖性和酪氨酸激酶活性的跨膜糖蛋白家族,它在多种人类肿瘤中均呈现高表达,如结直肠癌、乳腺癌和非小细胞肺癌等。EGFR对于调节肿瘤细胞的生长、生存、修复、新生血管生成、侵袭和转移等具有重要的作用[1-2],因此它成为目前肿瘤分子靶向治疗的重要靶点。近些年来,人们一直致力于寻找能抑制EGFR表达或阻断EGFR信号传导的抗癌疗法,而开发可拮抗EGFR胞外配体结合区的单克隆抗体成为这其中的一个热点。这种靶向疗法降低了传统的细胞毒疗法对正常组织的毒性,并且靶向治疗与传统疗法联合使用可能产生协同作用[3]。另外,目前用不同放射性核素标记的靶向EGFR抗体已经受到广泛关注,并用于肿瘤的SPECT和PET显像以及肿瘤治疗的研究[4-6]。
Panitumumab(ABX-EGF)是第一个EGFR靶向的完全人源化单克隆抗体(IgG2亚型),由Abgenix和Amgen公司采用XenoMouseTM技术从一组该类抗体中筛选获得。Panitumumab与EGFR具有高亲和性,与EGFR结合从而阻止其配体EGF和TGF-α(transforming growth factor-α,转化生长因子α)等与EGFR的结合,进而阻止下游信号的激活。2006年9月,Panitumumab被FDA批准,用于治疗常规化疗后转移的结直肠癌患者[7-8]。Niu等[9]首先用64Cu标记Panitumumab用于高表达EGFR的肿瘤模型的PET显像,而其它核素标记的Panitumumab国内外尚无文献报道。在本研究中,采用125I和111In分别标记Panitumumab,在体外测定标记物的免疫活性,并对其在正常鼠体内的生物分布进行比较,其目的是评价不同的放射性核素标记对抗体体内外性质的影响。
1 实验材料
1.1 主要试剂
111InCl3溶液和Na125I溶液(无载体),美国Perkin Elmer公司;完全人源化抗表皮生长因子受体(EGFR)单克隆抗体Panitumumab(Vectibix,帕尼单抗),美国斯坦福大学陈小元教授惠赠;快速薄层层析-硅胶纸(ITLC-SG),美国Gelman公司;PD-10脱盐柱(Sephadex G-25),美国GE公司;Iodogen (1,3,4,6-四氯3,6 -二苯-甘脲),美国Sigma公司;双功能偶联剂DOTA,购自美国Macrocyclics公司;1-Ethyl-3-[3-(dimethylamino)-propyl]carbodiimide(EDC)及N-hydro-xysulfonosuccinimide(SNHS),购自美国Sigma公司;DMEM(dulbecco’s modified eagle medium)培养基和胰蛋白酶,美国GIBCO/BRL公司;胎牛血清,美国Hyclone公司;Tween-20,美国Sigma公司;其它常规化学试剂均为分析纯,北京试剂公司产品。
所用缓冲液、枪头、反应管等均经去离子处理,所有实验用水为去离子水(18.2 MΩ)。
1.2 仪器
CRC-15R放射性活度计,美国Capintec公司;1470-002全自动γ计数仪,美国Perkin Elmer公司;AR-2000放射性薄层扫描仪,美国Bioscan公司。
1.3 实验动物
BALB/c小白鼠,4~5周龄,雌性,约20 g,由北京大学医学部实验动物中心提供。
2 实验方法
2.1 DOTA偶联Panitumumab
采用我们前期报道的方法将双功能偶联剂DOTA活化[10]。简言之,DOTA(100 μL,溶于0.1 mol/L NaOH)与EDC(100 μL,溶于H2O)和SNHS(100 μL,溶于H2O)按照n(DOTA)∶n(EDC)∶n(SNHS)=10∶5∶4的摩尔比混合,置4 ℃反应30 min。将活化好的DOTA(DOTA-OSSu)与抗EGFR单克隆抗体Panitumumab以1∶200的摩尔比混合,在0.1 mol/L NaHCO3溶液(pH=9.0)中4 ℃振荡反应过夜后,反应混合液用PD-10脱盐柱纯化。根据DOTA-Panitumumab及已知浓度的Panitumumab在280 nm波长处的吸光度值计算DOTA-Panitumumab的浓度。
2.2 Panitumumab及DOTA-Panitumumab的125I标记
将15 μL Panitumumab(300 μg)和30 μL DOTA-Panitumumab(300 μg)分别加至2个涂有50 μg Iodogen的小瓶中,再分别加入135 μL和120 μL的磷酸缓冲液(0.2 mol/L,pH=7.4),然后分别向瓶中加入12 μL Na125I溶液(约25.6 MBq),混合均匀室温反应5 min后,吸出反应液以终止反应。反应混合物分别经PD-10脱盐柱纯化(以PBS为流动相)后备用。
2.3 111In-DOTA-Panitumumab的制备
1.5 mL EP(Eppendorf)管中分别加入50 μL的0.2 mol/L醋酸钠缓冲液(pH=5.5)、200 μg DOTA-Panitumumab(20 μL)以及20 μL111InCl3(约111 MBq)。37 ℃振荡反应1 h后,用PD-10柱纯化产物111In-DOTA-Panitumumab,以PBS为流动相。
2.4 质控方法
质控采用快速薄层层析法(ITLC)。取1 μL标记产物点样于ITLC-SG板(10 mm×100 mm),125I标记物在85%甲醇的展开体系中上行展开,111In标记物在10 mmol/L EDTA的展开体系中展开,自然晾干后用放射性薄层扫描仪测量并计算标记率或放射化学纯度。
2.5 111In-DOTA-Panitumumab和125I-Panitumumab的体外稳定性
取100 μL纯化后的111In-DOTA-Panitumumab和125I-Panitumumab分别置于生理盐水(NS)和胎牛血清(FBS)溶液中,37 ℃振荡孵育。用ITLC监测不同时间点的放射化学纯度,以评价标记物的体外稳定性。
2.6 细胞培养
UM-SCC-22B人头颈癌细胞购自美国ATCC,培养于φ=10%胎牛血清(FBS)的DMEM培养基中。细胞置于饱和湿度、37 ℃含5% CO2的恒温培养箱中培养。UM-SCC-22B细胞高表达表皮生长因子受体(EGFR)[11]。
2.7 111In-DOTA-Panitumumab和125I-Panitumumab的放射免疫活性测定
取6个EP管分为总结合组和非特异性结合组,每组3个平行样。每管均加入500 μL细胞悬液(约106个细胞)和100 μL111In-DOTA-Panitumumab(约167 Bq)稀释液。然后在总结合组中每管加入100 μL 1% BSA(溶于PBS);非特异性结合组中每管加入100 μL过量未标记Panitumumab(约100 μg,溶于1% BSA)溶液。反应管混合均匀后,置于4 ℃层析柜中轻轻振荡反应过夜。结束后取出试管,离心,并用PBS反复洗涤4~6次。离心后经γ计数器测定每管细胞结合的放射性计数率(min-1),计算放射免疫活性(细胞结合量/加入总量)。
125I-Panitumumab的放射免疫活性测定步骤同上。
2.8 正常鼠体内生物分布
将60只BALB/c小白鼠随机分成3组,每组20只。每组分别经尾静脉注射185 kBq(100 μL溶于生理盐水)125I-Panitumumab、DOTA-Panitumumab-125I及111In-DOTA-Panitumumab,并于注射后4 h、1 d、3 d、5 d和7 d按组(每组4只)将实验小鼠处死,取血及主要脏器,称重并用γ计数仪测量放射性计数,经衰变校正后计算每克组织的百分注射剂量率(Up,%ID/g)。
2.9 数据分析
使用Prism 4.0软件对实验数据进行分析,P≤0.05为有显著性差异。
3 结果和讨论
3.1 标记物的制备与质控
标记物的标记率和放化纯结果列于表1。Panitumumab及DOTA-Panitumumab均具有较高的111In和125I标记率,然而111In标记物的标记率(88%)明显低于125I标记物的标记率(94%),这可能是由于111In需要通过双功能螯合剂与抗体偶联,所以它比125I更难标记到抗体上。经PD-10脱盐柱纯化后,111In和125I标记的Panitumumab均具有高的放射化学纯度(>98%)。
3.2 111In-DOTA-Panitumumab和125I-Panitumumab的体外稳定性结果
通过对111In-DOTA-Panitumumab和125I-Panitumumab在生理盐水(NS)和胎牛血清(FBS)中的放射化学纯度监测(图1)显示,2种标记物在体外均有很好的稳定性,72 h时,在2种介质中的放化纯均大于90%。
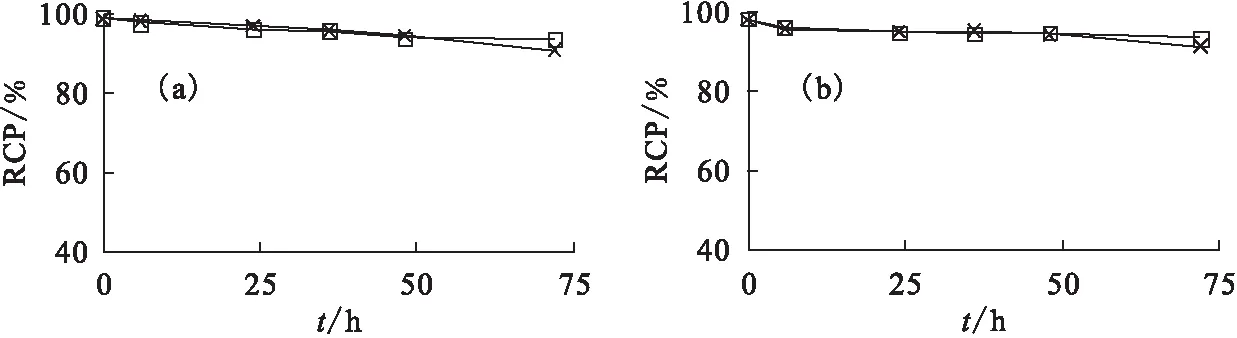
图1 125I-Panitumumab(a)和111In-DOTA-Panitumumab(b)在生理盐水(NS)和胎牛血清(FBS)中的稳定性Fig.1 In vitro stability of 125I-Panitumumab(a) and 111In-DOTA-Panitumumab(b)in saline (NS) and fatal bovine serum (FBS)×——NS,□——FBS
3.3 111In-DOTA-Panitumumab和125I-Panitumumab的放射免疫活性分数测定结果
111In-DOTA-Panitumumab和125I-Panitumumab的放射免疫活性分数分别为(58.32±4.84)%和(81.66±3.15)%(图2),说明2种标记物均保持了良好的免疫活性。111In-DOTA-Panitumumab的放射免疫活性低于125I-Panitumumab,这可能是由于双功能螯合剂与抗体偶联过程对抗体活性有一定的影响。
3.4 125I-Panitumumab、DOTA-Panitumumab-125I和111In-DOTA-Panitumumab在正常鼠内的生物分布
表2—4分别列出了125I-Panitumumab、DOTA-Panitumumab-125I和111In-DOTA-Panitumumab在BALB/c小白鼠体内的分布数据,图3比较了这3种标记物在主要脏器及血液中的清除情况。
根据生物分布数据,在注射后4 h,3种标记物111In-DOTA-Panitumumab、125I-Panitumumab和DOTA-Panitumumab-125I在血液中的放射性摄取分别为(46.65±3.96)、(39.08±1.16)、(36.77±3.03)%ID/g,随着时间的延长,3种标记物在血液中迅速清除,到注射后168 h,它们在血液中的放射性摄取分别降至(3.63±2.64)、(14.16±1.00)、(1.69±0.13)%ID/g。3种标记物在肾脏中的放射性摄取较低,在肝脏和脾脏中的放射性摄取较高,说明标记物主要是通过肝脏代谢的。3种标记物在肝脏和脾脏中的放射性摄取差异最大(图2)。111In-DOTA-Panitumumab在实验过程中所有时间点的肝脏摄取都显著高于DOTA-Panitumumab-125I和125I-Panitumumab(P<0.000 1)。这可能是由于3种标记物的代谢产物在体内分布性质的不同造成的。标记物经肝脏代谢时,会进入肝细胞内的溶酶体,经过蛋白酶裂解后产生代谢产物[12],这些代谢产物要通过简单扩散或者氨基酸转运子离开溶酶体腔。根据Duncan等[13]推测,111In-DOTA-Panitumumab的代谢终产物大部分为111In-DOTA-lysine(赖氨酸),由于溶酶体中不存在转运它的转运子,所以它难以离开肝细胞,从而造成了放射性在肝细胞中的滞留。而125I标记物的代谢产物在细胞质中易发生脱碘作用,游离碘很容易从细胞内溢出[14]。在注射后4 h,125I-Panitumumab在肝脏中的摄取为(6.24±0.77)%ID/g,也显著低于DOTA-Panitumumab-125I((10.99±1.34)%ID/g,t=6.136,P=0.000 9),说明了DOTA的连接本身也会增加肝脏的摄取。这可能是由于DOTA-Panitumumab的代谢产物具有阴离子性质,在pH=5.0的溶酶体中难以进行简单扩散,所以连有DOTA的标记物在肝脏中更容易累积。另外,从生物分布数据中还可以看出,3种标记物在肺中的摄取也较高,这可能是由于EGFR在正常的肺组织中也有少量的表达[15]。

图2 125I-Panitumumab(a)和111In-DOTA-Panitumumab(b)的放射免疫活性分数Fig.2 Radioimmunoreactive fractions of 125I-Panitumumab (a) and 111In-DOTA-Panitumumab (b)

组织(Tissues)Up/(%ID·g-1)4h1d3d5d7d血(Blood)39 08±1 1628 26±1 7022 14±2 2415 41±1 5314 16±1 00肝(Liver)6 25±0 774 04±0 533 12±0 671 94±0 262 29±0 58脾(Spleen)4 64±0 383 15±0 382 40±0 411 92±0 211 69±0 28肾(Kidney)8 46±0 305 69±0 173 31±0 742 96±0 313 04±0 15胃(Stomach)3 84±0 483 34±0 393 03±0 692 32±0 171 88±0 09肠(Intestines)7 11±1 075 40±0 575 47±0 743 77±0 613 22±0 33心(Heart)7 50±0 125 04±0 593 90±0 802 62±0 302 36±0 27肺(Lung)13 14±2 828 78±1 567 01±1 005 23±0 585 13±0 55肌肉(Muscle)1 70±0 282 52±0 362 09±0 401 40±0 151 17±0 14骨(Bone)3 43±0 892 28±0 591 65±0 271 16±0 200 92±0 11
注(Note):n=4

表3 DOTA-Panitumumab-125I的正常鼠生物分布Table 3 Biodistribution of DOTA-Panitumumab-125I in normal mice
注(Note):n=4

表4 111In-DOTA-Panitumumab的正常鼠生物分布Table 4 Biodistribution of 111In-DOTA-Panitumumab in normal mice
注(Note):n=4

图3 3种标记物在血液(a)、肝脏(b)、肾脏(c)和脾脏(d)中的清除情况比较Fig.3 Comparison of blood (a), liver (b), kidney (c), and spleen (d) clearance of three tracers□——125I-Panitumumab,▲——DOTA-Panitumumab-125I,×——111In-DOTA-Panitumumab
以上实验结果显示,125I标记简单,对标记物活性影响小,但125I标记物在体内容易脱碘,所以不能准确地反映出标记物在体内分布的情况。虽然111In标记对抗体活性影响比125I大,但仍然保持较好的免疫活性,并且111In标记物在体内性质稳定,更能体现出抗体在体内的分布情况。然而,111In标记物的最大缺点是在肝脏中摄取较高,滞留时间较长。因此在应用111In作为显像核素时,如何降低标记物在肝脏中的摄取还有待研究。
4 结 论
本研究中,Panitumumab的125I和111In标记均具有较高的标记率,经PD-10纯化后放化纯均高于98%。125I和111In标记的Panitumumab均具有较高的体外免疫活性,且125I-Panitumumab具有比111In-DOTA-Panitumumab更高的放射免疫活性分数。生物分布实验数据显示,在实验中所有的时间点,111In-DOTA-Panitumumab在肝脏和脾脏中的摄取均显著高于125I标记物,说明不同核素标记对生物分子的体内外性质具有一定的影响。虽然相对于易在体内脱碘的125I标记抗体,111In标记物在体内较为稳定,但是如何降低111In标记物在肝脏中的摄取还有待研究。
[1] Ciardiello F, Tortora G. A Novel Approach in the Treatment of Cancer: Targeting the Epidermal Growth Factor Receptor[J]. Clin Cancer Res, 2001, 7(10): 2 958-2 970.
[2] 代 梅,郭建辉.靶向EGFR家族的抗肿瘤药物研究进展[J].生命科学,2009,21(3):412-417.
[3] Zhu Z. Targeted Cancer Therapies Based on Antibodies Directed Against Epidermal Growth Factor Receptor: Status and Perspectives[J]. Acta Pharmacol Sin, 2007, 28(9): 1 476-1 493.
[4] Ramos-Suzarte M, Rodriguez N, Oliva J P, et al.99mTc-Labeled Antihuman Epidermal Growth Factor Receptor Antibody in Patients With Tumors of Epithelial Origin: Part III. Clinical Trials Safety and Diagnostic Efficacy[J]. J Nucl Med, 1999, 40(5): 768-775.
[5] Schechter N R, Yang D J, Azhdarinia A, et al. Assessment of Epidermal Growth Factor Receptor With99mTc-Ethylenedicysteine-C225 Monoclonal Antibody[J]. Anticancer Drugs, 2003, 14(1): 49-56.
[6] Dadparvar S, Krishna L, Miyamoto C, et al. Indium-111-Labeled Anti-EGFR-425 Scintigraphy in the Detection of Malignant Gliomas[J]. Cancer, 1994, 73(3 Suppl): 884-889.
[7] Yang X D, Jia X C, Corvalan J R, et al. Development of ABX-EGF, a Fully Human Anti-EGF Receptor Monoclonal Antibody for Cancer Therapy[J]. Crit Rev Oncol Hematol, 2001, 38(1): 17-23.
[8] Cohenuram M, Saif M W. Panitumumab the First Fully Human Monoclonal Antibody: From the Bench to the Clinic[J]. Anticancer Drugs, 2007, 18(1): 7-15.
[9] Niu G, Li Z, Xie J, et al. PET of EGFR Antibody Distribution in Head and Neck Squamous Cell Carcinoma Models[J]. J Nucl Med, 2009, 50(7): 1 116-1 123.
[10] Liu Z, Li Z B, Cao Q, et al. Small-Animal PET of Tumors With64Cu-Labeled RGD-Bombesin Heterodimer[J]. J Nucl Med, 2009, 50(7): 1 168-1 177.
[11] Bier H, Hoffmann T, Haas I, et al. Anti-Epidermal Growth Factor Receptor Monoclonal Antibodies for the Induction of Antibody-Dependent Cell-Mediated Cytotoxicity Against Squamous Cell Carcinoma Lines of the Head and Neck[J]. Cancer Immunol Immunother, 1998, 46(3): 167-173.
[12] Bridges K, Harford J, Ashwell G, et al. Fate of Receptor and Ligand During Endocytosis of Asialoglycoproteins by Isolated Hepatocytes[J]. Proc Natl Acad Sci U S A, 1982, 79(2): 350-354.
[13] Duncan J R, Welch M J. Intracellular Metabolism of Indium-111-DTPA-Labeled Receptor Targeted Proteins[J]. J Nucl Med, 1993, 34(10): 1 728-1 738.
[14] Koehrle J, Auf'Mkolk M, Rokos H, et al. Rat Liver Iodothyronine Monodeiodinase. Evaluation of the Iodothyronine Ligand-Binding Site[J]. J Biol Chem, 1986, 261(25): 11 613-11 622.
[15] Dittadi R, Gion M, Pagan V, et al. Epidermal Growth Factor Receptor in Lung Malignancies. Comparison Between Cancer and Normal Tissue[J]. Br J Cancer, 1991, 64(4): 741-744.

