99Tcm标记的小干扰RNA探针的制备及稳定性评价
康 磊,王荣福,*,闫 平,刘 萌,张春丽,于明明,崔永刚,徐小洁
1.北京大学第一医院 核医学科,北京 100034;2.军事医学科学院 生物工程研究所,北京 100850
自从1998年Andrew Fire和Craig Mello首次证实了双链RNA分子可诱导同源靶向mRNA降解并导致基因沉默的RNA干扰(RNA interference, RNAi)机制后,RNAi技术已经成为基因功能研究和基因治疗研究等领域中最热门的技术之一。小干扰RNA(small interfering RNA,siRNA)作为RNAi过程中的关键因子,具有强大的基因靶向能力和沉默作用。但是siRNA应用于体内研究时却往往由于脱靶效应或者转运不良而丧失基因沉默效应,因此迫切需要一种针对siRNA分子的体内示踪技术、特别是体内显像技术的应用[1]。放射性核素示踪技术具有安全可靠、探测灵敏、分辨率高等优点,尤其在大体动物体内显像较光学成像方法具有很大优势。构建一种针对siRNA分子的放射性核素标记方法对于RNA分子体内示踪和RNA反义显像技术的发展具有重要意义,并且结合siRNA的基因沉默效应可与放射性治疗联合达到基因干扰与放射治疗的双重效果。
另一方面,RNAi技术的迅速发展为提高RNA分子体内稳定性提供了相关技术支持。一直以来RNA分子的不稳定性限制了其在反义核酸研究领域的应用。但是近年来一些化学修饰方式已被成功应用于提高RNA分子的稳定性,包括硫代修饰(phosphorothioate,PS)[2]和2’-甲氧基修饰(2’-O-methyl,2’-OMe)[3]。2’-OMe修饰不但可以提高RNA抵抗多种理化因素和体内多种酶的降解作用,而且还能增加RNA分子的体内转运能力。本工作采用全程2’-OMe化学修饰,选择人端粒酶逆转录酶(hTERT)mRNA为作用靶点的siRNA作为标记探针,拟通过偶联双功能螯合剂S-乙酰基-NHS-MAG3(N-hydroxysuccinimidyl derivative of S-Acetyl mercaptoacetyltriglycine)构建99Tcm标记的siRNA示踪探针,并对其体外标记和活性稳定性进行评价,以期将来应用于肿瘤反义显像和治疗研究。
1 实验材料
1.1 主要试剂
S-乙酰基-NHS-MAG3由Hnatowich教授(University of Massachusetts Medical School)提供;N-2-羟乙基哌嗪-N-2-乙磺酸(HEPES)、氯化亚锡(SnCl2·2H2O)、二甲基甲酰胺(N,N-dimethylformamide,DMF)均购于美国Sigma-Aldrich公司;酒石酸钠、乙酸铵、氢氧化铵等常规分析纯化学试剂均购于北京化学试剂公司;99Mo-99Tcm发生器,北京原子高科技术股份有限公司;Sephadex G25(细)购于美国GE Amersham公司;焦碳酸二乙酯(diethypyrocarbonate,DEPC)购于美国Amresco公司,所有试剂均由DEPC处理过的水配制;肝细胞肝癌肿瘤细胞系HepG2,ATCC来源;高糖DMEM(Dulbecco’s modified eagle medium)培养基、转染试剂Lipofectmine 2000、无血清培养基(Opti-MEM I Reduced Serum Medium)、10%胎牛血清、Trizol均购于美国Invitrogen公司;Turbo Script逆转录第一链cDNA合成试剂盒购于原平皓公司;DNA聚合酶购于美国CHIMERx公司;琼脂糖粉购于法国Biowest公司。
1.2 实验仪器
NanoDrop-1000紫外分光光度仪,美国Thermo Scientific公司;真空冻干机,美国Thermo Fisher公司;RM905放射性活度仪,中国计量科学研究院;AXIMA-CFRplus电离飞行质谱仪,英国Kratos Analytical公司;新华一号滤纸,北京化学试剂公司;电泳仪、水平电泳槽,北京六一仪器厂。
2 实验方法
2.1 siRNA的设计与合成
本研究中siRNA的干扰靶点选择hTERT mRNA的第14个外显子的第3119—3137位核苷酸(19 bp)[4]。反义链的5’端连接6碳己基及氨基伯胺结构,作为与MAG3偶联的基团,其3’端的2个脱氧胸腺核苷酸d(TT)结构用于提高反义结合活性。因此反义链序列为5’-NH2-(CH2)6-UCCAAACUUGCUGAUGAAAd(TT)-3’。正义链序列为5’-UUUCAUCAGCAAGUUUG-GAd(TT) -3’。siRNA双链均由上海GenePharma公司合成,全程2’-甲氧基修饰。合成后进行HPLC纯化及RNA变性胶分子量鉴定后以冻干形态保存于-80 ℃。
2.2 siRNA反义链与NHS-MAG3偶联反应
NHS-MAG3偶联构建99Tcm-siRNA探针的反应路线示于图1。
取适量冻干反义RNA溶于0.30 mol/L HEPES缓冲液(pH=8.0)中,质量浓度达到10 g/L。在震荡条件下,将无水DMF新鲜配制的NHS-MAG3溶液加入RNA溶液中,使MAG3/RNA 的最终摩尔比为15∶1,室温下静置反应1~2 h[5-6]。反应产物经醋酸铵溶液(0.25 mol/L,pH=7.2)洗脱Sephadex G25层析柱(0.7×28 cm)纯化后,按照每管0.5 mL依次收集30管。根据每管洗脱产物在260 nm波长处的吸光度值(A260),合并RNA峰管后将其真空冻干,保存于-80 ℃备用。
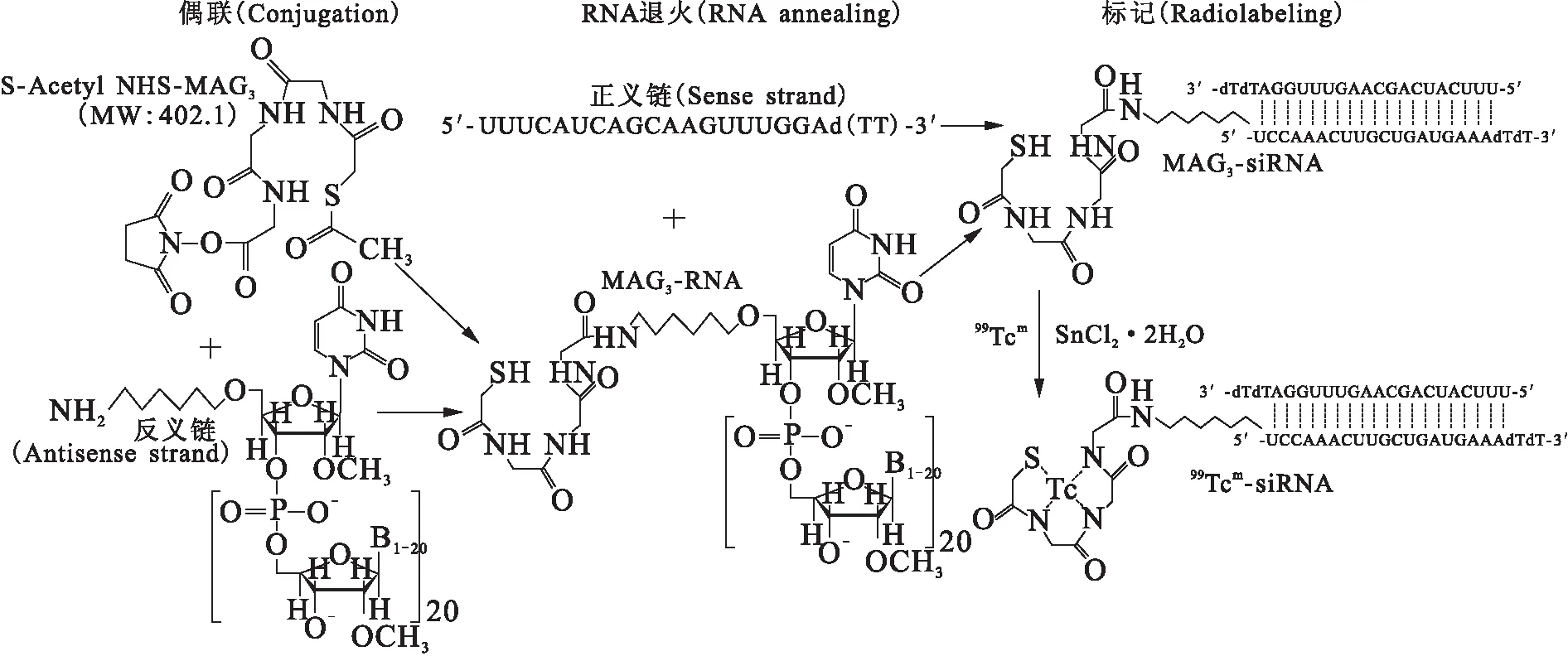
图1 通过S-乙酰基-NHS-MAG3偶联的99Tcm标记siRNA反应路线图Fig.1 Scheme of synthesis of 99Tcm radiolabeled siRNA via chelator of S-Acetyl-NHS-MAG3
2.3 MAG3-siRNA双链形成
取适量偶联与未偶联的RNA进行AXIMA-CFRplus 质谱分析,检测其分子量差以确认偶联产物的正确性,再将偶联后的反义链和正义链退火形成siRNA双链[7]。方法如下:取等量的RNA互补链分别溶于退火缓冲液(0.05 mol/L NaCl,10 mmol/L dithiothreitol,10 mmol/L MgCl2,10 mmol/L Tris-Cl,pH=7.5)中,使得质量浓度为1 g/L。将二者混匀后90 ℃加热1 min,再置于37 ℃水浴1 h退火形成双链。RNA退火产物以每管10 μg分装、冻干,保存于-80 ℃备用。
2.4 99Tcm标记反应

2.5 标记率和放射化学纯度的测定
采用新华一号试纸为固定相、丙酮和生理盐水为双展开剂的纸层析法测定标记产物的标记率和放射化学纯度。
2.6 标记稳定性分析
将标记产物99Tcm-siRNA分别溶于适量体积的生理盐水和新鲜人血清中,终浓度为0.01 g/L。分别置于室温和37 ℃条件下,孵育0.5、1、2、3、4、6 h后,分别取样纸层析法测定其放化纯度。
2.7 活性稳定性分析
HepG2细胞常规37 ℃、5% CO2条件下培养于含10%胎牛血清的高糖DMEM培养基中。待细胞密度达80%左右进行RNA转染操作,具体参照Lipofectmine 2000说明书。在分别转染脂质体、未标记的siRNA和99Tcm标记的siRNA后48 h收集细胞,Trizol法提取细胞总RNA。逆转录PCR扩增hTERT和GAPDH mRNA,具体扩增引物与条件参照文献[8]。扩增产物经1%琼脂糖凝胶电泳鉴定。
3 结果和讨论
3.1 siRNA反义链与NHS-MAG3的偶联反应
偶联产物经过Sephadex G25层析柱纯化后,使用紫外分光光度仪测定其吸光度值,结果示于图2。发现第7管—第9管和第19管—第21管产物在260 nm处有一定的吸收峰(图2(a))。但第7管—第9管产物仅在260 nm处测定有吸收峰,且峰值较高,提示该管中含有偶联产物MAG3-RNA(图2(b))。而第19管—第21管的吸收峰主要位于230 nm处,而260 nm处的吸收峰仅为230 nm峰的延续,提示主要为未偶联的游离MAG3离子峰(图2(c))。
将偶联后产物MAG3-RNA与偶联前RNA分别进行质谱分子量分析,结果示于图3。由图3可知,偶联前RNA相对分子质量为7 061.4(图3(a)),偶联后MAG3-RNA相对分子质量为7 307.1(图3(b)),偶联前后相对分子质量差为245.7。对照MAG3基团的理论相对分子量为245.23,可见螯合前后的相对分子质量差与理论相符,证实了RNA分子与NHS-MAG3成功偶联。NHS-MAG3作为一种双功能螯合剂,与RNA的5’或3’末端连接的胺基结合,去除保护巯基的乙酰基,通过转螯合作用与99Tcm螯合被标记。其优点是标记反应可以在室温和中性条件下进行[9],这种温和的反应条件对防止反应体系中的RNA分子降解起到重要作用,且该螯合剂具有标记率高、稳定性好、脱靶少的优势[10],有利于体内研究应用的99Tcm标记的RNA探针的构建。
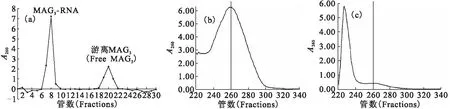
图2 偶联产物经Sephadex G25纯化后的紫外分光分析Fig.2 Absorbance analysis of purified products after conjugation (a)——各管在260 nm的吸光度值(Absorbance at 260 nm of all products),(b)——第8管的吸收峰(Absorbance at 260 nm of tube 8),(c)——第20管的吸收峰(Absorbance at 260 nm of tube 20)
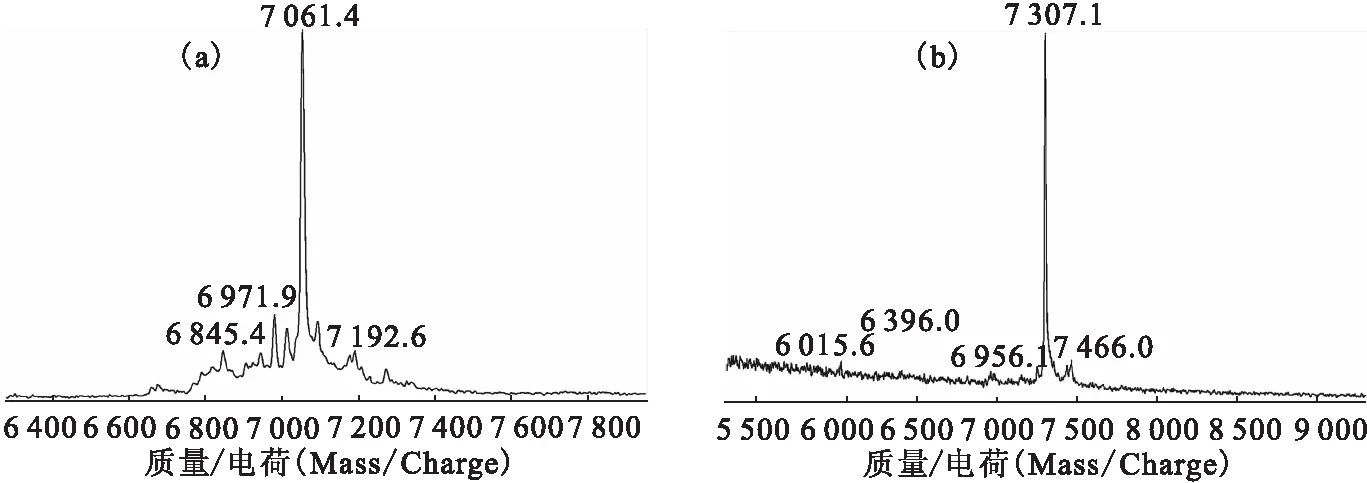
图3 偶联前(a)、后(b)RNA质谱分析Fig.3 MALDITOF-MS analysis of RNAs before (a) and after (b) conjugation
3.2 99Tcm标记结果

表1 使用丙酮和生理盐水双展开剂的纸层析检测结果Table 1 Paper chromatography with acetone and saline at the mobile phase
3.3 影响99Tcm-siRNA标记率的因素
3.3.1反应时间对标记率的影响 不同反应时间对标记率(Y)的影响示于图4。由图4可知,在使用1 g/L SnCl2·2H2O条件下,99Tcm-siRNA的标记率在反应1 h内随着反应时间的增加,标记率显著提高,由5 min时的38.4%增至1 h时的77.3%;而从1 h到5 h的反应时间内,随反应时间的延长标记率无显著提高,维持在78%左右。由此可见经过1 h的反应,RNA分子的99Tcm标记已达到饱和平台期。考虑到反应时间越长,RNA分子受到理化降解因素的危险就越大,因此本实验选择1 h作为最佳标记反应时间,既保证了高标记率,还降低了RNA降解的风险。
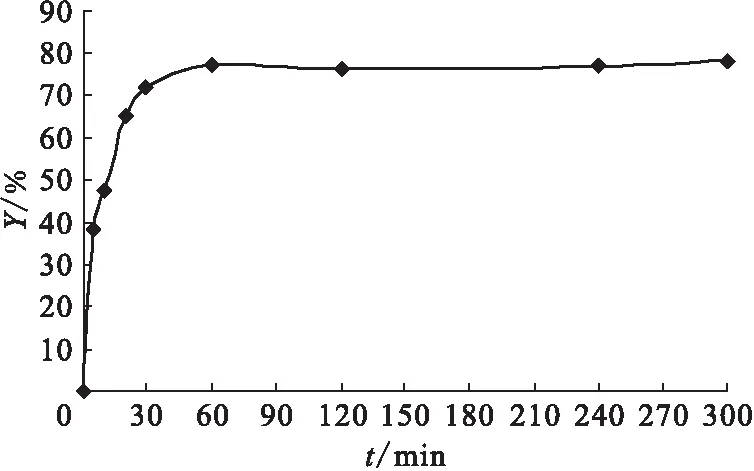
图4 不同反应时间对标记率的影响Fig.4 Effect on the labeling efficiency by different reaction time
3.3.2SnCl2·2H2O用量对标记率的影响 在标记反应中,SnCl2·2H2O主要还原高价99Tcm。siRNA分子通过偶联的MAG3与99Tcm核素形成螯合物而被标记,但是SnCl2·2H2O过多容易产生过多的锝胶体而降低标记率。本研究分别测定不同质量浓度的SnCl2·2H2O(1、2、4、8、10 g/L)在1 h反应时间中的标记率,以期优化反应条件,结果示于图5。由图5可知,反应标记率在SnCl2·2H2O质量浓度为1、2 g/L时均可达较高水平(77.3%和78.0%),而当SnCl2·2H2O使用量增大时,标记率迅速下降至67.7%,此结果和预期相符,亦和以往针对寡核苷酸的99Tcm标记SnCl2·2H2O使用量[12]一致。
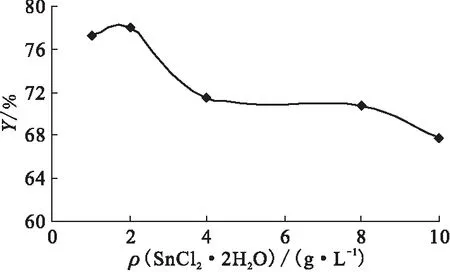
图5 SnCl2·2H2O的质量浓度对标记率的影响Fig.5 Effect on the labeling efficiency by different mass concentrations of SnCl2·2H2O
3.4 标记产物稳定性分析
图6显示99Tcm-siRNA探针在生理盐水和人新鲜血清2种介质中孵育6 h均能保持良好的稳定性,放化纯度(RCP)维持在94%以上。99Tcm-siRNA的放化纯稳定性在血清与生理盐水中、37 ℃和室温下均无显著性差异,说明经过2’-OMe化学修饰的RNA探针未受到血清中多种酶成分的影响而无降解发生,且标记探针在不同介质中均保持良好的标记稳定性,无脱标现象。本实验中37 ℃下血清介质在很大程度上模拟了体内环境,显示RNA标记探针在模拟体内环境中能保持良好稳定性,为将来体内实验研究奠定了基础。以上结果说明,2’-OMe修饰可在标记条件和模拟体内环境下保持RNA分子的稳定性,且通过MAG3螯合的99Tcm标记的产物能保持良好的标记稳定性,采用的化学修饰和标记方法适用于RNA探针。
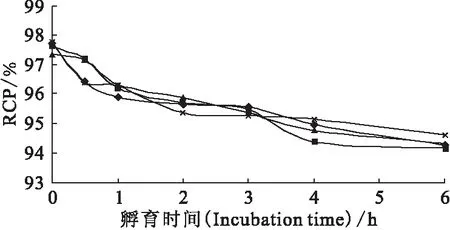
图6 99Tcm-siRNA探针的体外稳定性Fig.6 Stability of 99Tcm-siRNA in vitro生理盐水(Saline):▲——室温(RT),×——37 ℃;人新鲜血清(Serum):◆——室温(RT),■——37 ℃
3.5 活性稳定性分析
经过化学修饰及偶联标记的siRNA分子是否能够保持靶向识别能力和干扰活性是评价标记方法是否得当的重要标准。99Tcm-siRNA探针对hTERT靶向mRNA的干扰作用示于图7。本实验分别测定未转染的细胞、仅有脂质体转染的细胞、脂质体转染未偶联标记siRNA的细胞及脂质体转染偶联标记siRNA的细胞的hTERT基因mRNA水平。由图7可知,偶联标记后的siRNA与未偶联的siRNA分子具备相似的靶向基因干扰活性((79.2±1.5)%与(81.4±0.5)%))。这一结果证实所采用的MAG3偶联的99Tcm标记方法对siRNA分子的生物活性影响很小,保证了siRNA分子的靶向识别特异性和干扰活性。这种活性稳定性可能与MAG3基团的分子结构简单、分子量小因而对RNA分子功能区影响小有关。

图7 99Tcm-siRNA探针对hTERT靶向mRNA的干扰Fig.7 Inhibition activity on hTERT mRNA of 99Tcm-siRNA1——未转染细胞(Cells without transfection),2——脂质体转染的细胞(Cells transfected with liposome),3——脂质体转染未偶联标记siRNA的细胞(Cells transfected with liposome and unlabeled siRNA),4——脂质体转染偶联标记siRNA后的细胞(Cells transfected with liposome and labeled siRNA)
4 结 论
(1) 通过双功能螯合剂NHS-MAG3偶联的siRNA可被放射性同位素99Tcm标记,并获得较理想的标记率、稳定的放化纯和较高的比活度,此标记方法为RNA放射性核素标记研究提供了选择。
(2) 经过2’-甲氧基修饰的RNA分子在模拟体内环境中保持良好的标记稳定性,为RNA标记探针进一步在体内研究的应用奠定了基础。
(3) 通过螯合剂NHS-MAG3偶联的99Tcm标记方法能够保持RNA分子的生物活性稳定性,确保了标记RNA探针的靶向特异性,利于将来在体内显像示踪的应用。
[1] Medarova Z, Pham W, Farrar C, et al.InVivoImaging of siRNA Delivery and Silencing in Tumors[J]. Nat Med, 2007, 13(3): 372-377.
[2] Eckstein F. Phosphorothioate Oligodeoxynucleotides: What is Their Origin and What is Unique About Them?[J]. Antisense Nucleic Acid Drug Dev, 2000, 10(2): 117-121.
[3] Grünweller A, Wyszko E, Bieber B, et al. Comparison of Different Antisense Strategies in Mammalian Cells Using Locked Nucleic Acids, 2’-O-Methyl RNA, Phosphorothioates and Small Interfering RNA[J]. Nucleic Acids Res, 2003, 31(12): 3 185-3 193.
[4] Masutomi K, Yu E Y, Khurts S, et al. Telomerase Maintains Telomere Structure in Normal Human Cells[J]. Cell, 2003, 114(2): 241-253.
[5] Wang Y, Liu G, Hnatowich D J. Methods for MAG3Conjugation and99mTc Radiolabeling of Biomolecules[J]. Nat Protoc, 2006, 1(3): 1 477-1 480.
[6] Liu G, Zhang S, He J, et al. Improving the Label-ing of S-Acetyl NHS-MAG3Conjugated Morpholino Oligomers[J]. Bioconjug Chem, 2002, 13(4): 893-897.
[7] Vanitharani R, Chellappan P, Fauquet C M. Short Interfering RNA-Mediated Interference of Gene Expression and Viral DNA Accumulation in Cultured Plant Cells[J]. Proc Natl Acad Sci U S A, 2003, 100(16): 9 632-9 636.
[8] Nakamura T M, Morin G B, Chapman K B, et al. Telomerase Catalytic Subunit Homologs From Fission Yeast and Human[J]. Science, 1997, 277(5 328): 955-959.
[9] Hnatowich D J, Chang F, Lei K, et al. The Influence of Temperature and Alkaline pH on the Label-ing of Free and Conjugated MAG3With Techne-tium-99m [J]. Appl Radiat Isot, 1997, 48(5): 587-594.
[10] 刘 萌,王荣福.S-乙酰基-NHS-MAG3在反义显像研究中的应用及进展[J].同位素,2004,17(3):164-168.
[11] Liu N, Ding H, Vanderheyden J L, et al. Radiolabeling Small RNA With Technetium-99m for Visualizing Cellular Delivery and Mouse Biodistribution[J]. Nucl Med Biol, 2007, 34(4): 399-404.
[12] Liu M, Wang R F, Zhang C L, et al. Noninvasive Imaging of Human Telomerase Reverse Transcriptase (hTERT) Messenger RNA With99mTc-Radiolabeled Antisense Probes in Malignant Tumors[J]. J Nucl Med, 2007, 48(12): 2 028-2 036.

