戊糖乳杆菌WH12-2-1产细菌素条件的优化
苏芳,李莉,罗斌,孟和毕力格
(内蒙古农业大学 食品科学与工程学院,乳品生物技术与工程教育部重点实验室,呼和浩特010018)
戊糖乳杆菌WH12-2-1产细菌素条件的优化
苏芳,李莉,罗斌,孟和毕力格
(内蒙古农业大学 食品科学与工程学院,乳品生物技术与工程教育部重点实验室,呼和浩特010018)
以分离自内蒙古传统乳制品中的戊糖乳杆菌(Lactobacilluspentosus)WH12-2-1为试验菌株,研究其产细菌素的最佳条件,以提高该菌产细菌素的能力。对碳源、氮源等培养基成分及培养条件进行优化,并采用响应平面法确定其最佳的碳源、氮源和缓冲盐的质量浓度。结果表明,L.pentosusWH12-2-1在37℃(pH值为7.0),抑菌活性最佳,培养基成分为:大豆蛋白胨10 g/L,牛肉膏5 g/L,酵母粉5 g/L,葡萄糖30 g/L,柠檬酸钠6 g/L,磷酸氢二钾6 g/L,乙酸钠15 g/L,Tween-80 2 g/L,硫酸镁1 g/L,硫酸锰50 mg/L,硫酸亚铁50 mg/L。此条件下,细菌素的产量是原来的3.38倍。
糖乳杆菌WH12-2-1;细菌素;优化
0 引 言
细菌素(Bacteriocin)是细菌在代谢过程中通过核糖体合成机制产生的一类具有抑菌活性的肽或前体[1],通常认为它只作用于与产生菌同种的其他菌株或与其亲缘关系很近的种[2]。细菌素无致畸变作用,无毒性蓄积作用,也不易产生耐药性,近年的研究又揭示了细菌素不仅有直接抑菌的活性,而且对宿主有免疫抑制、免疫激活和免疫增强等调节功能[3],所以细菌素的应用价值越来越备受关注。
L.pentosusWH12-2-1是从内蒙古传统乳制品中分离出的一株具有抑制食品腐败和致病菌生长的微生物。本研究对L.pentosusWH12-2-1产生细菌素的培养条件和培养基成分进行优化,从而使其细菌素产量最大化。
1 材料与方法
1.1 菌株和培养基
菌株L.pentosusWH12-2-1,指示菌蜡样芽孢杆菌(Bacillus cereusAS 1.1846),均由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。
LB液体培养基 (Luria-Bertani Broth)、MRS液体培养基、酸性对照培养基(用乳酸调整的与细菌素初提液pH值相同的空白培养基)。
1.2 细菌素粗提液的制备
将L.pentosusWH12-2-1菌株于灭菌脱脂乳中-80℃保存,使用前,接种于MRS培养基,37℃培养16~18 h,活化两代后,按质量分数为2%的接种量接种到MRS培养基中,37℃培养24 h,最后一代经MRS培养基培养36 h。培养液于3 000 g离心15 min,取上清液用无菌滤菌器(0.22 μm)过滤除菌即得细菌素粗提液,保存于4℃冰箱备用。
1.3 抑菌活性检测方法
采用牛津杯法。在直径为9 cm的培养皿中准确加入20 mL MRS固体培养基,待凝固后,吸取100 μL指示菌稀释液(活菌数为2.0×106mL-1)于固体培养基中,用灭菌推棒涂抹均匀,在每个平皿中等距离放置牛津杯,并在牛津杯中加入100 μL细菌素粗提液,于30℃培养14 h,用游标卡尺测量抑菌圈直径。毎个试验设酸性对照,并设3组平行,求平均值。
1.4 不同培养温度和起始pH值对细菌素产量的影响
将L.pentosusWH12-2-1以质量分数为2%的接种量接种于MRS液体培养基中,分别于15,25,30,37,45℃培养48 h后,按照方法2.2制备细菌素粗提液,按照方法2.3测定抑菌活性。
用浓度为0.1 mol/L的HCl和NaOH溶液将液体MRS培养基的pH值分别调至4.0,5.0,6.0,7.0,8.0和9.0,灭菌后以质量分数为2%的接种量接入L.pentosusWH12-2-1,37℃培养48 h后,按照方法2.2制备细菌素粗提液,按照方法2.3测定抑菌活性。
1.5 培养基碳源和氮源的筛选
不同的碳源和氮源分别取代MRS中的碳源和氮源配制培养基,接种L.pentosusWH12-2-1进行培养,根据抑菌圈的直径确定碳源和氮源的优劣。优选的氮源按照不同的添加比例进行复配。
1.6 培养基碳氮量及碳氮比的优化
在上一步优化的培养基基础上,分别用不同的碳氮总量和碳氮质量比取代MRS中的碳源和氮源配制培养基,接种L.pentosusWH12-2-1进行培养,以抑菌圈的直径大小确定适宜的碳氮总量和碳氮比例。
1.7 培养基微量元素的优化
以优化的碳源和氮源培养基为基础,添加不同的微量元素(包括镁、锰、铁、),分别设酸性对照,接种L.pentosusWH12-2-1进行培养,以抑菌圈的直径大小确定微量元素的添加量。
1.8 培养基缓冲体系的优化
以优化了碳源、氮源、微量元素的培养基为基础,添加不同的缓冲盐体系,设酸性对照,确定最优的缓冲体系。
1.9 培养基组分构成比例的优化
由培养基营养成分筛选确定的L.pentosusWH12-2-1生长的主要影响因素包括碳源、氮源和缓冲盐,设计三因素正交旋转回归实验。以细菌素粗提液的抑菌圈直径为响应值做响应面设计,对营养成分进行优化,得到优化培养基。
2 结果与讨论
2.1 培养温度对细菌素产量的影响
图1为培养温度对细菌素产量的影响。
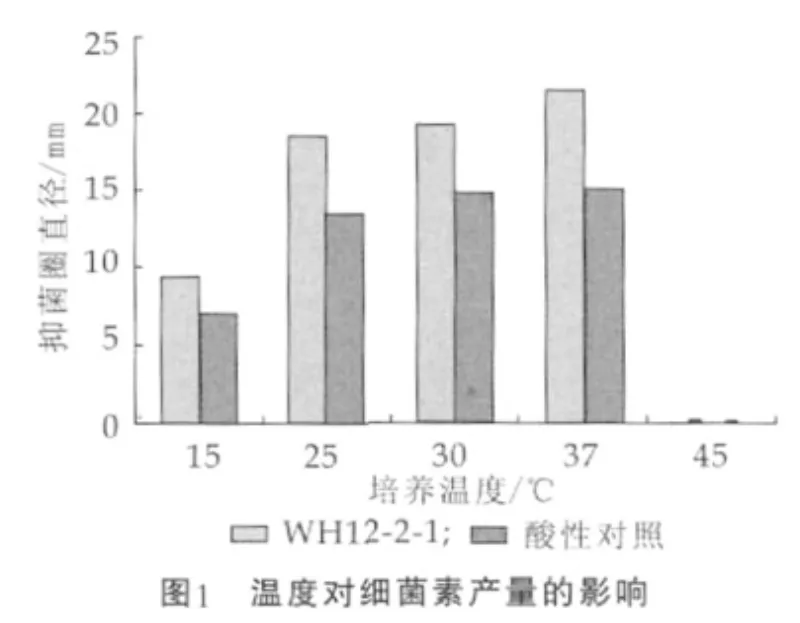
由图1可以看出,L.pentosusWH12-2-1在培养温度为37℃时,抑菌圈直径最大,可达(21.57±0.48)mm,酸性对照为(15.27±0.53)mm,说明此温度下细菌素产量最大;当培养温度降至15℃时,细菌素的产量明显下降,45℃时无细菌素产生,这是由于L.pentosusWH12-2-1在45℃生长受到限制,进而影响到细菌素的合成。已有报道乳酸菌产细菌素是一个对温度敏感的过程[4]。Luca Settanni等[5]研究发现温度对Enterococcus mundtii strains的抑菌物质活性没有强烈的影响,在30℃时,抑菌物质的活性最高。Ogunbanwo ST等[5]对Lactobacillus brevisOG1研究表明,30℃时最有利于细菌素的合成,菌体生长最好;而45℃时,菌体即停止生长和合成细菌素。本研究选择培养温度37℃进行下一步实验。
2.2 起始pH值对细菌素产量的影响
pH值对细菌素产量的影响,是因为pH值能够调控合成细菌素的基因,目前,几个典型的可被调控的基因已被发现[6]。图2为起始pH值对细菌素产量的影响。
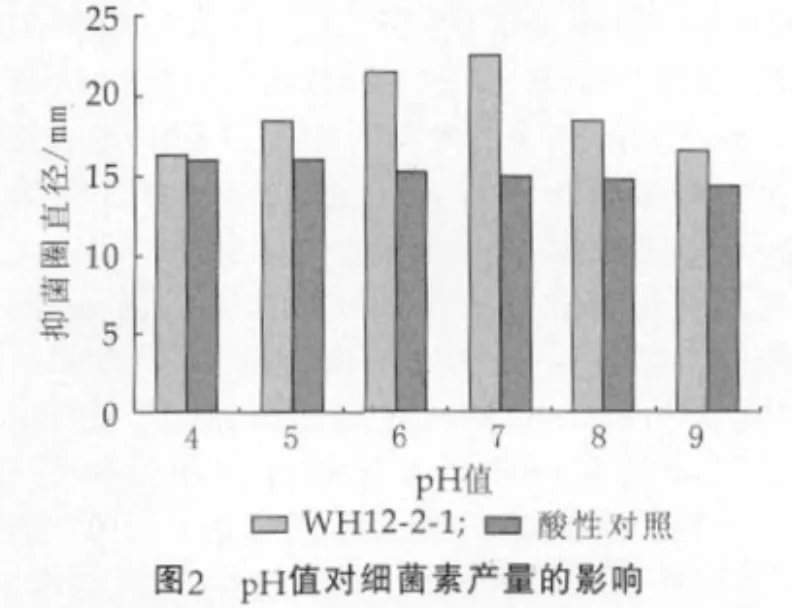
由图2可以看出,在起始pH值7.0的条件下,细菌素活力最强,抑菌圈直径可达(22.46±0.23)mm,酸性对照为(14.92±0.25)mm。结果与Van den Berghe[7]等研究E.faeciumFAIR-E 406在起始中性条件下能持续产生最大量的细菌素相似。中性pH值范围被认为是肠球菌产生最大细菌素量的最佳条件[8]。故选择pH值为7.0进行下一步实验。
2.3 培养基碳源优化
表1为L.pentosusWH12-2-1在不同碳源培养基中的抑菌圈直径。
由表1可以看出,经显著性分析可知,葡萄糖最有利于细菌素的产生,D-麦芽糖次之,蔗糖、乳糖的效果一般,可溶性淀粉最差,可能是不同的碳源提供的能量和碳骨架不同,影响了细菌素的合成。故选择葡萄糖为最佳的碳源。

表1 在不同碳源培养基中的抑菌圈直径
2.4 培养基氮源的优化
有机氮源的种类影响细菌素的产量,这可能与细菌素的合成机制有关,或许是不同氮源中的某些成分诱导了细菌素合成基因的启动[9]。由于乳酸菌其自身酶构成简单,许多氨基酸不能自身合成[10],故本实验选择有机氮源进行实验。表2为L.pentosus WH12-2-1在不同氮源培养基中豆的抑菌圈直径。

表2 在不同氮源培养基中豆的抑菌圈直径
由表2显著性分析可知,酵母粉最有利于L.pentosus WH12-2-1细菌素的产生,大豆蛋白胨和牛肉膏仅次之,胰蛋白胨和牛蛋白胨的效果最差。故选择酵母粉为最适宜的氮源。酵母粉中除含有丰富的氨基酸外还含有许多维生素和无机盐[11],许多对乳酸菌培养基的研究都表明酵母粉是最适宜的氮源[12,13]。
考虑到仅以酵母粉作为氮源成本较高,因此选择价格低廉,促进生长效果仅次于酵母粉的大豆蛋白胨、牛肉膏与酵母粉复合使用作为氮源。由表2可以看出,氮源的复合使用要比单独使用效果明显,故选择酵母粉︰大豆蛋白胨︰牛肉膏为1︰2︰1为复合氮源,添加质量分数为1%进行下一步实验,结果如表3所示。
2.5 培养基碳氮质量及碳氮量比的优化
培养基中碳氮比例对微生物生长繁殖和产物合成的影响极为显著。氮源过多则会使菌体生长过于旺盛,容易引起菌体的衰老和自溶;碳源过多则容易形成较低的pH值,不利于菌体生长[14]。
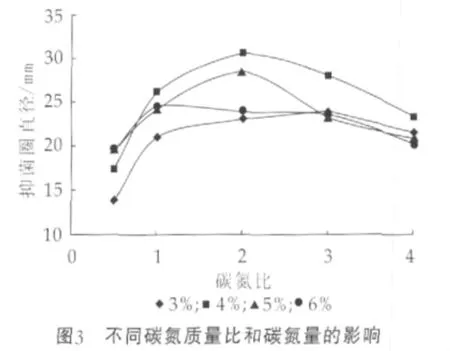
图3为不同碳氮质量比和碳氮量对细菌素产量的影响。由图3可以看出,培养基的碳氮质量比对细菌素产量的影响随碳氮量的变化而变化,均为先增大后减小,但是最佳比例却不相同。当碳氮量质量分数为3%时,抑菌圈直径在碳氮比为3时出现最大值;当碳氮质量分数为4%和5%时,抑菌圈直径均在碳氮比为2时出现最大值,而当碳氮质量分数为6%时,抑菌圈直径则是在碳氮比为1时出现最大值。综合考虑选择碳氮质量分数为4%、碳氮质量比为2进行下一步研究。
表3 复配氮源及添加量对细菌素产量的影响
注:抑菌圈直径单位为mm。(下同)
2.6 培养基缓冲盐体系的优化
缓冲盐体系中的某些无机盐是微生物细胞的组成成分或代谢调节物,如磷、硫是细胞质的组成成分,钾、钠有维持水平衡、保持渗透压和酸碱平衡的作用[15]。常用的缓冲剂有柠檬酸盐、磷酸盐、乙酸盐等。表4为不同缓冲盐体系及其添加量对细菌素产量的影响。
由表4可以看出,培养基中补充一定的缓冲盐后细菌素的产量明显高于空白对照组。经过不同缓冲盐体系对细菌素产量影响的显著性分析,可知体系C6H5Na3O7-K2HPO4-CH3COONa、Na2HPO4-NaH2PO4和Na2HPO4-KH2PO4对细菌素产量的影响差异不显著,而他们都与体系C6H8O7-C6H5Na3O7差异显著。其中,以C6H5Na3O7-K2HPO4-CH3COONa体系的平均水平最高,且在浓度为0.1mol/L的情况下,细菌素的产量最大。故选择C6H5Na3O7-K2HPO4-CH3COONa体系进行下一步实验。
2.7 培养基微量元素的优化
图4为微量元素对细菌素产量的影响。由图4可以看出,MgSO4,MnSO4和 FeSO4对细菌素的产生都有一定的促进作用,且随着微量元素添加量的增大,细菌素的产量都经历了由增到减的过程。Vlaemynck[16]发现在培养基中将MgSO4替换为MgCl2或K2SO4,还有或在MgSO4存在的基础上添加不同浓度的这些盐类(Mg-Cl2或K2SO4)会对细菌生长和细菌素产量有一定的影响。Hugas[17]发现锰离子可以提高Lb.sakei CTC 494细菌素的活性。故确定MgSO4的添加量为1000 mg/L,MnSO4的添加量为50 mg/L,FeSO4的添加量为50 mg/L。

表4 不同缓冲盐体系及其添加量对细菌素产量的影响

2.8 Tween-80添加量的选择
Tween-80作为一种乳化剂,可以降低菌体细胞与培养基接触面之间的表面张力,从而改善细胞膜的通透性,减弱细胞对细菌素的吸附作用,使细菌素更多的释放到培养基中,从而使细菌素产量增加[18]。除此之外,Tween-80可能为细胞的生[19]长提供某些脂肪酸,也可能是作为一种类似维生素的物质,有助于细菌素的产生。而过量的Tween-80则会与硫酸盐反应形成沉淀,使纯化工艺的难度加大[20]。 因此,选择合适质量分数的Tween-80对细菌素的产生和后面的纯化工作都至关重要。图5为Tween-80对细菌素产量的影响。
由图5可以看出,在培养基中添加不同质量分数的Tween-80对L.pentosus WH12-2-1细菌素的产生有不同程度的影响,其中,添加质量分数为0.2%的Tween-80最有利于细菌素的产生。故确定Tween-80的添加量为0.2%。
2.9 对培养基主要组成成分的优化
响应面法 (Response Surface Methodology,RSM)是利用合理的试验设计并通过实验得到的一定数据,采用多元回归方程来拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法[21]。与单因素设计和正交实验设计相比,它通过建立数学模型,可以在更广泛的范围内考虑因素的组合并预测响应值;同时对影响生物产量的各因子水平及其交互作用进行优化与评价,快速有效地确定多因子系统的最佳条件[22]。因此被广泛用于发酵培养基的优化工作。
本研究采用响应面中心组合设计方案的三因素二次正交旋转设计对已选定的培养基成分中的主要营养成分碳源、氮源和缓冲盐含量进行优化,以细菌素抑菌圈直径为响应值寻求最适宜的各培养基成分配方。具体实验因素水平设计和实验结果如表5所示。
用Design Expert软件对表4数据进行多项回归分析,得到L.pentosus WH12-2-1细菌素粗提液的抑菌圈直径(Y)对碳源x1,氮源x2,缓冲盐x3的多项回归方程为
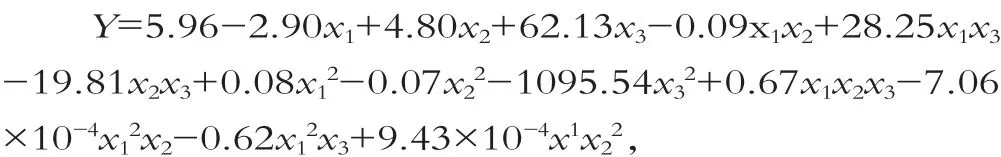


表5 三因素二次正交旋转回归设计及实验结果
式中:Y为抑菌圈直径的预测值;x1,x2,x3分别为碳源、氮源和缓冲盐对应的编码值。方差分析表明该模型极显著(P=0.0010),模型确定系数R2=0.9750,校正系数R2=0.9207,这表明模型与实际情况拟合较好。因此,该模型可用于预测菌株L.pentosusWH12-2-1产细菌素的情况。碳源,氮源,缓冲盐交互作用对细菌素产量的影响变化趋势,如图6所示。
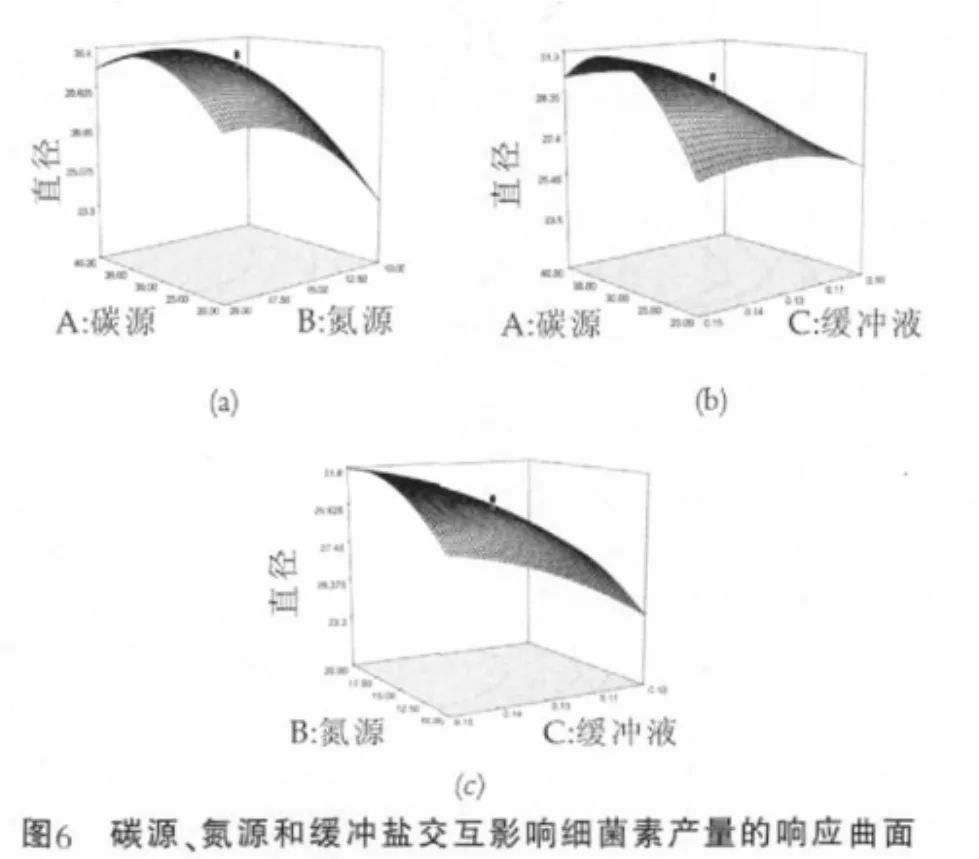
图6(a)中,缓冲盐浓度为0.13 mol/L,碳源-氮源交互作用;(b)中,氮源质量浓度为15 g/L,碳源-缓冲盐交互作用;(c)中,碳源质量浓度为30 g/L,氮源-缓冲盐交互作用。
由图6可以看出,碳源和氮源交互作用的响应曲面是有明显曲率的,说明碳源、氮源对细菌素的产量是有交互作用的,从而进一步验证了前期设计碳氮总量及碳氮比例的试验是有必要的。
求解方程极值得到预测最优培养基配方为:碳源x1=32.71 g/L,氮源x2=18.25 g/L,缓冲盐x3=0.14 mol/L,预测最大抑菌圈直径为32.95 mm。考虑到实际操作性,将优化参数修正为:碳源30 g/L,氮源20 g/L,缓冲盐0.15 mol/L,在此条件下,预测最大抑菌圈直径为32.45 mm。经实验验证,实际测得抑菌圈直径为(31.72±0.17)mm, 与模型预测值拟合率达97.75%,酸性对照为(13.14±0.25)mm。从验证实验的效果来看,该预测方程可靠。
3 结 论
经过对L.pentosusWH12-2-1产细菌素的条件优化后,在37℃(pH值为7.0)条件下,最佳培养基配方为大豆蛋白胨10 g/L,牛肉膏5 g/L,酵母粉5 g/L,葡萄糖30 g/L,柠檬酸钠6 g/L,磷酸氢二钾6 g/L,乙酸钠15 g/L,Tween-80 2g/L,硫酸镁1 g/L,硫酸锰50 mg/L,硫酸亚铁50 mg/L。经过培养基成分的优化,抑菌圈直径可达(31.72±0.17)mm,酸性对照为(13.14±0.25)mm,排除酸性物质的影响,其抑菌活性是优化前的3.38倍。
[1]ENNAHAR S,SASHIHARA T,SONOMOTO K,et al.Class IIa Bacteriocins:Biosynthesis,Structure and Activity[J].FEMS Microbiol Rev,2000,24(1):85–106.
[2]RAIPH W,JACK J R,TAGG B R.Bacteriocins of Grampositive Bacteria[J].Microbiological Reviews,1995,1:171-200.
[3]徐灵龙,王云峰.抗菌肽及其功能研究[J].中国生物工程杂志,2007,27(1):115-118.
[4]LEROY F,DE VUYST L.Temperature and pH Conditions That Prevail During the Fermentation of ausages are Optimal for Production of the Antilisterial Bacteriocin Sakacin K.Appl.Environ[J].Microbiol,1999b,65:974–981.
[5]LUCA S,SARA V,GIOVANNA S,ALDO C,et al.The Role of Environmental Factors and Medium Composition on Bacteriocin Like Inhibitory Substances(BLIS)Production byEnterococcus mundtiiStrains[J].Food Microbiology,2008,25:722-728.
[6]OGUNBANWO S T,SANNI A I,ONILUDE A A.Influence of Cultural Conditions on the Production of Bacteriocin byLactobacillus brevisOG1.Afr J Biotechnol,2003,2(7):179?184.
[7]OLSON E R.Influence of pH on Bacterial Gene Expression[J].Molecular Microbiology,1993,8:5–14.
[8]DEN BERGHE EV,WINTER TD,VUYST LD.Enterocin A production byEnterococcus faeciumFAIR-E 406 is Characterised by a Temperature andpH-dependentSwitch-offMechanism when Growth is Limited due to Nutrient Depletion[J].International Journal of Food Microbiology?,2006,107:159–170.
[9]ASEN I M,MORETRO T,KATLA T,et al.Influence of Complex Nutrients,Temperature and pH on Bacteriocin Production byLacto-bacillus sakei CCUG 42687[J].Appl Microbiol Bictechnol 2000,53:159-166.
[10]杨洁彬.乳酸菌-生物学基础及应用[M].北京:中国轻工业出版社,1996.
[11]THANGAMANI A,THANGAMANI R,NAGARAJAN K,et al.Influence of Medium Components and Fermentation Conditions on the Production of Bacteriocin(s)by Bacillus licheniformis AnBa9[J].Bioresource Technology,2009,100:872–877.
[12]HUJANEN M,LINKO Y Y.Effect of Temperature and Various Nitrogen Sources on L-(+)-Lactic Acid Production by Lactobacillus casei[J].Appl Microbiol Biotechnol,1996,45(6):307-313.
[13]HUJANEN M,LINKO S,LINKO Y Y,et al.Optimization of Medium and Cultivation Conditions for L(+)(s)-Lactic Acid Production by Lactobacillus casei NNRL B-441[J].Appl Microbiol.Biotechnol,2001,56:126-130.
[14]余龙江.发酵工程原理与技术应用 [M].北京,化学工业出版社,2006.9.
[15]李寅,高海军,陈坚.高细胞密度发酵技术[M].北京:化学工业出版社,2006.
[16]VLAEMYNCK G.Inhibition of Listeria Monocytogenes by the Application of Bacteriocins:Study of Some Parameters Effecting Production of Enterocin RZS C5 and Pediocin RZS C8.Mededelingen Faculteit Landbouwwetenschappen Universiteit Gent,1996,61,1605–1611.
[17]HUGASM,GARRIGAM,PASCUAIM,etal.Enhancementof Sakacin K Activity AgainstListeria monocytogenesin Fermented Sausages with Pepper or Manganese as Ingredients[J].Food Microbiol,2002,19:519–528.
[18]ASTHER M,CORRIEN G.Effect of Tween-80 and Oleic in Liganase Production by Phanerochaete chryaoporium INA-12[J].Enzyme Microbiology and Technology,1987,9:245-249.
[19]庄绪亮,张洪勋,马桂荣.不同发酵条件下吐温80对乳酸链球菌SM526产Nisin的影响[J].化工冶金,2000,21(2):145-148.
[20]陈秀珠,何松,龙力红等.乳链菌肽高产菌株AL2的发酵条件研究[J].微生物学通报,1995,22(4):215-218.
[21]SENTHURAN A,SENTHYRAN V,MATTIASSON B,et al.Lactic Acid Fermentation in Recycle Batch Reactor Using Immobilized Lactobacillus casei[J].Biotechnol.Bioeng,1997,55:841-853.
[22]RATNAM B V V,RAO M N,RAO M D,et al.Optimization of Fermentation Conditions for the Production of Ethanol from Sago Starch Using Response Surface Methodology[J].World Journal of Microbiology&Biotechnology,2003,19:523-526.
Optimation of condition of bacteriocin production by Lactobacillus pentosus WH12-2-1
SU Fang,LI Li,LUO Bin,Menghebilige
(Key Lab of Dairy Biotechnology and Bioengineer of Education Ministry of China,college of food science and engineering,Inner Mongolia Agricultural University,Huhhot 010018,China)
As one strain was isolated from traditional fermented dairy product of Inner Mongolia,Lactobacillus pentosus WH12-2-1 was investigated for its optimal condition of bacteriocin production.Medium components such as carbon and nitrogen sources and cultivation condition were optimized,the optimal concentration of buffer salt,carbon and nitrogen sources were determined by using response surface method.The results showed that Lactobacillus pentosus WH12-2-1 optimal culture medium components was consist of 10 g/L soy peptone,5 g/L beef extract,5 g/L yeast extract,30 g/L glucose,6 g/L sodium citrate,6 g/L K2HPO4,15 g/L CH3COONa,2 g/L Tween-80,1 g/L Mg-SO4,50 mg/L MnSO4and 50mg/L FeSO4at 37℃with start pH 7.0.Under optimized condition,Lactobacillus pentosus WH12-2-1 produced 3.38-fold higher amount of bacteriocin than the un-optimized condition.
L.pentosus WH12-2-1;Bacteriocin;Optimation
Q93-335
A
1001-2230(2010)03-0010-06
2009-11-11
苏芳(1986-),女,硕士研究生,从事食品微生物与发酵工程的研究。
孟和毕力格

