阿魏酸存在下酪蛋白的酶促交联与一些性质变化
李君文,赵新淮
(东北农业大学 乳品科学教育部重点实验室,哈尔滨150030)
阿魏酸存在下酪蛋白的酶促交联与一些性质变化
李君文,赵新淮
(东北农业大学 乳品科学教育部重点实验室,哈尔滨150030)
在pH值为9.5,阿魏酸存在和37℃的条件下,利用辣根过氧化物酶(EC 1.11.1.7)和过氧化氢对酪蛋白进行氧化交联,并用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳和紫外吸收分析确认交联作用。在蛋白质质量分数为0.04%时,交联酪蛋白的乳化活性指数、乳化稳定性分别比酪蛋白提高25.2%和7.0%。利用葡萄糖酸–δ–内酯制备酪蛋白和交联酪蛋白的酸化凝胶,扫描电子显微镜观察可以看出交联酪蛋白凝胶的微观结构中空穴减少,形成了更为致密的结构。
酪蛋白;辣根过氧化物酶;阿魏酸;交联;乳化性质
0 引 言
酪蛋白是牛乳中质量分数最多的蛋白质,占总量的80%~82%[1]。酪蛋白的改性处理,例如交联,可以改变它的功能性质。蛋白质交联是在蛋白质内部或蛋白质之间形成共价键[2],交联的方法有化学法、物理法和酶法。酶法交联多采用转谷氨酰胺酶[3-4],极少采用过氧化物酶,只有1篇报告涉及酪蛋白的氧化交联[5]。研究表明,酪蛋白经辣根过氧化物酶氧化交联后改善了乳化性。
在氧化酶存在下,阿魏酸等能与赖氨酸等残基反应并导致交联。为此,本研究以阿魏酸为交联剂,在H2O2存在下利用辣根过氧化物酶对酪蛋白进行氧化交联,通过样品的凝胶电泳和光谱分析,确认交联反应,并对交联酪蛋白的乳化性质、酸化凝胶的微观结构进行分析,评价氧化交联对这些性质的影响。
1 实 验
1.1 材料
酪蛋白;辣根过氧化物酶;阿魏酸;精炼大豆油;研究用水为去离子水,其他化学试剂均为分析纯试剂。
1.2 主要设备
DELTA 320型pH计,2300型全自动凯氏定氮仪,DHP-9082型电热恒温培养箱,WD-9405型水平摇床,P/ACE MDQ 毛细管电泳系统,UV-2401PC紫外可见分光光度计,LGJ-1型冷冻干燥机,高速组织匀浆机,凝胶成像分析系统,S-5700扫描电子显微镜。
1.3 方法
1.3.1 交联反应确认
采用单因素试验,固定酪蛋白质量分数为5%,pH值为9.5(浓度0.2 mol/L碳酸盐缓冲体系)、温度37℃、辣根过氧化物酶添加量为420 U/g酪蛋白、质量分数为3%的过氧化氢溶液加1 mL,阿魏酸浓度为8 mmol/L,于37℃恒温培养箱内水平摇床振荡,进行酪蛋白进行交联反应,反应时间分别为0.5~3 h。反应完成后于85℃水浴锅加热灭酶10 min,冷却后–20℃保存。
(1)SDS-PAGE分析。采用稳压法电泳。每孔进样10 μL,浓缩胶质量分数为3%,分离胶质量分数为12%。样品处于浓缩胶时电压为80 V,待溴酚蓝前沿进入分离胶后加压至120 V,待溴酚蓝距离下缘0.5~1.0 cm时停止电泳,剥离凝胶,固定、染色和脱色,直至蛋白质条带清晰、背景色完全褪去,凝胶成像。
1.3.1.2 光谱分析
将所有的样品液稀释成蛋白质质量浓度为1 g/L,分别于波长280 nm和315 nm处测定吸光度值,计算A315/A280[6]。
1.3.2 交联酪蛋白制备
用pH值为9.5碳酸盐缓冲溶液配制质量分数为5%的酪蛋白溶液,采用优化后的交联反应条件(本文不详细介绍),加入3 μkat·g-1蛋白的辣根过氧化物酶、质量分数为3%过氧化氢1mL以及阿魏酸浓度为6mmol/L,37℃恒温培养箱用水平摇床振荡反应0.7 h,85℃灭酶10 min,冷却后–20℃保存。
1.3.3 乳化活性指数及乳化稳定性测定
配制质量分数为0.01%,0.02%,0.03%和0.04%的交联酪蛋白溶液。取75 mL溶液与25 mL大豆油混合,以12 000 r/min均质1 min,静置,在0 min和10 min时从容器底部取50 μL乳状液于试管中,加5 mL质量分数为0.1%的SDS,500 nm处测定吸光度(以0.1%SDS调节零点)。同样处理、测定酪蛋白。乳化活性指数(EAI)及乳化稳定性(ESI)的计算为[8]
式中:A0为零时刻的吸光度;C为酪蛋白质量浓度(g/mL);Φ为油相体积分数;A10为静置10 min后的吸光度。
1.3.4 酸化凝胶微观结构观察
取一定量的酪蛋白样品,搅拌溶解,并用浓度为0.2 mol/L盐酸调节pH值 7.0左右。利用超声波处理10 min,定容,配制质量分数为3%的酪蛋白溶液。酪蛋白溶液加一定量的葡聚糖–δ–内酯,40℃水浴锅中恒温放置至pH值约为4.0,取出后4℃冰箱保存,制得凝胶样品。将凝胶从冰箱中取出,室温放置,取样。样品于4℃温度条件下固定于质量分数为2.5%的戊二醛溶液中1 h以上,分别用质量分数为50%、70%和90%乙醇进行梯度洗脱,每次洗脱10 min,然后用体积分数为100%乙醇洗脱两次,每次15 min;分别用1∶1的100%乙醇和叔丁醇、叔丁醇分别置换15 min;将样品置于冷冻干燥机中冷冻12 h,冷冻样品取出,用双面胶将样品固定于扫面电子显微镜的样品台上,然后在离子溅射仪中镀金;最后,用扫描电子显微镜观察样品的微观结构,加速电压为5 kV,放大倍数为5 000倍。
2 结果与讨论
在过氧化氢、酚类化合物存在下,过氧化物酶催化的蛋白质氧化交联反应的机理为[8]:酚酸或者其它的多元酚经过氧化物酶的作用氧化成醌,醌与蛋白质中一些氨基酸残基的基团(氨基或巯基)发生反应生成加成物,并再次形成酚羟基结构。后者可以再次被氧化并结合第二个蛋白质肽链,从而形成交联化合物(即交联蛋白)。所以,交联蛋白具有不同于原来蛋白质的分子质量,并且由于分子体积增加,导致其功能性质发生变化。阿魏酸为植物性食品中的一个常见酚酸,可以作为交联剂用于蛋白质的交联处理,以开发新型蛋白质配料。
2.1 辣根过氧化物酶催化酪蛋白氧化交联
2.1.1 SDS-PAGE电泳验证
对不同反应时间的交联酪蛋白样品进行SDS–PAGE分析,结果如图1所示。由图1可以看出,交联酪蛋白泳道 (泳道1~5)在97.4 ku以上有明显的条带存在,而酪蛋白泳道(泳道0)则没有;同时,交联酪蛋白泳道中31 ku以下没有蛋白质条带,而酪蛋白泳道则有。电泳谱图的结果显示,在阿魏酸和过氧化氢的存在下,辣根过氧化物酶催化酪蛋白发生交联,形成更大分子的蛋白质。

图1中,泳道M为标准蛋白;泳道0为酪蛋白样品;泳道1~5为反应时间分别为0.5,1,1.5,2,3 h的交联酪蛋白样品
2.1.2 光谱分析
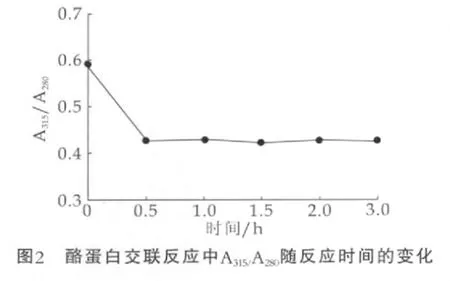
对不同反应时间的交联酪蛋白样品的紫外吸收分析结果如图2所示。与未反应的酪蛋白相比(反应时间为0 h),交联酪蛋白样品的A315/280比值降低,但0.5 h后基本不变。由于酪蛋白在280 nm处有最大吸收,并且反应过程中其质量分数不变,而阿魏酸在315 nm处有最大吸收,所以A315/280比值可以反映出交联反应过程中酪蛋白、阿魏酸之间的相对变化关系。可以看出,反应0.5h后A315/280比值从0.6减小至接近0.4,说明阿魏酸含量的相对的减少了。这一结果间接地表明,在过氧化氢存在下辣根过氧化物酶促酪蛋白发生交联反应,阿魏酸参与了酪蛋白的交联反应,且交联反应在进行了0.5 h后,反应程度变化不大。
2.2 交联酪蛋白的乳化活性和乳化稳定性
对酪蛋白、交联酪蛋白的乳化活性和乳化稳定性进行相关评价结果如图3所示。与酪蛋白相比,在蛋白质质量分数低于0.03%时,交联酪蛋白的乳化活性指数较低;在蛋白质质量分数为高于0.03%时,交联酪蛋白的乳化活性指数高于酪蛋白;在蛋白质质量分数为0.04%时,交联酪蛋白的乳化活性指数增加25.2%。同样,交联酪蛋白的乳化稳定性整体上略好于酪蛋白;当蛋白质质量分数为0.04%时,其乳化稳定性增加7.0%。这可能是由于交联形成共价聚合物,交联蛋白质分子的黏弹性比单体酪蛋白分子要高,界面蛋白膜的稳定性提高,油滴不易聚集,从而使乳化稳定性得到改善。整体上看,交联反应整体上改善了酪蛋白的乳化性质,尤其是在乳化活性指数上改进较大。这是均是由于酪蛋白交联以后,增加了其分子的体积,因此有利于其乳化性质的改善。

2.3 交联酪蛋白的酸化凝胶微观结构
图4为利用葡萄糖酸–δ–内酯制备的酪蛋白、交联酪蛋白的微观结构分析结果。由图4(a)可以看出,酪蛋白微观结构松散、存在较大的空穴;而图4(b)中的交联酪蛋白微观结构,呈现出更致密的网状结构。这是由于阿魏酸、过氧化物酶的存在,可以将酪蛋白分子以“手拉手”的形式连接起来,形成了共价聚合物,更有利于蛋白质分子形成有序、致密的空间结构。因此,酪蛋白在阿魏酸存在下的过氧化物酶催化氧化交联,可以有效的改善其酸化凝胶的微观结构,并将最终影响其质地。

3 结 论
(1)在过氧化氢和阿魏酸存在的条件下,利用辣根过氧化物酶的催化作用可以实现酪蛋白的氧化交联,该交联可以通过SDS–PAGE、光谱分析和毛细管电泳三方面得到确认。
(2)与酪蛋白相比,在蛋白质质量分数为0.04%时,交联酪蛋白的乳化活性指数、乳化稳定性分别提高25.2%和7.0%。
(3)利用葡萄糖酸–δ–内酯制备酪蛋白、交联酪蛋白凝胶,通过扫描电子显微镜观察、比较,交联酪蛋白所形成的酸化凝胶,其微观结构中空穴减少,具有更致密的结构。
[1]张建忠.酪蛋白和酪蛋白制品的开发[J].中国乳品工业.1998,26(6):31-32.
[2]FEENEY R E,WHITAKER J R.Importance of Cross-linking Reactions in Proteins[J].Advances in Cereal Science and Technology,1987,9:21-46.
[3]BONISCH M P,HUSS M,WEITL K,et al.Transglutaminase Crosslinking of Milk Proteins and Impact on Yoghurt Gel Properties[J].International Dairy Journal,2007,17(11):1360-1371.
[4]TRESPALACIOS P,PLA R.Simultaneous Application of Transglutaminase and High Pressure to Improve Functional Properties of Chicken Meat Gels[J].Food Chemistry,2007,100(1):264-272.
[5]STEFFENSEN C L,MATTINEN M L,ANDERSEN H J et al.Cross-linking of Tyrosine-Containing Peptides by Hydrogen Peroxide-Activated Coprinus Cinereus Peroxidase[J].European Food Research and Technology,2008,227(1):57-67.
[6]TENOVUO J,PAUNIO K.Peroxidase-Catalysed Formation of Dityrosine,a Protein Cross-Link in Human Periodontal Ligament Collagen[J].Archives of Oral Biology,1979,24(8):591-594.
[7]KINGSLEY K,ADDOB A K,XIONG Y L.Emulsifying and Foaming Properties of Transglutaminase-Treated Wheat Gluten Hydrolysate as Influenced by pH,Temperature and Salt[J].Food Hydrocolloids,2009,23(1):72-81.
[8]STRAUSS G,GIBSON S M.Plant Phenolics as Cross-Linkers of Gelatin Gels and Gelatin-Based Coacervates for Use as Food Ingredients[J].Food Hydrocolloids,2004,18(1):81-89.
Oxidative cross-linking of casein by peroxidase in the presence of ferulic acid and impacts on some selected properties
LI Jun-wen,ZHAO Xin-huai
(Key Lab of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Horseradish peroxidase(EC 1.11.1.7)and peroxide hydrogen was used to oxidative cross-link casein in presence of H2O2 and ferulic acid at 37℃and pH=9.5.Cross-linking of casein occurred was first demonstrated by SDS-PAGE and spectroscopic analysis.Crosslinked casein was then prepared and used to analyze its emulsifying activity index,emulsifying stability index and microstructure of acidified gel.The emulsifying activity index and emulsifying stability index of cross-linked casein at concentration of proteins of 0.04%(w/w)were enhanced about 25.2%and 7%compared to that of casein at same concentration of proteins,respectively.The gel microstructure of cross-linked casein prepared by acidification of glucono-δ-lactone was observed by scanning electron microscopy as more compact and uniform structure.
casein;horseradish peroxidase;ferulic acid;cross-linking;emulsifying property
TS252.1
A
1001-2230(2010)03-0007-03
2009-11-11
国家高技术发展计划(863)(2006AA10Z324)。
李君文(1963-)女,硕士研究生,从事食品蛋白质研究。
赵新淮

