扁桃斑鸠菊叶不同溶剂提取物的抗氧化性和抑菌性分析





摘 要 以水、乙醇、乙酸乙酯、二氯甲烷和石油醚等5种不同极性的溶剂对扁桃斑鸠菊叶浸提,分析其提取物的抗氧化性和抑菌活性,筛选针对扁桃斑鸠菊叶中抗氧化及抑菌活性成分提取的适宜溶剂。利用提取物进行DPPH自由基清除率、ABTS自由基清除率和FRAP总抗氧化能力试验,并通过药敏抑菌圈直径和抑菌率分析提取物的抑菌性。抗氧化试验结果表明,乙酸乙酯提取物(E3)对DPPH自由基、ABTS自由基的清除效果和总抗氧化能力最好,清除率IC50值分别为VC的1.44、1.36倍,总抗氧化能力达0.69 mg Trolox·mg-1;抑菌圈直径和抑菌率测定结果高度一致,二氯甲烷提取物(E4)的抑菌圈直径最大,为15.51 mm,浓度相同时其抑菌率也最高,IC50值为0.14 mg·mL-1。总体上看,极性小的溶剂提取物的抗氧化性和抑菌活性相对更好,乙酸乙酯和二氯甲烷可分别作为提取扁桃斑鸠菊抗氧化和抑菌活性成分的优选溶剂。
关键词 扁桃斑鸠菊;提取物;抗氧化性;抑菌活性
中图分类号:QS567.1;TS202.1 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2025.01.003
扁桃斑鸠菊(Vernonia amygdalina Delile)是菊科斑鸠菊属植物,因原产于南非,故俗称“南非叶”,又常被称作“苦茶叶”“苦叶”等[1],主要分布在非洲热带地区和东南亚地区[2]。扁桃斑鸠菊在尼日利亚当地常作为药食两用植物[3],具有抗肿瘤、抗氧化、清热解毒、消炎、降血压、降血糖等多种功效[4-9]。随着“一带一路”倡议合作持续深化拓展,扁桃斑鸠菊已被引进在我国广东、福建、海南等亚热带或热带地区种植,其叶晒干后可制成茶叶饮用。目前,关于扁桃斑鸠菊的研究主要在其化学成分的解析及药理作用等方面[10-12],而对其活性部位的筛选研究还少见报道。本研究以水、乙醇、乙酸乙酯、二氯甲烷和石油醚分别对扁桃斑鸠菊叶进行浸提,提取物经浓缩挥干后,探究其对金黄色葡萄球菌的抑制率和抗氧化活性,确定扁桃斑鸠菊中抗菌和抗氧化活性成分提取的较优溶剂并评价其活性,以期为扁桃斑鸠菊资源的开发提供理论基础。
1 "材料与方法
1.1 "试验材料和试剂
材料:扁桃斑鸠菊叶采自海南省定安县海岛散养农场,经净化、杀青后,于80 ℃下烘干,粉碎过60目筛,备用。
试剂:DPPH自由基清除能力试剂盒、ABTS自由基清除能力试剂盒、总抗氧化能力试剂盒(FRAP法),购自苏州格锐思生物科技有限公司;无水乙醇、乙酸乙酯、二氯甲烷、石油醚(60~90 ℃)等化学品均为分析纯,购自国药集团化学试剂有限公司;LB培养基,购自上海源叶生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus,CICC10001),购自中国工业微生物菌种保藏管理中心,由实验室保存;超纯水。
1.2 "仪器设备
DHG电热鼓风干燥箱(上海一恒科学仪器有限公司);UV-1800PC紫外可见分光光度计(上海美谱达仪器有限公司);RV 10 digital旋转蒸发仪(德国IKA);Heraguard ECO超净工作台(赛默飞世尔科技有限公司);LHS-100CA恒温恒湿培养箱(上海一恒科学仪器有限公司);LDZX-75L高压蒸汽灭菌器(上海申安医疗器械厂);PRACTUM224-1CN电子分析天平(赛多利斯科学仪器有限公司);4-20R冷冻高速离心机(上海托莫斯科学仪器有限公司)。
1.3 "试验方法
1.3.1 "提取
称取约20 g扁桃斑鸠菊叶粉末,按照1∶10(g·mL-1)的比例分别用水、乙醇、乙酸乙酯、二氯甲烷、石油醚等5种不同极性的溶剂于60 ℃水浴下浸提2次,每次200 W超声辅助30 min,提取2 h,合并提取液后旋转蒸发挥干溶剂,所得提取物分别记为E1、E2、E3、E4、E5,于60 ℃下烘干备用。
1.3.2 "体外抗氧化性试验
1.3.2.1 " "DPPH自由基清除率测定
将5种溶剂的提取物用80%乙醇配制成0.2、0.4、0.6、0.8、1.0 mg·mL-1不同浓度的溶液,参考DPPH试剂盒使用说明,按表1方式配制溶液,混匀,室温(25 ℃)避光静置30 min,12 000 rpm,室温离心5 min,取上清液于517 nm处测定其吸光度;以同梯度浓度的VC作阳性对照。
测定组(或阳性对照组)、空白组和对照组的吸光度分别记为As、Ab、Ac,按照公式(1)计算DPPH自由基清除率。
[DPPH清除率=As−AbAc×100%] "(1)
1.3.2.2 " "ABTS自由基清除率测定
将5种溶剂的提取物用80%乙醇配制成0.2、0.4、0.6、0.8、1.0 mg·mL-1不同浓度的溶液,参考ABTS试剂盒使用说明,按表2方式配制溶液,混匀,室温(25 ℃)避光静置6 min,于734 nm处测定其吸光度;以同梯度浓度的VC作阳性对照。
测定组(或阳性对照组)、空白组和对照组的吸光度分别记为As、Ab、Ac,按照公式(2)计算ABTS自由基清除率。
[ABTS清除率=As−AbAc×100%] (2)
1.3.2.3 " "总抗氧化能力测定
①标准曲线绘制
参考FRAP试剂盒使用说明,用80%乙醇将试剂盒中的水溶性维生素E(Trolox)标准品配制成0、0.16、0.32、0.48、0.64、0.80 μmol·mL-1浓度梯度的标准品溶液,移取75 μL标准液,加入75 μL超纯水和850 μL显色液,混匀,室温(25 ℃)反应10 min,于590 nm处测定其吸光度;以75 μL的80%乙醇代替标准液作空白。以标准品的浓度为横坐标,ΔA(ΔA=A测-A空)为纵坐标作标准曲线,如图1。
②FRAP总抗氧化能力测定
将5种溶剂的提取物用80%乙醇配制成1.0 mg·mL-1的样品液,参照绘制标准曲线方案,测定吸光度;以75 μL的80%乙醇代替样品液作空白。总抗氧化能力以1 mg样品所相当的Trolox的质量(mg)来表示,结合标准曲线,可通过公式(3)用测得吸光度(ΔA)进行计算,式中250.29为Trolox的相对分子量。
总抗氧化能力(mg Trolox·mg-1)=(△A-0.0147)÷2.668 8×250.29×10-3 "(3)
1.3.3 "抑菌试验
以金黄色葡萄球菌为供试菌种,测定提取物的抑菌性。
1.3.3.1 " "菌悬液的制备
从菌落平板上挑选金黄色葡萄球菌单个菌落,接种于LB液体培养基中,37 ℃、100 rpm·min-1培养24 h。活化后使用PBS缓冲液配制成浓度约为1×105 CFU·mL-1的菌悬液。
1.3.3.2 " "抑菌活性测试
将5种溶剂的提取物用PBS缓冲液均配制成1 mg·mL-1的样品液;取菌悬液100 μL加到LB固体培养基中,迅速倒平板,待其凝固后进行打孔,然后将100 μL样品液加到孔中,平板置于37 ℃恒温培养箱中培养24 h,比较抑菌圈的直径大小。
1.3.3.3 " "抑菌率的测定
将5种溶剂的提取物用PBS缓冲液分别配制成0.1、0.2、0.4、0.8、1.6 mg·mL-1的样品液;于96孔板中每孔加入1.3.3.1中所配制的菌悬液100 μL,再加入100 μL样品液,以100 μL菌悬液和100 μL PBS缓冲液为对照组,以100 μL培养基和100 μL样品液为空白组,于37 ℃恒温培养箱中培养24 h后,于600 nm波长处测定其OD600值(表示菌株密度),分别用Ac、As和Ab表示;抑菌率按照公式(4)计算:
[抑菌率=Ac−AsAc−Ab×100%] (4)
1.3.4 "数据处理
以上每个试验平行测定3次,结果以平均值±标准差表示。通过Excel、SPSS软件分析处理数据。
2 "结果与分析
2.1 "提取物的抗氧化性
2.1.1 "DPPH自由基清除率
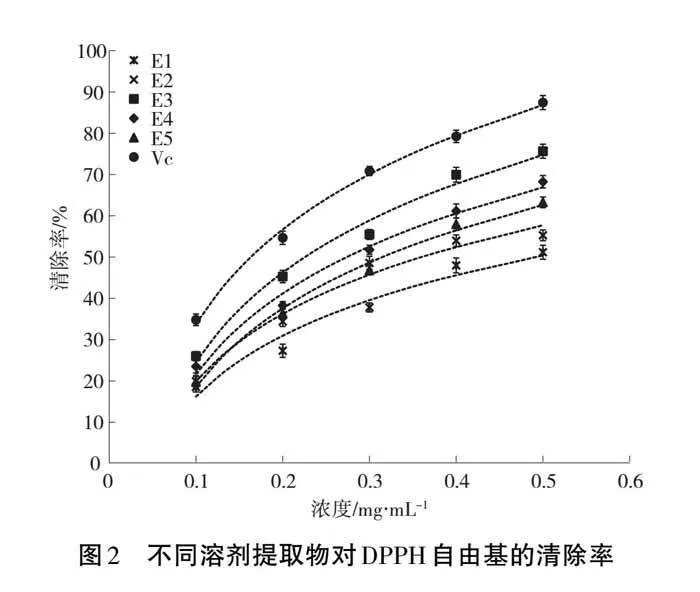
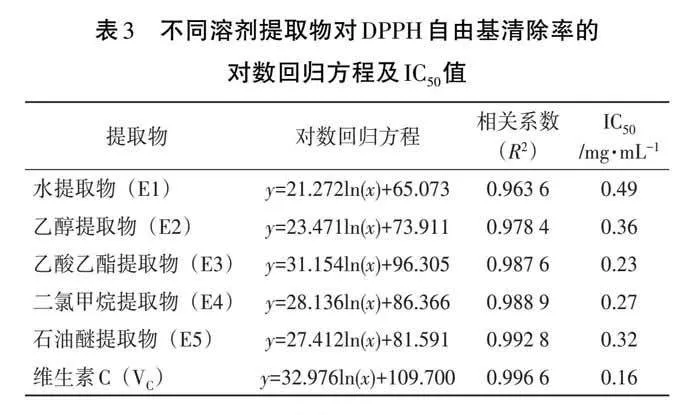
DPPH自由基清除率测定被广泛用于抗氧化活性的评价[13-15],5种溶剂的提取物对DPPH自由基的清除率如图2所示,说明5种提取物对DPPH自由基均有一定的清除能力,提取物浓度与清除率呈量效关系。清除率与提取物浓度的对数回归方程和IC50值见表3。由图2和表3可知,5种提取物对DPPH自由基的清除能力为乙酸乙酯提取物(E3)>乙醇提取物(E2)>二氯甲烷提取物(E4)>石油醚提取物(E5)>水提取物(E1),乙酸乙酯提取物对DPPH自由基的清除能力最好,其IC50值约为VC的1.44倍。
2.1.2 "ABTS自由基清除率
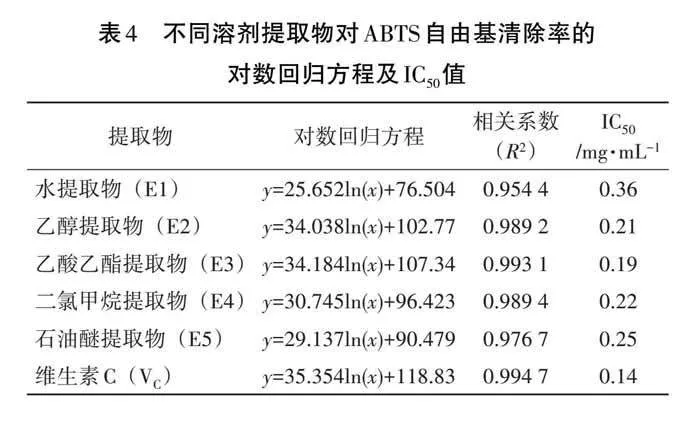
ABTS自由基清除率常作为体外抗氧化活性的评价指标[16-18],5种溶剂的提取物对ABTS自由基的清除率如图3所示,5种提取物对ABTS自由基表现出一定的清除能力,两者之间呈量效关系。清除率与提取物浓度的对数回归方程和IC50值见表4。由图3和表4可知,5种提取物对ABTS自由基的清除能力排序为乙酸乙酯提取物(E3)>二氯甲烷提取物(E4)>石油醚提取物(E5)>乙醇提取物(E2)>水提取物(E1),对ABTS自由基清除能力最好的仍是乙酸乙酯提取物,其IC50值约为VC的1.36倍。
2.1.3 "FRAP总抗氧化能力
FRAP法即测定样品对铁离子的还原能力,被普遍作为样品总抗氧化能力的指标[19-21]。5种溶剂的提取物均有一定的抗氧化能力,其FRAP总抗氧化能力结果如图4所示,5种提取物的总抗氧化能力顺序为乙酸乙酯提取物(E3)>二氯甲烷提取物(E4)>乙醇提取物(E2)>石油醚提取物(E5)>水提取物(E1),乙酸乙酯提取物与Trolox的抗氧化能力最为接近,达到0.69 mg Trolox·mg-1。
2.2 "提取物的抑菌活性
2.2.1 "抑菌圈直径
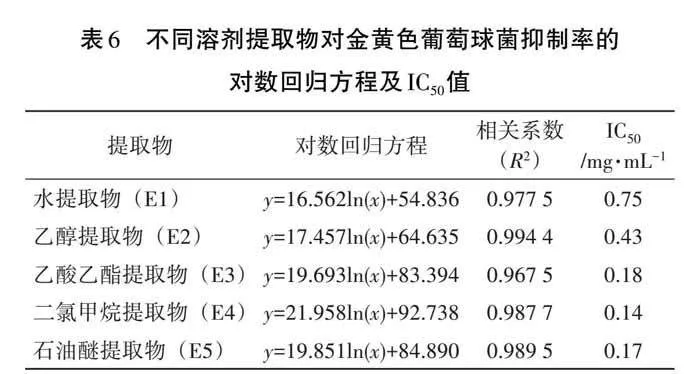
5种提取物抑菌圈直径的测定结果如表5,抑菌圈直径越大说明抑菌性越好。参考文献[22-23],说明5种提取物均对金黄色葡萄球菌显示出一定的抑菌活性,其中水提取物(E1)的抑菌圈直径仅为5.63±0.21 mm,抑菌效果不明显,而其他提取物的抑菌圈直径均大于10 mm,抑菌效果较好,其中二氯甲烷提取物(E4)的抑菌效果最佳。
2.2.2 "抑菌率
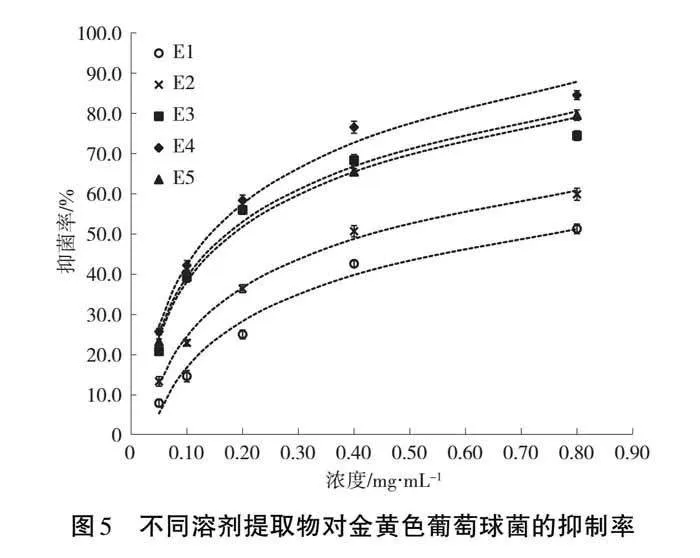
抑菌率可作为评价样品抑菌能力的参考指标并被广泛应用[24-26],5种提取物的抑菌率测定结果如图5,抑菌率与浓度呈正相关。抑菌率与提取物浓度的对数回归方程和IC50值见表6。由图5和表6可知,氯甲烷提取物(E4)、乙酸乙酯提取物(E3)和石油醚提取物(E5)对金黄色葡萄球菌的抑制能力相对较强,其IC50值分别为0.14、0.17、0.18 mg·mL-1;而乙醇提取物(E2)和水提取物(E1)的抑制能力相对偏弱,其IC50值分别为0.43、0.75 mg·mL-1。
3 "小结
本研究采用水、乙醇、乙酸乙酯、二氯甲烷和石油醚等5种不同极性的溶剂分别对扁桃斑鸠菊叶进行浸提,对所得提取物进行了体外抗氧化活性和抗菌性试验。DPPH自由基清除率、ABTS自由基清除率和FRAP总抗氧化能力试验结果表明所得提取物均有一定的抗氧化性,3种试验结果具有较大的一致性,其中乙酸乙酯提取物(E3)的抗氧化性最佳,水提取物(E1)最差,乙醇提取物(E2)、二氯甲烷提取物(E4)和石油醚提取物(E5)在3种试验中的结果虽不一致,但差异不大。抑菌圈直径和抑菌率测定结果高度一致,二氯甲烷提取物(E4)的抑菌能力最强,石油醚提取物(E5)、乙酸乙酯提取物(E3)与其较为接近,但乙醇提取物(E2)和水提取物(E1)的抑菌能力相对偏低。分析不同溶剂提取物的抗氧化性和抑菌性存在差异的原因,可能是相应功能活性成分不同,极性也有所不同,导致在不同极性溶剂中的溶出率不一致;而乙醇提取物(E2)、二氯甲烷提取物(E4)和石油醚提取物(E5)在3种不同抗氧化性试验中表现出的不一致性,可能是3种试验的作用机制不同而导致的。总体上看,极性小的溶剂所得提取物的抗氧化性和抑菌性更好,这与Tian等[27]的研究结果相似。研究结果可为后续选择溶剂对扁桃斑鸠菊叶进行提取并进一步分离纯化筛选高效抗氧化及抗菌活性成分提供参考,对扁桃斑鸠菊资源的开发和利用具有积极的指导意义。
参考文献:
[1] " 王子恒,赵孝俊,陈巡,等.新外来中药南非叶的文献研究及中药药性探讨[J].中国中药杂志,2023,48(8):2265-2271.
[2] ADODO A, IWU M M. Healing plants of Nigeria: ethnomedicine and therapeutic applications[M]. Boca Raton, Florida: CRC Press, 2020.
[3] OGWU M C, IKHAJIAGBE B. Vernonia amygdalina Delile (asteraceae): an overview of the phytochemical constituents, nutritional characteristics, and ethnomedicinal values for sustainability in herbal medicine phytochemistry[M]. Switzerland: Springer Cham, 2024.
[4] " YEDJOU C G, SIMS J N, NJIKI S, et al. Vernonia amygdalina Delile exhibits a potential for the treatment of acute promyelocytic leukemia[J]. Glob J Adv Eng Technol Sci, 2018, 5(8):1-9.
[5] " ADEYEMI O O, ALABI A S, ADEYEMI O A, et al. Acute gastroenteritis and the usage pattern of antibiotics and traditional herbal medications for its management in a Nigerian community[J]. PloS One, 2021, 16(10):e0257837.
[6] " 黄敏桃,庞小莉,杨林芳,等.正交试验法优化南非叶抑菌活性成分提取工艺[J].南方农业,2021,15(34):84-87,91.
[7] " AMAEZE O U, ADEREMI-WILLIAMS R I, AYO-VAUGHAN M A, et al. Herbal medicine use among Type 2 diabetes mellitus patients in Nigeria: understanding the magnitude and predictors of use[J].International Journal of Clinical Pharmacy,2018,40(3):580-588.
[8] " UGBOGU E A, EMMANUEL O, DIKE E D,et al.The Phytochemistry, Ethnobotanical, and Pharmacological potentials of the medicinal plant-Vernonia amygdalina L. (bitter Leaf)[J]. Clinical Complementary Medicine and Pharmacology, 2021, 1(1): 100006.
[9] " GREAT I E, PRINCESS O S, AGATHA N J, et al. Biological and bioactive components of bitter leaf (Vernonia amygdalina leaf): Insight on health and nutritional benefits. A review[J]. Food Chemistry Advances, 2023, 3:100488.
[10] 赵梦灵.扁桃斑鸠菊化学成分及其生物活性研究[D].南京:南京师范大学,2021.
[11] 刘祥忠,卢茜,何守伦,等.扁桃斑鸠菊中木脂素类化合物的分离与鉴定[J].中国药物化学杂志, 2020,30(12):738-744.
[12] 管磬馨,胡文忠,张越,等.Advances in research on active constituents and anticancer effects of South African leaves[C]//中国食品科学技术学会(Chinese Institute of Food Science and Technology).中国食品科学技术学会第十六届年会暨第十届中美食品业高层论坛论文摘要集.武汉:2019.
[13] 秦小桐,曹昱莹,居瑞军,等.虎杖根不同溶剂提取物的抗氧化活性研究[J].现代化工,2024,44(4):128-133.
[14] 许丹丹,徐雅琴,隽行,等.富硒菊芋多糖的提取及其体外抗氧化活性研究[J].中国农学通报,2021,37(30):121-127.
[15] IONITA P. The chemistry of dpph· free radical and congeners[J]. International Journal of Molecular Sciences, 2021: 22(4):1545.
[16] ARAB K, GHANBARZADEH B, AYASEH A,et al. Extraction, purification, physicochemical properties and antioxidant activity of a new polysaccharide from Ocimum album L. seed[J]. International Journal of Biological Macromolecules,2021,180: 643-653.
[17] 朱玉昌,焦必宁.ABTS法体外测定果蔬类总抗氧化能力的研究进展[J].食品与发酵工业,2005(8):77-80.
[18] 樊海燕,蔡云飞,杨彭鹏,等.ABTS法和DPPH法测定锁阳多糖抗氧化活性的适用性[J].光谱学与光谱分析,2023,43(S1):315-316.
[19] 杨青,宁子琨,曾雁枝,等.啤酒FRAP抗氧化活性评价方法及应用[J].中外酒业,2023(19):14-25.
[20] 王荣,罗倩,冯怡.DPPH、ABTS和FRAP微量法测定山奈酚的抗氧化能力[J].广州化工,2021,49(3):58-59,63.
[21] 恽祥惠,邢丽娜,李云,等.建立基于96孔板检测的FRAP法和DPPH法及其在橘核抗氧化活性研究中的应用[J].时珍国医国药,2014,25(5):1275-1278.
[22] 鲁俊廷.不同中药及其复方对奶牛乳房炎金黄色葡萄球菌的体外抑菌效果[J].养殖与饲料,2024,23(6):16-20.
[23] 刘博洋,朱美齐,李泽宇,等.大兴安岭森林凋落物真菌及其次生代谢物活性研究[J].中国农学通报,2019,35(29):103-108.
[24] 程梦丽,姜广路,霍凤敏,等.夫西地酸对分枝杆菌的体外抑菌效果评价[J].中国防痨杂志,2024,46(4):461-466.
[25] 陈文丹,白玉莹,郭成虎,等.黄花蒿精油抑菌、抗氧化及毒理学特性研究[J].食品工业科技,2024,45(7):44-50.
[26] 刘俊俊,田佳仪,李坤,等.7种中药提取物体外抑制金黄色葡萄球菌的效果及机制研究[J].畜牧与兽医,2024,56(6):130-138.
[27] TIAN F, LI B, JI B P, et al.Antioxidant and antimicrobial activities of consecutive extracts from Galla chinensis:The polarity affects the bioactivities[J].Food Chemistry,2009:113(1):173-179.
(责任编辑:易 "婧)

