A群C群脑膜炎球菌多糖结合疫苗和乙肝疫苗同时接种后疑似预防接种异常反应监测分析
【摘 要】目的:评价A群C群脑膜炎球菌多糖结合疫苗(group A and group C meningococcal polysaccharide conjugate vaccine,MPCV-AC)和乙型肝炎疫苗(hepatitis B vaccine,HepB)同时接种后的安全性。方法:通过国家免疫规划信息系统和安徽省免疫规划信息管理系统分别收集2020年至2022年安徽省适龄儿童MPCV-AC和HepB的疑似预防接种异常反应(adverse events following immunization,AEFI)数据和预防接种数据,比较2种疫苗同时接种和单独接种的AEFI的发生风险。结果:MPCV-AC第1剂次和HepB第3剂次同时接种、MPCV-AC第1剂次单独接种、HepB第3剂次单独接种的AEFI报告发生率分别为48.03/ 10万(280例)、56.37/10万(314例)、51.96/10万(283例);其中一般反应分别为43.91/10万(256例)、51.35/10万(286例)、48.65/ 10万(265例),异常反应分别为4.12/10万(24例)、4.85/10万(27例)、3.30/10万(18例)。同时接种组、单独接种组的AEFI发生风险、一般反应及异常反应的发生风险差异均无统计学意义。结论:MPCV-AC和HepB同时接种未增加AEFI的发生风险,可作为6月龄儿童同时接种MPCV-AC和HepB的科学依据。
【关键词】AC结合疫苗;乙肝疫苗;同时接种;疑似预防接种异常反应
【中图分类号】R186【文献标志码】A【收稿日期】2024-04-09
基金项目:中国肝炎防治基金会中国乙肝防控科研基金资助项目(编号:YGFK20230119)。
Surveillance analysis of adverse events following co-immunization of group A and group C meningococcal polysaccharide conjugate vaccine and hepatitis B vaccine
Wang Binbing1,Xue Wenqing1,Meng Fanya1,Tang Jihai2,Luo Xianwei1,Su Ying1,Dong Yan1,Wang Junping1
(1. Department of Immunoprophylaxis,Anhui Provincial Center for Disease Control and Prevention;2. Center for Clinical Evaluation of Vaccines,Anhui Provincial Center for Disease Control and Prevention)
【Abstract】Objective:To assess the safety of co-immunization of group A and group C meningococcal polysaccharide conjugate vac‐cine (MPCV-AC) and hepatitis B vaccine(HepB). Methods:The data on adverse event following immunization(AEFI) and vaccina‐tion with MPCV-AC and HepB among age-eligible children in Anhui Province,China from 2020 to 2022 were obtained through the National Immunization Information System and Anhui Provincial Immunization Information System. The reported incidence rates of AEFI were compared among children who received the two vaccines simultaneously and separately. Results:The reported incidence rates of AEFI were 48.03/105(280 cases) following co-immunization of MPCV-AC (1st dose) and HepB(3rd dose),56.37/105(314 cases) following MPCV-AC(1st dose),and 51.96/105(283 cases) following HepB(3rd dose). The incidence rates of common reactions in the three groups were 43.91/105(256 cases),51.35/105(286 cases),and 48.65/105(265 cases),respectively;the incidence rates of adverse events in the three groups were 4.12/105 (24 cases),4.85/105(27 cases),and 3.30/105(18 cases),respectively. There were no significant differences between the co-immunization group and the separate vaccination groups in the risk of AEFI,common reactions,and adverse events.Conclusion:Co-immunization of MPCV-AC and HepB does not increase the risk of AEFI,which can serve as a scientific basis for co-immunization of MPCV-AC and HepB in 6-month-old children.
【Key words】group A and group C meningococcal polysaccharide conjugate vaccine;hepatitis B vaccine;co-immunization;adverse event following immunization
A群C群脑膜炎球菌多糖结合疫苗(group A and group C meningococcal polysaccharide conjugate vaccine,MPCV-AC)对婴幼儿具有较好的免疫原性和持久性[1],是在全国广泛应用的非免疫规划疫苗[2-3]。MPCV-AC仅在中国生产并使用[4],基础免疫起始月龄与国家免疫规划疫苗乙肝疫苗(hepatitis B vaccine,HepB)第3剂次接种起始月龄均为6月龄[5-6],可以考虑通过同时接种,简化免疫程序、提高疫苗接种率[7]。目前国家免疫规划疫苗可以同时接种[6],而免疫规划疫苗和非免疫规划疫苗之间是否能够同时接种需要基于最新证据[8],虽然MPCV-AC和HepB均有多项国内研究报道其单独接种后的良好安全性[9-13],但MPCV-AC和HepB同时接种的安全性尚缺乏国内外相关研究。疫苗同时接种的安全性证据不足,在免疫规划的实施中,可能导致6月龄婴幼儿的MPCV-AC接种不及时。安徽省于2010年起将MPCV-AC纳入免疫规划[14],开展了大规模MPCV-AC和HepB同时接种实践,本研究通过分析2020-2022年安徽省内MPCV-AC单独接种、HepB单独接种和MPCV-AC与HepB同时接种后报告的疑似预防接种异常反应(adverse events following immunization,AEFI)监测数据,以评估2种疫苗同时接种的安全性,为2种疫苗同时接种提供科学依据。
1 资料与方法
1.1 疫苗和免疫程序
本研究纳入分析的MPCV-AC为罗益(无锡)生物制药有限公司生产,HepB为深圳康泰生物制品股份有限公司、艾美汉信疫苗(大连)有限公司等生产,包括汉逊酵母、酿酒酵母、CHO细胞乙肝疫苗。MPCV-AC基础免疫接种2针,6月龄开始接种第1剂次,间隔1月接种第2剂次;HepB基础免疫程序为3针,分别在第0、1、6月接种,新生儿第1针在出生后24 h内注射。按照免疫程序,同时接种情形是在儿童6月龄时,同一天内接种了MPCV-AC第1剂次和HepB第3剂次。
1.2 数据来源
采用横断面描述性研究,纳入2020年1月1日至2022年12月31日在安徽省接种免疫规划疫苗MPCV-AC第1剂次和/或HepB第3剂次的符合接种起始月龄(6月龄)且无接种禁忌儿童的AEFI数据和预防接种数据。AEFI数据来源于国家免疫规划信息系统所收集的AEFI被动监测资料,收集变量包括受种者性别、出生日期、接种日期、AEFI分类、临床症状、严重程度、反应发生间隔等。预防接种数据来源于安徽省免疫规划信息管理系统,收集变量包括受种者性别、出生日期、接种疫苗种类、剂次、接种日期等。
1.3 方法
安徽省AEFI的监测与处置工作遵循《全国疑似预防接种异常反应监测方案》(2022年版),以省(区、市)为单位,每年开展相关业务培训及监测数据审核订正工作以保证监测数据质量。具体的定义、报告、调查诊断和分类等如下所述。①AEFI及严重AEFI的定义:AEFI是指在预防接种后发生的怀疑与预防接种有关的反应或事件,严重AEFI是指有以下情形之一者:死亡、危及生命、需要住院治疗或延长已在住院治疗的时间、持续的或显著的人体伤残/失能、先天性异常或者出生缺陷(怀疑受种者母亲孕期接种疫苗所致),以及如不干预或者治疗可能出现上述所列情况的情形。②AEFI报告:AEFI报告范围按照发生时限(24 h内、5 d内、15 d内、6周内、3个月内、接种卡介苗后1~12月)分为不同情形,医疗机构、接种单位等责任报告单位和报告人发现AEFI(包括接到受种者或其监护人的报告)后,应当及时填写AEFI个案报告卡,向受种者所在地的县级CDC报告,县级CDC经核实后立即通过全国预防接种信息管理系统进行网络直报。③AEFI调查诊断:除明确诊断的一般反应外的AEFI均需调查。省级、设区的市级和县级CDC应当成立预防接种异常反应调查诊断专家组,负责预防接种异常反应调查诊断。调查诊断专家组依据法律法规、部门规章和技术规范,结合临床表现、医学检查结果等进行综合分析,作出调查诊断结论,对AEFI进行分类。对调查诊断结论有争议的,可以根据相关鉴定办法申请鉴定。④AEFI分类:AEFI按照发生原因分为不良反应(包括一般反应和异常反应)、疫苗质量事故、接种事故、偶合症、心因性反应。
1.4 统计学方法
本研究中同时接种组为同一天内接种MPCV-AC第1剂次和HepB第3剂次,MPCV-AC单独接种组为单独接种MPCV-AC第1剂次,HepB单独接种组为单独接种HepB第3剂次。统计分析内容为按性别、反应分类、发生时间间隔、临床症状、严重程度对各组别AEFI的报告例数及报告发生率/构成比进行统计描述(AEFI报告发生率(/10万剂)=报告AEFI数/接种剂次数×10万剂次);同时,以同时接种组为参照,采用Poisson回归模型估计HepB单独接种组及MPCVAC单独接种组AEFI发生的相对风险(relative risk,RR)。所有统计学分析均通过SAS 9.4进行。检验水准α=0.05。
2 结 果
2.1 AEFI报告情况
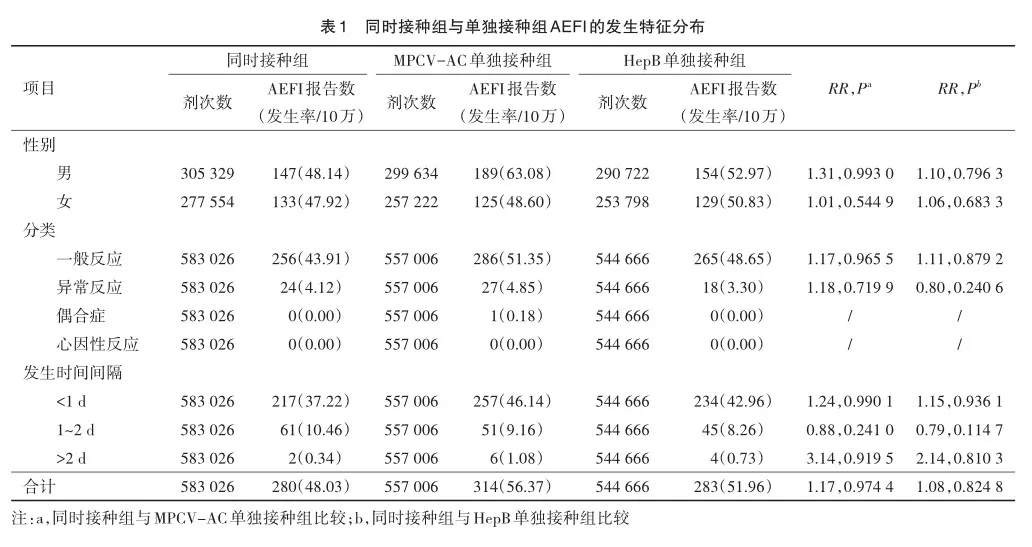
2020年1月至2022年12月,同时接种组接种583 026剂次,AEFI报告280例,AEFI报告发生率为48.03/10万;MPCV-AC单独接种组接种557 006剂次,AEFI报告314例,AEFI报告发生率为56.37/10万;HepB单独接种组接种544 666剂次,AEFI报告283例,AEFI报告发生率为51.96/10万。同时接种组AEFI的发生风险与MPCV-AC单独接种组(RR= 1.17,P=0.974 4)、HepB单独接种组(RR=1.08,P=0.824 8)相比差异均无统计学意义。
2.2 AEFI发生特征
从性别分布来看,男性中,同时接种组、MPCV-AC单独接种组、HepB单独接种组的AEFI报告发生率分别为48.14/ 10万、63.08/10万、52.97/10万;女性中,3组AEFI报告发生率分别为47.92/10万、48.60/10万、50.83/10万。无论是在男性还是女性受种者中,同时接种组AEFI的发生风险与MPCVAC单独接种组、HepB单独接种组相比,差异均无统计学意义。AEFI分类中,3组的一般反应报告发生率分别为43.91/10万、51.35/10万、48.65/10万;异常反应报告发生率分别为4.12/ 10万、4.85/10万、3.30/10万。一般反应及异常反应中,同时接种组AEFI的发生风险与另外2组相比,差异均无统计学意义。3组中,AEFI发生均以接种后1 d以内居多,分别占比77.50%、81.85%、82.69%,报告发生率分别为37.22/10万、46.14/10万、42.96/10万,差异无统计学意义,见表1。
2.3 AEFI临床症状分布
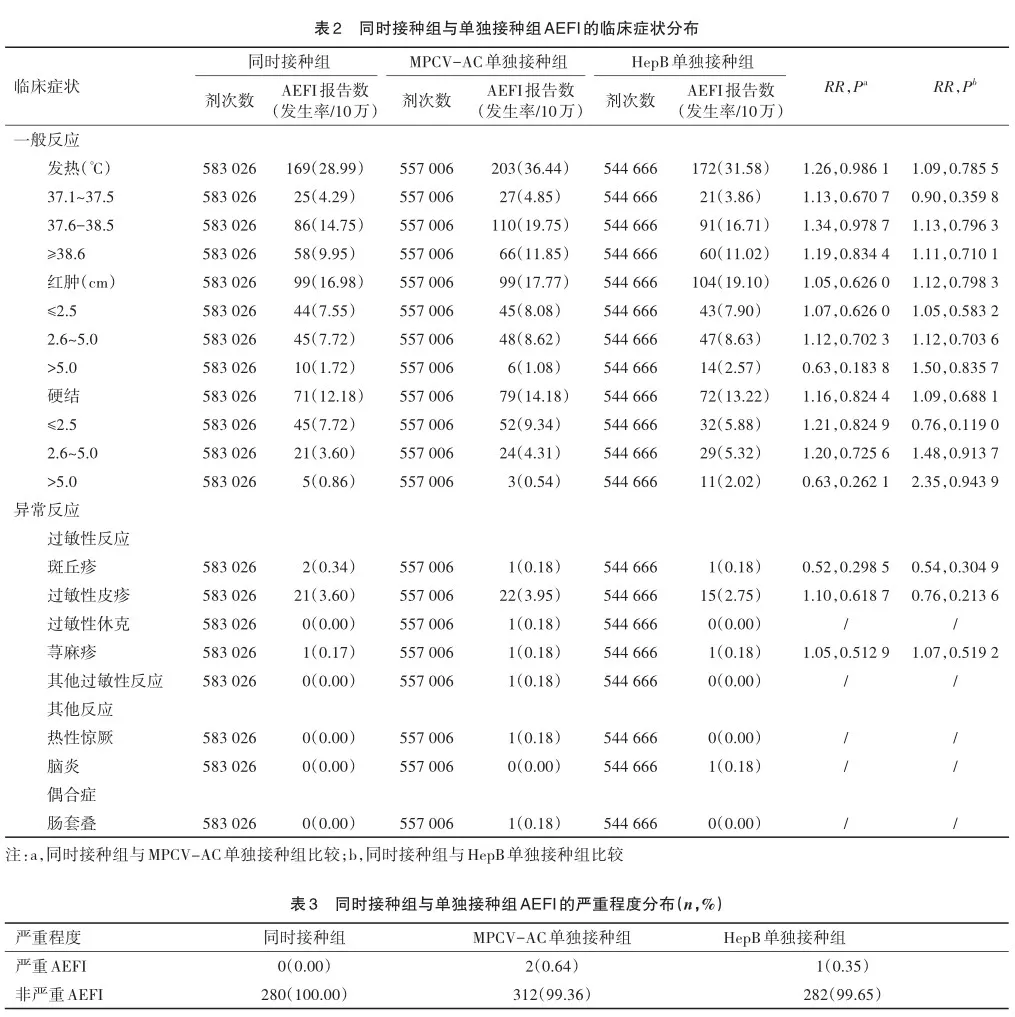
一般反应中,同时接种组、MPCV-AC单独接种组、HepB单独接种组的发热报告发生率分别为28.99/10万、36.44/10万、31.58/10万;红肿报告发生率分别为16.98/10万、17.77/10万、19.10/10万;硬结报告发生率分别为12.18/10万、14.18/10万、13.22/10万。异常反应中,过敏性皮疹报告发生率分别为3.60/10万、3.95/10万、2.75/10万;斑丘疹报告发生率分别为0.34/10万、0.18/10万、0.18/10万。同时接种组各临床症状的发生风险与另外2组相比,差异无统计学意义。见表2。
2.4 AEFI严重程度分布
同时接种组、MPCV-AC单独接种组、HepB单独接种组中严重AEFI的构成比分别为0.00%、0.64%、0.35%。见表3。
3 讨 论
同时接种是指同一次接种时间在不同的解剖部位或以不同接种途径接种一种以上的疫苗,多种疫苗同时接种,能够简化免疫程序,提高接种率,向受种者提供更多疾病保护,减轻接种人员工作量,是预防接种的未来发展趋势[7]。我国流脑疫苗基础免疫中使用非免疫规划疫苗MPCV-AC替代A群脑膜炎球菌多糖疫苗(meningococcal polysaccharide vaccine,MPSV-A)较为常见[2-3],若具备明确依据,在完成6月龄儿童基础免疫的过程中,可考虑将MPCV-AC和HepB同时接种,以便捷接种安排、促进及时接种。安徽省自2010年将MPCV-AC纳入免疫规划以来,至今为国家唯一执行此免疫策略的省份,由于MPCV-AC和HepB在安徽省内均为免疫规划疫苗,同时接种情形较为普遍,据此,基于安徽省内开展的大规模MPCV-AC和HepB同时接种实践,开展本次研究。
本研究中,通过回顾性调查2020-2022年安徽省接种监测和AEFI被动监测数据发现,同时接种MPCV-AC第1剂次和HepB第3剂次AEFI的发生风险与单独接种MPCV-AC第1剂次、HepB第3剂次相比差异无统计学意义,其中,一般反应和异常反应发生风险均无显著性差异;AEFI大多数出现于接种后1 d内。研究结果显示,对比单独接种MPCV-AC第1剂次、HepB第3剂次,婴幼儿同时接种MPCV-AC第1剂次和HepB第3剂次后AEFI发生风险并未升高。
上述同时接种后报告的AEFI临床表现以一般反应为主,多为发热、红肿和硬结;异常反应少见,多为过敏性反应,以过敏性皮疹为主,与既往的国内单独接种MPCV-AC、HepB后安全性观察研究报道一致[15-18]。同时接种后未报告严重AEFI,但需要注意的是,在单独接种MPCV-AC后分别出现1例过敏性休克、1例热性惊厥,单独接种HepB后出现1例脑炎等异常反应,提示需要做好同时接种后AEFI的监测和处置。
临床实践和试验证据证明,同时接种疫苗不会增加疫苗不良反应风险[19],世界卫生组织和美国免疫实施咨询委员会均支持为没有特定禁忌证的儿童同时接种多种疫苗[20-21]。我国免疫规划疫苗之间可以同时接种,免疫规划疫苗和非免疫规划疫苗之间、非免疫规划疫苗之间能否同时接种,要依据最新证据确定。既往国内已有多项、多类疫苗同时接种的回顾性调查显示同时接种并未增加不良反应发生风险[22-24],国内关于婴幼儿同时接种HepB和流脑多糖疫苗后的安全性也有相关研究,袁承德等[25]在血源性乙肝疫苗(HepB-B)和MPSV-A 同时接种的免疫原性和安全性观察中证实,两者同时接种不会增加不良反应发生率,本研究结果同样表明,HepB和MPCV-AC同时接种亦未增加AEFI发生风险。
流脑是免疫规划疫苗可预防疾病中经济负担较重的病种[26],6个月~2岁的婴幼儿是流脑高危人群[27],做好该人群的免疫预防,需要将免疫原性和持久性较好的脑膜炎球菌多糖结合疫苗推进纳入免疫规划[28],同时在儿童年龄达到接种起始月龄后应尽早接种流脑疫苗[28]。儿童满6月龄后,将同时达到免疫规划疫苗HepB和免疫规划疫苗MPSV-A的基础免疫起始月龄,若监护人选择使用非免疫规划疫苗MPCV-AC替代MPSV-A接种,儿童需要分别接种HepB和MPCV-AC,并且按照免疫规划疫苗优先的原则[6],MPCV-AC接种日期应迟于HepB,造成儿童及其监护人往返接种的时间成本增加、推迟接种等不利影响。本项研究结果作为国内唯一开展的MPCV-AC与HepB同时接种安全性相关研究,通过真实世界中长期、大规模的接种后AEFI监测,证实6月龄婴幼儿同时接种2种疫苗未增加不良反应风险,可作为明确依据,供接种人员对无接种禁忌儿童实施MPCV-AC与HepB同时接种的参考,从而简化儿童免疫程序,促进疫苗及时接种,优化免疫服务。
本研究存在一定的局限性:安徽省AEFI监测敏感性在近年较为稳定[29],但是客观上被动监测敏感性偏低[30];安徽省免疫规划疫苗MPCV-AC应用种类较为单一,未能涵盖所有已上市疫苗品种等,今后可以通过优化研究方案,进行前瞻性调查等方式,进一步开展2种疫苗同时接种的安全性相关研究,此外,基于2种疫苗同时接种可以带来接种率和接种效率的获益,后续可以开展2种疫苗同时接种后免疫原性相关研究,进一步验证同时接种的效果,为接种人员同时接种提供更加充分的依据。
参 考 文 献
[1] Vesikari T,Karvonen A,Bianco V,et al. Tetravalent meningococ‐cal serogroups A,C,W-135 and Y conjugate vaccine is well tolerated and immunogenic when co-administered with measles-mumps-rubellavaricella vaccine during the second year of life:an open,randomized controlled trial[J]. Vaccine,2011,29(25):4274-4284.
[2] 王 琴,陈俊磊,潘伟毅. 2014—2020年福建省非免疫规划疫苗使用情况监测分析[J]. 中国生物制品学杂志,2023,36(7):815-819. Wang Q,Chen JL,Pan WY. Monitoring and analysis of use of nonnational immunization program vaccines in Fujian Province from 2014 to 2020[J]. Chin J Biol,2023,36(7):815-819.
[3] 马雅婷,白祎然,路明霞,等. 2010—2020年河南省非免疫规划疫苗接种现状[J]. 河南预防医学杂志,2021,32(9):673-676. Ma YT,Bai YR,Lu MX,et al. Status of vaccination with non-expanded program on immunization vaccines in Henan Province,2010-2020[J]. Henan J Prev Med,2021,32(9):673-676.
[4] 孟清霞,许项可,安文珏,等. 脑膜炎球菌多糖结合疫苗的研究进展[J]. 中国生物制品学杂志,2024,37(3):370-375. Meng QX,Xu XK,An WJ,et al. Advances in meningococcal polysac‐charide conjugate vaccine research[J]. Chin J Biol,2024,37(3):370-375.
[5] 罗益(无锡)生物制药有限公司. A群C群脑膜炎球菌多糖结合疫苗?说明书[Z]. 2015-12-31. ROYAL(WUXI) BIO-PHARMACEUTICAL CO.,LTD. Group A and Group C Meningococcal Conjugate Vaccine Instructions[Z]. 2015-12-31.
[6] 国家疾病预防控制局. 国家卫生健康委关于印发国家免疫规划疫苗儿童免疫程序及说明(2021年版)的通知[EB/OL].(2021-03-12) [2023-10-08]. http://www.nhc.gov.cn/jkj/s3581/202103/590a8c791 5054aa682a8d2ae8199e222.shtml. National Disease Control and Prevention Administration. Circular of the National Health Commission of the People’s Republic of China on the Issuance of National Immunization Programme Vaccines Immunization Procedures and Instructions for Children(2021 Edition)[EB/OL].(2021-03-12) [2023-10-08]. http://www.nhc.gov.cn/jkj/s3581/202103/590a8c 7915054aa682a8d2ae8199e222.shtml.
[7] 中国疫苗行业协会免疫服务指导与评价专业委员会. 0~12月龄儿童联合疫苗使用和同时接种专家共识[J]. 中华流行病学杂志,2022,43(8):1171-1177. China Vaccine Industry Association immunization service guidance and evaluation committee. Expert consensus on the use of combination vac‐cine and simultaneous immunization in children aged 0-12 months[J]. Chin J Epidemiol,2022,43(8):1171-1177.
[8] 国家疾病预防控制局. 国家卫生健康委办公厅关于印发非免疫规划疫苗使用指导原则(2020年版)的通知[EB/OL].(2020-12-14)[2022-03-12]. .http://www.nhc.gov.cn/jkj/s3581/202012/9b76584336a1 483cbece7edd0abb2a7e.shtml. National Disease Control and Prevention Administration. Circular of the National Health Commission of the People’s Republic of China on the Guidelines for the use of Non-Immunization-Programme Vaccines(2020 Edition)[EB/OL].(2020-12-14) [2022-03-12]. .http://www.nhc. gov.cn/jkj/s3581/202012/9b76584336a1483cbece7edd0abb2a7e.shtml.
[9] 王彦霞,王 雪,黄海涛,等. 3-23月龄儿童接种A群C群脑膜炎球菌多糖结合疫苗的安全性Ⅲ期临床试验[J]. 中国疫苗和免疫,2022,28(4):440-445. Wang YX,Wang X,Huang HT,et al. Safety of a group A and group C meningococcal polysaccharide conjugate vaccine among 3-23-monthold children:a phase Ⅲ clinical trial[J]. Chin J Vaccines Immun,2022,28(4):440-445.
[10] 施礼威,梁馨元,李红华,等. 冻干A群C群脑膜炎球菌多糖结合疫苗在3~8月龄健康婴幼儿人群中的免疫原性和安全性评价[J].中国生物制品学杂志,2020,33(3):297-301,307. Shi LW,Liang XY,Li HH,et al. Immunogenicity and safty of freezedried groups A and C meningococcal polysaccharide conjugate vaccine in healthy infants at ages of 3 - 8 months[J]. Chin J Biol,2020,33(3):297-301,307.
[11] 黄园嫣,廖玉宜,刘超群,等. 国产重组乙型肝炎疫苗(酿酒酵母)的安全性、免疫效果及社会效益研究进展[J]. 华南预防医学,2023,49(3):263-267. Huang YY,Liao YY,Liu CQ,et al. Research progress on safety,im‐mune effect,and social benefit of domestic recombinant hepatitis B vac‐cine(Saccharomyces cerevisiae)[J]. South China J Prev Med,2023,49(3):263-267.
[12] 张 岷,康国栋,马燕丽,等. 重组乙型肝炎疫苗(酿酒酵母)上市后安全性的临床观察[J]. 中国生物制品学杂志,2016,29(11):1183-1186. Zhang M,Kang GD,Ma YL,et al. Post-marketing study on safety of re‐combinant hepatitis B vaccine(Saccharomyces cerevisiae)[J]. Chin J Biol,2016,29(11):1183-1186.
[13] 韩 芳,张复臣,马翠荣. 菏泽市接种乙肝疫苗和A+C流脑结合疫苗偶合中枢神经系统感染死亡病例的调查分析[J]. 安徽预防医学杂志,2017,23(6):446-447,451. Han F,Zhang FC,Ma CR. Investigation and analysis of inoculation of hepatitis B vaccine and A + C vaccine combined with meningococcal meningitis death cases coupled with central nervous system infection[J]. Anhui J Prev Med,2017,23(6):446-447,451.
[14] 王斌冰,毛雷婧,罗献伟,等. 2004—2019年安徽省0~2岁儿童流行性脑脊髓膜炎流行病学特征[J]. 实用医学杂志,2021,37(12):1613-1618. Wang BB,Mao LJ,Luo XW,et al. Current epidemiological analysis of epidemic cerebrospinal meningitis cases among children aged 0?2 years in Anhui Province,2004-2019[J]. J Pract Med,2021,37(12):1613-1618.
[15] 章 冰,王少芳,夏志才,等. 宣城市A+C群脑膜炎球菌结合疫苗接种后不良反应观察[J]. 公共卫生与预防医学,2015,26(4):78-80. Zhang B,Wang SF,Xia ZC,et al. Observation on adverse reactions of group A+C meningococcal conjugated vaccine in Xuancheng city[J]. J Public Health Prev Med,2015,26(4):78-80.
[16] 崔雪莲,吴 昕,黎明强,等. 大规模冻干A+C群脑膜炎球菌多糖结合疫苗接种后安全性观察[J]. 现代预防医学,2015,42(1):143-146. Cui XL,Wu X,Li MQ,et al. The safety of freeze-dried group A/C me‐ningococcal polysaccharide conjugate vaccine after the mass immuniza‐tion in infant and children in Liuzhou City,China[J]. Mod Prev Med,2015,42(1):143-146.
[17] 陈秋婷,黄彩虹,曾珊珊,等. 泉州市2015—2020年乙肝疫苗疑似预防接种异常反应监测分析[J]. 海峡预防医学杂志,2022,28(2):28-30. Chen QT,Huang CH,Zeng SS,et al. Analysis on surveillance results of adverse events following immunization for hepatitis B vaccine in Quan‐zhou City,2015-2020[J]. Strait J Prev Med,2022,28(2):28-30.
[18] 杜冰会,杨凯朝,史鲁斌,等. 2017—2021年河南省乙型肝炎疫苗疑似预防接种异常反应监测分析[J]. 河南预防医学杂志,2023,34(1):72-76. Du BH,Yang KC,Shi LB,et al. Analysis on the surveillance data of ad‐verse events following immunization with hepatitis B vaccine in Henan Province between 2017and 2021[J]. Henan J Prev Med,2023,34(1):72-76.
[19] Damon RA. Routine simultaneous administration of childhood vaccines[J]. JAMA,1990,263(4):516.
[20] World Health Organization. Vaccines and immunization: What is vaccination?[EB/OL]. (2024-04-23)[2024-05-24].https://www.who.int/ news-room/questions-and-answers/item/vaccines-and-immunizationwhat-is-vaccination.
[21] Kroger AT,Duchin JS,Vazquez M. General best practice guide‐lines for immunization: best practices guidance if the Advisory Commit‐tee on Immunization Practices(ACIP)[EB/OL].(2021-03-12)[2023-10-08]. https://stacks.cdc.gov/view/cdc/46256.
[22] 吕 敏,苗 良,温小菁,等. 北京市适龄儿童13价肺炎球菌多糖结合疫苗和口服五价轮状病毒减毒活疫苗同时接种的上市后安全性监测[J]. 中国疫苗和免疫,2022,28(2):219-223. Lv M,Miao L,Wen XJ,et al. Post-marketing safety of coadministration of 13-valent pneumococcal polysaccharide conjugate vaccine and oral pentavalent rotavirus attenuated live vaccine in ageeligible children in Beijing[J]. Chin J Vaccines Immun,2022,28(2):219-223.
[23] 林 琳,付思美,田 鑫,等. 吉林省2020—2021年适龄婴儿脊髓灰质炎灭活疫苗和无细胞百白破联合疫苗单独和同时接种的不良反应发生率[J]. 中国疫苗和免疫,2022,28(4):446-450. Lin L,Fu SM,Tian X,et al. Incidences of adverse reactions following standalone and simultaneous vaccination with inactivated poliovirus vac‐cine and diphtheria,tetanus and acellular combined vaccine among ageeligible infants of Jilin Province in 2020-2021[J]. Chin J Vaccines Im‐mun,2022,28(4):446-450.
[24] 蒋蕊鞠,殷琼洲,徐明珏,等. 冻干甲型肝炎减毒活疫苗与免疫规划疫苗同时接种疑似预防接种异常反应监测数据分析[J]. 中国药物警戒,2020,17(10):710-714,719. Jiang RJ,Yin QZ,Xu MJ,et al. Adverse events induced by immuniza‐tion of concomitant inoculation of freeze-dried hepatitis a(live) vaccine with vaccines for national immunization program from surveillance data[J]. Chin J Pharmacovigil,2020,17(10):710-714,719.
[25] 袁承德,迮文远,杨进业,等. 乙型肝炎疫苗与婴儿期常用疫苗同时接种的免疫应答与反应观察:Ⅰ. 乙型肝炎疫苗与白百破混合疫苗、脊髓灰质炎活疫苗同时接种的免疫应答与反应观察[J]. 中华流行病学杂志,1989,10(4):206-209. Yuan CD,Ze WY,Yang JY,et al. Immune response and reactions to si‐multaneous administration of hepatitis B vaccine with routine vaccine in childrenⅰ. immune response and reactions to simultaneous administra‐tion of DPT,TOPV and hepatitis B vaccine[J]. Chin J Epidemiol,1989,10(4):206-209.
[26] 陈媛美,刘 锦,朱传武,等. 乙型肝炎病毒整合DNA在慢性乙型肝炎中的作用研究进展[J]. 中华肝脏病杂志,2024,32(2):164-167. Chen YM,Liu J,Zhu CW,et al. Research progress on the role of hepati‐tis B virus DNA integration in chronic hepatitis B[J]. Chin J Hepatol,2024,32(2):164-167.
[27] 李兰娟,任红. 传染病学[M]. 8版. 北京:人民卫生出版社,2013:207-212. Li LJ,Ren H. Infectious diseases[M]. 8th ed. Beijing:People’s Medical Publishing House,2013:207-212.
[28] Chinese Preventive Medicine Association. 中国脑膜炎球菌疫苗预防接种专家共识[J]. 中国疫苗和免疫,2019,25(1):96-101. Association CPM. Experts’ consensus on immunization with meningo‐coccal vaccines in China[J]. Chin J Vaccines Immun,2019,25(1):96-101.
[29] 孟凡亚,史四九,王斌冰,等. 2017—2021年安徽省卡介苗预防接种后不良反应监测分析[J]. 中国疫苗和免疫,2022,28(3):362-365. Meng FY,Shi SJ,Wang BB,et al. Surveillance of adverse reactions fol‐lowing immunization with bacillus Calmette-Guérin vaccine in Anhui Province,2017-2021[J]. Chin J Vaccines Immun,2022,28(3):362-365.
[30] 武文娣,李克莉,许涤沙,等. 中国2015—2018年3个流感季节流感疫苗疑似预防接种异常反应监测数据分析[J]. 中华预防医学杂志,2019,5(10):987-992. Wu WD,Li KL,Xu DS,et al. Study on surveillance data of adverse events following immunization of seasonal influenza vaccine in China during 2015-2018 influenza season[J]. Chin J Prev Med,2019,5(10):987-992.
(责任编辑:李青颖)
本文引用格式:
王斌冰,薛文庆,孟凡亚,等. A群C群脑膜炎球菌多糖结合疫苗和乙肝疫苗同时接种后疑似预防接种异常反应监测分析[J]. 重庆医科大学学报,2025,50(1):88-93.

