外泌体miRNA差异表达可作为诊断慢性心力衰竭合并高尿酸血症患者新型分子标志物及靶基因功能分析



摘要:目的 分析慢性心力衰竭(CHF)合并高尿酸血症(HUA)患者血清外泌体miRNA的差异表达,探讨其作为CHF合并HUA新型诊断分子标志物的可能性,并对差异miRNA进行靶基因功能分析,分析作用靶点。方法 以2020年9月~2023年9月南京中医药大学附属南京中医院心血管病科收治的CHF合并HUA患者为观察组(n=30),选择同期健康志愿者为对照组(n=30)。两组各选取6例样本,采用高通量测序分析血清外泌体中的差异表达miRNA,采用RT-PCR检测对未作高通量测序的观察组和对照组样本(n=24)进行验证,使用R软件进行GO、KEGG富集分析,预测差异表达miRNA的作用靶点,并通过动物实验验证临床筛查的差异miRNA。结果 高通量测序分析显示,观察组患者共检测到42 个差异表达的miRNA(18 个上调,24 个下调),其中miR-27a-5p上调(Plt;0.001),miR-139-3p下调(Plt;0.001)。RT-PCR检测显示,观察组患者血清外泌体中miR-27a-5p 表达量上调(P=0.004)、miR-139-3p 表达量下调(P=0.005);ROC曲线下面积(AUC)分析发现,miR-27a-5p、miR-139-3p 预测CHF 合并HUA 发病的AUC 分别是0.708(95% CI:0.562-0.855)和0.734(95% CI:0.593-0.876),两者联合预测CHF 与HUA 发病的AUC为0.899(95% CI:0.812-0.987)。对差异基因进行GO富集分析发现,细胞自噬是富集程度最高的靶点;KEGG功能注释显示,激活AMPK-mTOR信号通路可能是差异表达的miR-27a-5p 和miR-139-3p 作用靶点之一。进一步动物实验得到了相同的验证。结论 血清外泌体中miR-27a-5p 上调和miR-139-3p 下调可作为精准诊断CHF 合并HUA 的新型分子标志物,激活AMPK-mTOR信号通路后促进心肌细胞的自噬反应可能是差异表达的miR-27a-5p、miR-139-3p的作用靶点之一。
关键词:慢性心力衰竭;高尿酸血症;外泌体;微小RNA;AMPK;mTOR;自噬
高尿酸血症(HUA)是嘌呤代谢紊乱导致血清尿酸生成过多或排泄障碍引起的一种代谢异常疾病,是慢性心力衰竭(CHF)的常见合并症,与心衰不良预后密切相关[1-3]。诊断CHF 合并HUA主要依据临床症状及血B型脑利钠肽(BNP)、左室射血分数(LVEF)和血尿酸(SUA)等检测指标的综合诊断。但血BNP 容易受高龄、肥胖、肾功能、SUA等因素影响[4-6]。LVEF主要通过检查心脏的血流动力学改变评估患者心功能和心室重构情况,CHF除了与血流动力学改变相关,还与神经内分泌等机制有关,但心脏超声却无法反映这一病理改变,使得LVEF检查结果具有不全面性[7]。SUA受遗传、环境、饮食习惯、性别、年龄、药物使用、肾功能等多因素影响[8]。因此单一的生物标志物可能不足以诊断CHF合并HUA这一共病状态。
外泌体是细胞内多泡体分泌的一种纳米级微囊泡,直径30~140 nm,广泛分布于各种细胞和体液中,比如血液、脑脊液、尿液和唾液等[9, 10]。外泌体可转移源细胞的小分子遗传物质和蛋白质,然后作用于靶细胞,是细胞间信息传递的工具,具有更高的稳定性[11]。miRNA是一类长18~25 个核苷酸组成的小分子非编码RNA,通过特异性结合靶基因mRNA转录本的3'非翻译区,参与多种生物学过程,包括发育进程、器官形成、细胞增殖、代谢和凋亡等,从而实现对靶基因的表达发挥调控作用[12]。miRNA可作为一种新型的生物标志物应用于疾病的诊断和预后的早期判断,以及提供新的治疗靶点[13-16]。已有研究表明,外泌体miRNA的差异表达可作为预测CHF 或HUA 的诊断标记物[17, 18],但目前尚无CHF合并HUA的共病患者外泌体中miRNA异常表达谱分析的相关研究报道。
本研究基于miRNA测序,对CHF合并HUA患者和健康志愿者血清外泌体miRNA表达谱进行分析,筛选差异表达miRNA,为确定CHF 合并HUA共病状态的早期诊断新型分子标志物提供依据;通过GO 和KEGG富集分析,进一步预测差异表达miRNA的相关作用靶点,探讨差异表达miRNA对CHF合并HUA发病的调控机制。
1 资料和方法
1.1 研究对象
选择2020 年9 月~2023 年9 月就诊于南京中医药大学附属南京中医院心血管病科的CHF合并HUA患者作为观察组(n=30),随机选择在南京中医药大学附属南京中医院健康体检中心参加体检的健康志愿者作为对照组(n=30)。本研究方案通过南京中医药大学附属南京中医院伦理委员会批准(伦理批号:KY2020083),研究对象均签署知情同意书。
1.2 诊断标准
CHF的诊断及心功能分级标准参照《中国心力衰竭诊断和治疗指南2018》制定:高血压性心脏病、冠心病、风心病、心肌病;NYHA心功能分级Ⅱ~Ⅳ级;LVEFlt;50%。
HUA的诊断标准参照《中国高尿酸血症与痛风诊疗指南2019》制定:正常嘌呤饮食状态下,非同日2次空腹SUAgt;420 μmol/L(成年人,不分性别)。
1.3 纳入、排除标准
CHF合并HUA的纳入标准:符合CHF及HUA的诊断标准;入组前2 周未使用任何中西医降尿酸药物;18周岁≤年龄lt;90周岁;自愿接受本次临床研究,并签署知情同意书。健康志愿者的纳入标准:健康体检者,18周岁≤年龄lt;90周岁。排除标准:自身免疫性疾病、各种急慢性感染及肿瘤患者;既往发生急、慢性痛风性关节炎者;严重肝功能不全、肾功能不全者;妊娠或哺乳期妇女;无法合作者,如精神病患者;拒绝签署知情同意者。
1.4 主要仪器与试剂
高速冷冻离心机、高速离心机(赛默飞世尔科技有限公司),低速离心机(杭州奥盛仪器有限公司),涡旋混合器(太仓市华利达试验设备有限公司),紫外分光光度计(simgen biotechlogy) ,AGENCOURT®AMPURE® XP Kit(Bechman Coulter),KAPA LibraryQuantification Kit Illumina® Platforms (KAPABiosystems),T100TM Thermal Cycler(PCR 仪)(Bio-RAD),Qubit® Fluorometers(Thermo Fisher Scientific),Qseq 100 DNA Analyzer(Bioptic),Light Cycler® 96(Roche)。
Small RNA Library Prep Kit(KAITAI-BIO),Reverse Transcriptase M-MLV(Takara),SYBR Green Ibased Real-time quantitative PCR试剂盒 (艾科瑞),10mmol/L dNTP、RNase-free Water (TIANGEN),RNaseInhibitor (Thermo Fisher Scientific) 。microRNAuniRev、hsa-miR-27a-5p RT、hsa-miR-27a-5p F、hsamiR-139-3p RT、hsa-miR-139-3p F、hsa-U6 snRNAFor、hsa-U6 snRNA Rev(捷瑞)。
1.5 方法
1.5.1 样本采集与保存 研究对象均禁食10 h,于次日清晨采取外周静脉血10 mL,室温静置10~60 min,4 ℃,以3000 r/min 离心10 min,移液枪吸取上清液1.5 mL到新的离心管中,以16 000×g离心10 min,移液枪吸取上清液到无RNA酶Eppendorf管中,-80 ℃低温保存。
1.5.2 血清外泌体的提取 采用超高速离心法按以下步骤提取血清外泌体:取出-80 ℃保存的血清复温后,在4 ℃条件下,以300×g 离心10 min,再以10 000×g 离心60 min。使用0.22 μm滤器过滤上清。过滤后使用天平称质量法绝对配平后放入超高速离心机,在4 ℃条件下,以120 000×g离心2 h。然后在离心瓶中加入DPBS清洗超离获得的外泌体液。再次给予120 000×g,4 ℃条件下离心2 h。小心去除上清,轻柔加入DPBS重悬外泌体沉淀块,即为外泌体溶液。
1.5.3 血清外泌体RNA 的提取 血清外泌体中加入700 μL QLAzol Lysis,边加边吸打至样本溶解,然后涡旋震荡混匀。在室温15~25 ℃放置5 min。加入140 μL氯仿(氯仿与QLAzol Lysis体积比=1∶5),涡旋混匀,室温放置3 min。4 ℃条件下,12 000×g离心15 min。取上清至另一离心管(尽量吸取上清,不要中间的白膜层),加入1.5倍体积的无水乙醇,涡旋混匀,室温15~25 ℃放置10 min。取700 μL混合液于RNeasyMini colution 中,≥8000×g,室温离心15 s,若混合液较多,重复此步骤。去掉下游液体,加入700 μL RWT到柱子上,≥8000×g,室温离心15 s。去掉下游液体,加入500 μL RPE到柱子上,≥8000×g,室温离心15 s。去掉下游液体,加入500 μLRPE到柱子上,≥8000×g,室温离心15 s。≥8000×g,室温空离2 min,将吸附柱置于一个新的RNase-Freedd离心管中于室温放置5 min,晾干吸附材料中残余的漂洗液。往离心管中央加入30 μL RNase-FreeddH2O,室温放置2 min,13 400×g 离心3 min 得到血清外泌体RNA溶液。
1.5.4 血清外泌体miRNA高通量芯片检测
1.5.4.1 外泌体RNA的提取 根据基因测序实验设计要求每组样本≥3 的原则及本研究纳入的总样本量,随机选取6例CHF合并HUA患者和6例健康体检者作先期血清外泌体miRNA高通量测序。
1.5.4.2 外泌体miRNA高通量测序及数据质控 提取miRNA后,对其进行质量检测。使用Qubit2.0 进行初步定量,使用Agilent 2100对其片段长度进行检测。采用Q-PCR方法对检测的miRNA有效浓度进行准确定量(有效浓度为gt;2 nmol/L)。按照目标下机数据量进行pooling,用NovaSeq 6000平台进行测序。
1.5.5 筛选出可能作为CHF 合并HUA的血清外泌体miRNA标志物 经过高通量测序,检测6 例CHF 合并HUA患者及6例健康志愿者血清外泌体中存在的差异表达miRNA,使用R软件包DESeq 2对数据集进行差异分析,按照|log FC|gt;1.5且Plt;0.05的标准筛选差异表达的miRNA,在得到的显著差异表达的miRNA基因谱中选取一个显著上调和一个显著下调的miRNA,作为CHF合并HUA患者显著差异表达的血清外泌体miRNA标志物。
1.5.6 RT-PCR验证筛选出的差异miRNA 筛选出CHF合并HUA患者差异表达的血清外泌体miRNA标志物后,对其余CHF合并HUA患者和健康体检者的血清样本采用RT-PCR的方法进行验证。按照1.5.2和1.5.3的试验步骤,提取血清外泌体miRNA,参照microRNAuniRev试剂盒使用说明制取混合液,混合均匀后瞬时离心,在ABI 核酸扩增仪中42 ℃ 60 min,70 ℃ 15 min 得到RT反应液。按照microRNA uniRev试剂盒步骤,分别加入目标miRNA引物(表1),在ABI PCR仪中95 ℃30 s进行预变性,95 ℃ 5 s,60 ℃ 30 s进行40个循环完成变性和退火,循环结束后立即进行融解曲线分析。各样品设置3 个复孔,采用2-ΔΔct法计算miR-27a-5p 和miR-139-3p的相对表达水平。以U6作为内参,对未作高通量测试的24例CHF合并HUA患者及24例健康志愿者血清外泌体中目标 miRNA采用RT-PCR检测方法验证。
1.5.7 靶基因的筛选 基于已知和新预测的miRNA,根据其种子区(动物)或完整序列(植物)与靶基因3' UTR区的互补关系,结合自由能情况预测该miRNA的靶基因。为进一步提高预测结果的准确性,本报告使用miRanda(http://www.microrna.org/microrna/home.do)和RNAhybridl两个软件预测差异表达miRNA靶基因,并且对两个结果取交集,得到最终miRNA靶基因。
1.5.8 差异miRNA 靶基因预测和功能分析 使用miRanda和RNAhybridl软件预测miRNA的靶基因,并且对两个结果取交集,得到最终miRNA靶基因。
使用R包clusterprofiler 对得到的靶基因进行GO和KEGG富集分析,设置筛选阈值Plt;0.05。通过GO富集分析发现与差异表达miRNA的靶基因显著相关分子功能、生物过程和细胞组分。通过KEGG富集分析发现与差异表达的miRNA靶基因富集的分子信号通路。
1.6 动物实验验证临床筛查的差异miRNA
采用腹腔注射阿霉素(2.5 mg/kg)1次/周、连续6周的方法制备CHF大鼠模型。给予CHF模型大鼠灌胃乙胺丁醇(250 mg/kg)联合皮下注射氧嗪酸钾(200 mg/kg)1次/d、连续6周,制备CHF合并HUA模型大鼠,观察临床协定方化湿降浊方对CHF 合并HUA 模型大鼠血miR-27a-5p 和miR-139-3p 的影响,进一步观察调控miR-27a-5p 与miR-139-3p 对模型大鼠心肌细胞自噬反应和AMPK-mTOR信号通路的影响。
50只SD雄性大鼠,随机选取8只作为空白对照组(Control),其余42只大鼠进行CHF合并HUA造模,在CHF造模过程中先后死亡6只,36只大鼠成功制备CHF合并HUA病理模型,随机分为3组:模型组(Model)、化湿降浊方组(HSJZF)和化湿降浊方+AMPK 激动剂Acadesine组(HSJZF+A),12只/组。HSJZF组给予化湿降浊方(10 g·kg-1·d-1)混悬液灌胃;HSJZF+A组给予化湿降浊方(10 g·kg-1·d-1)混悬液灌胃的基础上肌肉注射Acadesine(50 mg·kg-1·d-1);Control 与Model 组灌胃等量蒸馏水,体积为10 mL/kg。末次给药1 h后行心脏彩超检查测定各实验大鼠的左心室射血分数(LVEF),然后麻醉处死,用ELISA 法测定其SUA、血脑利钠肽(BNP),RT-PCR 法测定血miR-27a-5p 和miR-139-3p的相对表达量;取大鼠心肌组织,采用Western blotting法检测AMPK-mTOR蛋白表达情况。
1.7 统计学分析
采用SPSS 21.0 软件进行统计分析,计量资料以均数±标准差表示,符合正态分布的数据组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,不符合正态分布则采用Mann-Whitney U 检验,使用ROC曲线下面积(AUC)来描述差异目标miRNA的检测效能,计数资料以例(%)表示,组间比较采用卡方检验,Plt;0.05为差异有统计学意义。
2 结果
2.1 临床资料比较
观察组患者中合并高血压11例、冠心病5例、房颤5例;对照组经询问病史排除心血管疾病。两组性别、年龄、肝功能、总胆固醇的差异均无统计学意义(Pgt;0.05),观察组的SUA、SCr、BUN水平高于对照组(Plt;0.001),LVEF低于对照组(Plt;0.001,表2)。
2.2 高通量测序筛查CHF合并HUA患者血清外泌体差异表达的miRNA
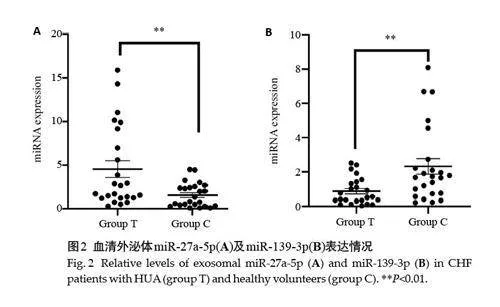
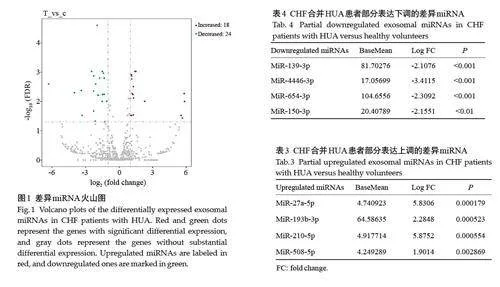
筛选出差异表达miRNA共42个,其中18个上调,24 个下调。miR-27a-5p 上调最为显著,miR-139-3p 下调最为显著(图1,表3、4)。因此,选择miR-27a-5p 和miR-139-3p 作为CHF合并HUA患者显著差异表达的目标miRNA,并进行RT-PCR验证。
2.3 RT-PCR法检测验证目标miRNA
与对照组比较,CHF合并HUA患者血清外泌体中miR-27a-5p表达量升高(P=0.004)、miR-139-3p表达量下降(P=0.005,图2)。
2.4 靶基因筛选结果
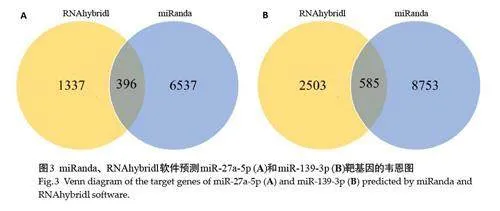
结果显示,miRanda 和RNAhybridl 预测miR-27a-5p的靶基因分别有6537和1337个,交集靶基因有396个(图3A,表5)。使用miRanda和RNAhybridl预测miR-139-3p的靶基因分别有8753和2503个,交集靶基因有585 个(图3B,表5)。分别取交集靶基因用于后续GO和KEGG富集分析。
2.5 miR-27a-5p、miR-139-3p 预测CHF 合并HUA 的ROC曲线分析
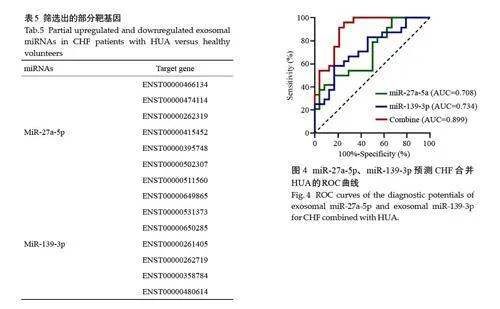
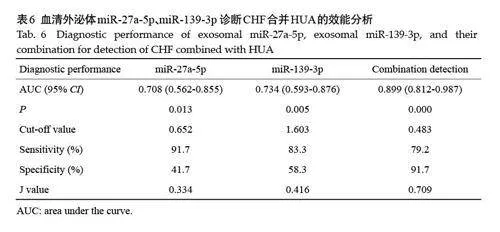
ROC曲线结果显示,miR-27a-5p和miR-139-3p预测的AUC分别为0.708(95% CI:0.562-0.855)和0.734(95% CI:0.593-0.876),两者联合预测CHF 合并HUA的AUC为0.899(95% CI:0.812-0.987)(表6,图4)。
2.6 GO和KEGG富集分析
对差异基因进行GO富集分析,共富集了8353 条GO条目。根据P值由小到大的顺序筛选出前40 位的GO条目,包括:生物学过程(BP),细胞组成(CC)和分子功能(MF)。主要BP有:自噬、参与自噬的过程、GTP酶活性的调节、蛋白信号传导等。主要CC有:神经元胞体、细胞前缘、突触膜、轴突等;主要MF包括:丝氨酸/苏氨酸激酶活性、微小GTP酶结合、金属离子跨膜转运活性、GTP酶结合、GTP酶活性调节等。通过富集分析气泡图,发现细胞自噬是富集程度最高的靶点(图5A)。
对CHF 合并HUA 患者差异表达miR-27a-5p 与miR-139-3p 基因进行KEGG通路分析,结果显示分别有多条通路参与CHF合并HUA的病理机制:如磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)信号通路、自噬信号通路、腺苷酸活化蛋白激酶(AMPK)-哺乳动物雷帕霉素靶蛋白(mTOR)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、醛固酮合成和分泌等。其中AMPK-mTOR跟PI3K-Akt 信号通路是差异基因表达GO功能注释得出的自噬高度相关的通路(图5B)。
2.7 大鼠血miR-27a-5p和miR-139-3p相对表达量比较
与Control组比较,Model组大鼠血miR-27a-5p 表达量升高(Plt;0.01),血miR-139-3p表达量降低(Plt;0.01)。与Model 组比较,HSJZF 组可以下调miR-27a-5p 的表达(Plt;0.01),升高miR-139-3p 的表达(Plt;0.05)。与HSJZF 组相比,加用AMPK激动剂后,HSJZF+A组大鼠血miR-27a-5p 表达量上调(Plt;0.01),血miR-139-3p表达量下调(Plt;0.05,图6)。
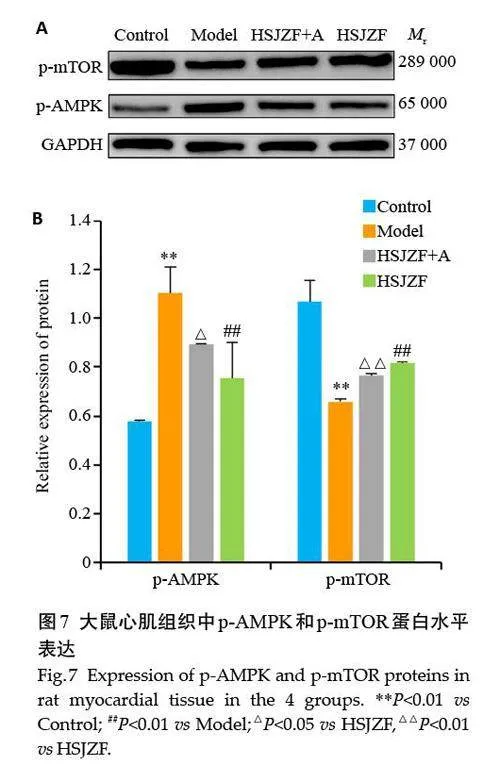
2.8 大鼠心肌组织中AMPK-mTOR蛋白水平比较
与Control 组比较,Model 组大鼠心肌组织中p-AMPK蛋白表达增加、p-mTOR蛋白表达降低(Plt;0.01);与Model 组相比,HSJZF 可以降低p-AMPK 和升高p-mTOR蛋白的表达(Plt;0.01);与HSJZF组比较,加用AMPK激动剂后,HSJZF+A组p-AMPK蛋白表达水平增加,但p-mTOR蛋白表达水平下降(Plt;0.05,图7)。
3 讨论
CHF 与HUA共病是心衰患者最常见的临床状态之一,探索特异性、敏感性高的新型分子标志物对于CHF 合并HUA精准诊断和靶向治疗具有重要意义。miRNA为生理和病理过程中细胞间通讯和信号传导介质的调节因子,差异表达的miRNA具有编码成纤维细胞和促进血管新生的作用,与心力衰竭和左室肥大相关[21-23]。研究发现心室重构模型小鼠外泌体中miRNA-27a-5p 呈高表达[19]、梗死心肌中miR-139-3p 呈低表达[20]。本研究发现,CHF与HUA共病患者血清外泌体中存在差异表达的miRNA共42个,其中18个上调,24个下调,miR-27a-5p呈上调表达,miR-139-3p呈下调表达,与上述文献报道结果相似。联合检测血清外泌体miR-27a-5p和miR-139-3p的表达水平对进一步研究精准诊断CHF合并HUA可能的新型分子标记物具有重要价值。
一种miRNA可作用于多个不同的靶基因,而每种靶基因亦可被多个不同的miRNA调控。差异表达的miRNA具有调控心肌细胞凋亡和自噬影响CHF 患者预后的作用[24]。自噬是一种高度保守的溶酶体相关降解过程,主要负责大分子蛋白聚集体和受损细胞器的降解,广泛参与包括心血管疾病在内的病理生理过程[25]。衰竭的心脏组织中,受损的线粒体产生活性氧,进一步激活自噬,过度自噬是加重CHF的重要因素[26, 27]。本研究GO 富集分析发现,差异表达miRNA 的靶基因可能与调控自噬的发生相关。因此推断差异表达的miR-27a-5p 和miR-139-3p 通过激活自噬参与CHF 合并HUA的进程。
SUA异常可以通过诱导内皮损伤、炎症反应和氧化应激,激活自噬,导致血管和心肌的损伤[28-30]。PI3KAkt、磷酸酯酶与张力蛋白同源物(PTEN)诱导假定激酶1-帕金森病蛋白(PINK1-Parkin)、AMPK-mTOR和p38MAPK等通路是调节自噬的主要信号通路[25, 31-33]。但CHF合并HUA共病状态下自噬被激活的信号通路仍不清楚,探究其分子遗传发病机制已成为当前研究的热点。本研究KEGG富集分析发现,差异表达miR- 27a-5p 和miR-139-3p 的靶基因涉及与自噬相关的PI3KAkt与AMPK-mTOR信号通路。高尿酸会激活PI3KAkt信号通路,故抑制PI3K-Akt信号通路可能是降尿酸药物发挥作用的机制之一[34]。而抑制PI3K-Akt信号通路可导致心肌细胞的过度自噬,激活PI3K-Akt信号通路,则可以影响心肌细胞的过度自噬,从而发挥保护心肌细胞的作用[35]。两者之间存在明显矛盾,提示PI3KAkt信号通路可能还通过除自噬之外的其它机制参与了CHF 合并HUA 的发病[29]。高浓度的尿酸可激活AMPK-mTOR 信号通路从而促进细胞自噬。而AMPK-mTOR信号通路的激活又具有促进心肌细胞自噬的作用,抑制AMPK-mTOR信号通路可显著降低心肌细胞的自噬程度,具有保护心肌细胞的作用[36]。进一步提示差异表达外泌体miR-27a-5p 和miR-139-3p 通过激活AMPK-mTOR信号通路诱发自噬调控CHF 合并HUA的发生、发展。
对于筛选出的差异miRNA及预测的信号通路,本研究通过制备CHF合并HUA复合病理模型,并采用化湿降浊方进行动物实验验证干预,结果发现CHF合并HUA模型大鼠血miR-27a-5p呈高表达、miR-139-3p呈低表达,并通过激活AMPK-mTOR信号通路,加重CHF合并HUA模型大鼠心肌损伤。这与临床研究结果相同,进一步验证了高表达的miR-27a-5p 及低表达的miR-139-3p 与CHF合并HUA的发病相关。化湿降浊方干预后具有通过调控miR-27a-5p 和miR-139-3p 的表达,抑制AMPK-mTOR信号通路的激活,发挥对CHF合并HUA模型大鼠心肌的保护作用。加用AMPK激动剂后可以部分逆转化湿降浊方的干预作用,进一步验证临床筛查的差异miRNA对自噬相关AMPK-mTOR信号通路的影响。
综上所述,血清外泌体中差异表达的miR-27a-5p联合miR-139-3p可作为早期诊断CHF与HUA共病的新型分子标志物,激活AMPK-mTOR信号通路、导致心肌细胞自噬可能是差异表达miRNA的调控机制之一。本研究为探索精准诊断CHF与HUA共病、寻找靶向干预药物提供了新的研究思路,具有较好的临床应用前景及科研意义。
本研究仍存在一些局限性。首先,由于本研究是来自单一中心的小样本临床研究,研究结果可能存在一定的偏倚和局限性。第二,本研究仅限于中国汉族人群,因此研究结果应谨慎推广到其他种族群体。未来可通过多中心、大样本的临床研究和动物实验进一步验证本文研究结果。
参考文献:
[1] Hamaguchi S, Furumoto T, Tsuchihashi-Makaya M, et al.
Hyperuricemia predicts adverse outcomes in patients with heart
failure[J]. Int J Cardiol, 2011, 151(2): 143-7.
[2] Krishnan E. Hyperuricemia and incident heart failure[J]. Circ Heart
Fail, 2009, 2(6): 556-62.
[3] Huang H, Huang BT, Li YL, et al. Uric acid and risk of heart failure:
a systematic review and meta-analysis[J]. Eur J Heart Fail, 2014, 16
(1): 15-24.
[4] 王晓瑜. 慢性肾脏病非透析患者BNP的影响因素及其与心功能关
系的研究[D]. 广州: 广州医科大学, 2020: 33-6.
[5] Takase H, Dohi Y. Kidney function crucially affects B-type
natriuretic peptide (BNP), N-terminal proBNP and their relationship
[J]. Eur J Clin Invest, 2014, 44(3): 303-8.
[6] Vickery S, Price CP, John RI, et al. B-type natriuretic peptide (BNP)
and amino-terminal proBNP in patients with CKD: relationship to
renal function and left ventricular hypertrophy[J]. Am J Kidney Dis,
2005, 46(4): 610-20.
[7] Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA
guideline for the management of heart failure: a report of the
American college of cardiology/american heart association joint
committee on clinical practice guidelines[J]. Circulation, 2022, 145
(18): e895-1032.
[8] Dong XK, Zhang HL, Wang F, et al. Epidemiology and prevalence
of hyperuricemia among men and women in Chinese rural
population: the Henan Rural Cohort Study[J]. Mod Rheumatol,
2020, 30(5): 910-20.
[9] Saheera S, Potnuri AG, Krishnamurthy P. Nano-vesicle (mis)
communication in senescence-related pathologies[J]. Cells, 2020, 9
(9): 1974.
[10]Zhang TM, Ma SH, Lv JK, et al. The emerging role of exosomes in
Alzheimer's disease[J]. Ageing Res Rev, 2021, 68: 101321.
[11]Guo M, Hao YN, Feng YW, et al. Microglial exosomes in
neurodegenerative disease[J]. Front Mol Neurosci, 2021, 14:
630808.
[12] Jiang H, Wang JX, Li M, et al. miRTRS: a recommendation
algorithm for predicting miRNA targets[J]. IEEE/ACM Trans
Comput Biol Bioinform, 2020, 17(3): 1032-41.
[13]Vishnoi A, Rani S. MiRNA biogenesis and regulation of diseases: an
overview[J]. Methods Mol Biol, 2017, 1509: 1-10.
[14]Bheri S, Kassouf BP, Park HJ, et al. Engineering cardiac small
extracellular vesicle-derived vehicles with thin-film hydration for
customized microRNA loading[J]. J Cardiovasc Dev Dis, 2021, 8
(11): 135.
[15]Ameres SL, Zamore PD. Diversifying microRNA sequence and
function[J]. Nat Rev Mol Cell Biol, 2013, 14(8): 475-88.
[16]Chen H, Xue RC, Huang PS, et al. Modified exosomes: a good
transporter for miRNAs within stem cells to treat ischemic heart
disease[J]. J Cardiovasc Transl Res, 2022, 15(3): 514-23.
[17]Wang L, Liu J, Xu B, et al. Reduced exosome miR-425 and miR-744
in the plasma represents the progression of fibrosis and heart failure
[J]. Kaohsiung J Med Sci, 2018, 34(11): 626-33.
[18]Gou HM, Wan PC, Guo WQ, et al. Analysis of miRNA expression
profile of hyperuricemia in peripheral blood and the construction of
ceRNA network [J]. J Nor Sichuan Med Coll, 2023, 38(04): 451-6.
[19]高 娜. 应用超声生物显微镜评价肥胖小鼠心肌功能与其外泌体成
分的实验研究[D]. 银川: 宁夏医科大学, 2022: 25-7.
[20]Ning Y, Huang PS, Chen GH, et al. Atorvastatin-pretreated
mesenchymal stem cell-derived extracellular vesicles promote
cardiac repair after myocardial infarction via shifting macrophage
polarization by targeting microRNA-139-3p/Stat1 pathway[J].
BMC Med, 2023, 21(1): 96.
[21]Zhang Q, Chen L, Huang LY, et al. CD44 promotes angiogenesis in
myocardial infarction through regulating plasma exosome uptake
and further enhancing FGFR2 signaling transduction[J]. Mol Med,
2022, 28(1): 145.
[22]Wang XJ, Morelli MB, Matarese A, et al. Cardiomyocyte-derived
exosomal microRNA-92a mediates post-ischemic myofibroblast
activation both in vitro and ex vivo[J]. ESC Heart Fail, 2020, 7(1):
284-8.
[23]Morelli MB, Shu J, Sardu C, et al. Cardiosomal microRNAs are
essential in post-infarction myofibroblast phenoconversion[J]. Int J
Mol Sci, 2019, 21(1): 201.
[24]Kansakar U, Varzideh F, Mone P, et al. Functional role of
microRNAs in regulating cardiomyocyte death[J]. Cells, 2022, 11
(6): 983.
[25]Zhang DQ, Zheng N, Fu XL, et al. Dl-3-n-butylphthalide attenuates
myocardial ischemia reperfusion injury by suppressing oxidative
stress and regulating cardiac mitophagy via the PINK1/Parkin
pathway in rats[J]. J Thorac Dis, 2022, 14(5): 1651-62.
[26]Li B, Chi RF, Qin FZ, et al. Distinct changes of myocyte autophagy
during myocardial hypertrophy and heart failure: association with
oxidative stress[J]. Exp Physiol, 2016, 101(8): 1050-63.
[27]Wang JL, Li YZ, Tao TQ, et al. Postconditioning with calreticulin
attenuates myocardial ischemia/reperfusion injury and improves
autophagic flux[J]. Shock, 2020, 53(3): 363-72.
[28]Chen YC, Zhang CL, Wu Q. The role of autophagy in vascular
endothelial cell damage and inflammatory response caused by high
uric acid [J]. Chin J Gerontol, 2019, 39(24): 6098-101.
[29]Du LG, Yu Y, Lan QS, et al. Lesinurad improves high uric acidinduced
abnormal proliferation of vascular smooth muscle by
inhibiting autophagy via gegulating AMPK/mTOR pathway [J]. J
Guangzhou Med Univ, 2022, 50(5): 1-5.
[30]Liu D, Gao K, Xie Y, et al. The effect of high uric acid on the activity
of cardiomyocytes and its related mechanism [J]. Tianjin Med J,
2020, 48(10): 931-6.
[31]Li TY, Lin SY, Lin SC. Mechanism and physiological significance of
growth factor-related autophagy[J]. Physiology, 2013, 28(6):
423-31.
[32]Han DD, Jiang LL, Gu XL, et al. SIRT3 deficiency is resistant to
autophagy-dependent ferroptosis by inhibiting the AMPK/mTOR
pathway and promoting GPX4 levels[J]. J Cell Physiol, 2020, 235
(11): 8839-51.
[33]Li WM, Zhu JQ, Dou J, et al. Phosphorylation of LAMP2A by p38
MAPK couples ER stress to chaperone-mediated autophagy[J]. Nat
Commun, 2017, 8(1): 1763.
[34]Lou DX, Zhang XG, Jiang CH, et al. 3β, 23-dihydroxy-12-ene-28-
ursolic acid isolated from Cyclocarya paliurus alleviates NLRP3
inflammasome-mediated gout via PI3K-AKT-mTOR-dependent
autophagy[J]. Evid Based Complement Alternat Med, 2022, 2022:
5541232.
[35]Ba LN, Gao JQ, Chen YP, et al. Allicin attenuates pathological
cardiac hypertrophy by inhibiting autophagy via activation of PI3K/
Akt/mTOR and MAPK/ERK/mTOR signaling pathways[J].
Phytomedicine, 2019, 58: 152765.
[36]Fan CL, Cai WJ, Ye MN, et al. Qili Qiangxin, a compound herbal
medicine formula, alleviates hypoxia-reoxygenation-induced
apoptotic and autophagic cell death via suppression of ROS/AMPK/
mTOR pathway in vitro[J]. J Integr Med, 2022, 20(4): 365-75.
(编辑:林 萍)