乙烯利对草地早熟禾水分胁迫及复水过程中抗氧化酶的影响





摘要:前期研究显示乙烯利能缓解干旱胁迫下草地早熟禾(Poa pratensis L.)的受胁迫程度,但其作用机制未知。为探究抗氧化酶在乙烯利对草地早熟禾水分胁迫响应中的作用,利用草地早熟禾品种‘Midnight’进行水分胁迫和胁迫后复水处理,以正常浇水作为对照(CK),研究乙烯利(ETH)、水分胁迫(WS)和乙烯利水分胁迫(EWS)4种处理下草地早熟禾的生理指标和各项抗氧化酶活性变化,分析抗氧化酶在乙烯利缓解水分胁迫中的作用。结果表明:乙烯利在水分胁迫条件下显著提高了草地早熟禾过氧化物酶(Peroxidase,POD)以及谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)活性;在复水恢复阶段,乙烯利大幅提升GPX和脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)活性。综上所述,乙烯利对草地早熟禾水分胁迫下POD,GPX,DHAR抗氧化酶的活性提高产生积极作用,对其他抗氧化酶活性的影响不显著。
关键词:草地早熟禾;乙烯利;抗氧化酶;水分胁迫
中图分类号:Q945.78""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2540-08
Effects of Ethephon on Antioxidant Enzymes in Kentucky Bluegrass
under Water Stress and Rewatering
LIU Yue-yue1#, GAO Ya-nan1,2#, LU Shuang1, ZHOU Sheng-feng1,
XU Xin-yu1, LIU Zhuo-fan1, XU Li-xin1*
(1. School of Grassland Science, Beijing Forestry University, Beijing 100083, China; 2. College of Grassland Science and
Technology, China Agricultural University, Beijing 100193, China)
Abstract:Previous studies have shown that ethephon can promote drought tolerance of Poa pratensis. However,the underlying mechanism is unknown. In order to explore the effect of ethephon on antioxidant enzymes in Kentucky bluegrass under water shortage conditions,Kentucky bluegrass (Poa pratensis L.) variety ‘Midnight’ was used for water stress and post rewatering treatment. Watering plants (CK),ethephon pre-treated plants (ETH),water stressed plants (WS) and ethephon pre-treated plants with water stress (EWS) were used to investigate changes in physiological indices and activities of antioxidant enzymes in Kentucky bluegrass. Main antioxidant enzyme responses to ethephon treatment under water stressed conditions were analyzed. Results showed that ethephon significantly increased the activities of peroxidase (POD) and glutathione peroxidase (GPX) in Kentucky bluegrass under water stress,and ethephon dramatically increased the activities of GPX and dehydroascorbate reductase (DHAR) during rewatering. In conclusion,ethephon had a positive role on Kentucky bluegrass drought tolerance by promoting activities of POD,GPX and DHAR.
Key words:Kentucky bluegrass;Ethephon;Antioxidant enzyme;Water stress
大量研究表明,全球约有1/3的地区处在干旱状态,且年总降水量呈下降趋势[1]。缺水会使植物产生大量活性氧(Reactive oxygen species,ROS),影响氧化还原平衡,从而造成细胞损伤[2],对植物正常生长发育产生影响。此时植物体内的抗氧化酶系统通过增加各种酶活性清除ROS,缓解逆境对于植物的不利影响,包括超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)以及抗坏血酸-谷胱甘肽循环(Ascorbate-glutathione cycle,AsA-GSH)过程中的多种抗氧化酶[3]。
AsA-GSH循环是植物体内抗氧化的重要机制,主要包括抗坏血酸过氧化物酶(Ascorbic acid peroxidase,APX)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)、谷胱甘肽还原酶(Glutathione reductase,GR)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)以及单脱氢抗坏血酸还原酶(Monodehydroascorbate reductase,MDHAR)等几种酶,在其共同作用下将产生的主要氧化物质H2O2转化为H2O,达到减少ROS损伤的目的[4]。
水分是草坪草生长发育的关键因子[5],利用各种技术手段提高草坪草的抗旱性具有十分重要的实践意义。草地早熟禾(Poa pratensis L.)作为冷季型草坪草,分布广泛,具有耐修剪、叶片质地细腻等优良特性[6],但抗旱性、耐盐性等抗逆性相对较差。内蒙古农业大学通过施加适宜浓度的肌醇,降低或升高部分渗透调节物质含量,达到缓解盐害对草地早熟禾胁迫损伤的作用[7]。陈润娟等人[8]发现NO能够促进低温胁迫下草地早熟禾抗氧化酶活性的提高,增强了低温胁迫的适应能力。隋永超等人[9]验证了利用乙烯利可以提高草地早熟禾的抗旱性。
乙烯利(Ethephon)作为植物生长激素乙烯的生成剂,外施乙烯利可迅速转化成乙烯,对植物的生长发育产生影响[10-11]。近几年,乙烯利应用研究大多集中在促进作物、蔬菜的抗逆性和成熟度方面[12-13]。乙烯利在提升植物抗逆性,尤其是抗旱性方面的具体作用机制研究较少。部分学者认为乙烯利处理会启动植物防御反应,引起植物相对含水量、电导率和丙二醛含量等生理指标变化,从而提高其抵抗干旱胁迫的能力[8]。也有研究显示,喷洒乙烯利抑制草坪草生长,同时控制干物质积累,从而利用类似干旱逃避的策略增强干旱适应性[14]。为进一步解释乙烯利对水分胁迫下草地早熟禾的作用机理,探究抗氧化酶在此过程中的作用,本研究检测了草地早熟禾水分胁迫及胁迫后复水恢复过程中多个抗氧化酶的活性变化,分析和筛选响应乙烯利处理的抗氧化酶,为解析乙烯利提升草坪草抗旱性机制提供基础依据。
1 材料与方法
1.1 试验材料
北京中农克劳沃运动场景观工程有限公司提供草地早熟禾‘Midnight’品种作为试验材料。
1.2 试验设计
为了保证试验的成功,我们在人工气候箱中对草地早熟禾进行养护,养护条件包括:光照强度17 600 Lux,湿度70% RH,温度为23℃和18℃,分别光照和黑暗处理14 h和10 h。为了提供适合草地早熟禾生长的基质,将土壤和沙子按照1.5∶1的比例混合,每平方米的土壤基质上播种15 g的草地早熟禾[15]。为确保草种出苗,每天早晚给予适量的水浇灌,出苗后,立即将其移栽至大小为20 cm×16 cm的花盆中,以便进行日常修剪和浇水。草种生长过程中减少灌溉次数,并补充1×Hoagland营养液(购买于北京酷来博科技有限公司,NS1010-50 mL),当其生长至成坪阶段,进行水分胁迫处理。
选取20盆长势良好的草地早熟禾盆栽分别进行正常浇水处理(CK)、乙烯利(ETH)处理、水分胁迫(WS)处理和乙烯利水分胁迫(EWS)处理,每组处理5个重复。处理开始后,4种处理均喷施过量蒸馏水,ETH和EWS处理须在喷施过量蒸馏水后喷施乙烯利溶液,直至叶片凝结水珠。乙烯利浓度的选择依据韩露[16]的研究,选择最有利于草地早熟禾抗旱性提高的200 mg·L-1。喷施完毕后,对草坪草叶片进行第一次取样,以便后续指标测定。
处理期间,CK和ETH处理组正常浇水,保持土壤含水量稳定在40%,WS和EWS不浇水,当土壤含水量从最初的40%逐渐下降第10 d的4%时,进行第二次取样。最后进行复水处理,当RWC恢复到处理前水平时完成第三次的取样(复水2 d)。在此过程中各组处理土壤含水量的变化,见表1[15]。取样时间均在早上8:30—9:00之间。
1.3 测定指标及方法
使用时间域反射(Time Domain Reflectometry,TDR)方法对土壤含水量进行测定,水分速测仪TZS-Ⅰ购自浙江托普仪器有限公司;叶片相对含水量(Relative water content,RWC)采用传统的烘干法进行测定[17];电导率(Electrolyte leaking,EL)使用Zhang等人[18]的方法用电导仪进行测定;采用硫代巴比妥酸法进行丙二醛(Malondialdechyde,MDA)含量的测定[19];使用高俊风[20]的方法对超氧化物歧化酶(Superoxide Dismutase,SOD)活性进行测定;过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)和抗坏血酸过氧化物酶(Ascorbic acid peroxidase,APX)活性测定分别采用紫外吸收法[21]、愈创木酚法[22]和Nakano and Asada[23]的方法进行测定;使用从苏州科明生物技术有限公司购买的试剂盒进行谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)活性的测定;采用许立新[24]的方法,将试剂等比例减小调整为1 mL反应体系进行谷胱甘肽还原酶(Glutathione reductase,GR)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)和单脱氢抗坏血酸还原酶(Monodehydroascorbate reductase,MDHAR)活性测定。
1.4 数据分析
为了对数据进行方差分析和单因素比较,使用IBM SPSS Statistics 26软件进行统计分析,并采用平均值和标准误差来呈现试验结果,最终使用Origin 2019b软件制图来直观显示数据结果。
2 结果与分析
2.1 喷施乙烯利对草地早熟禾水分胁迫及复水过程中叶片相对含水量的影响
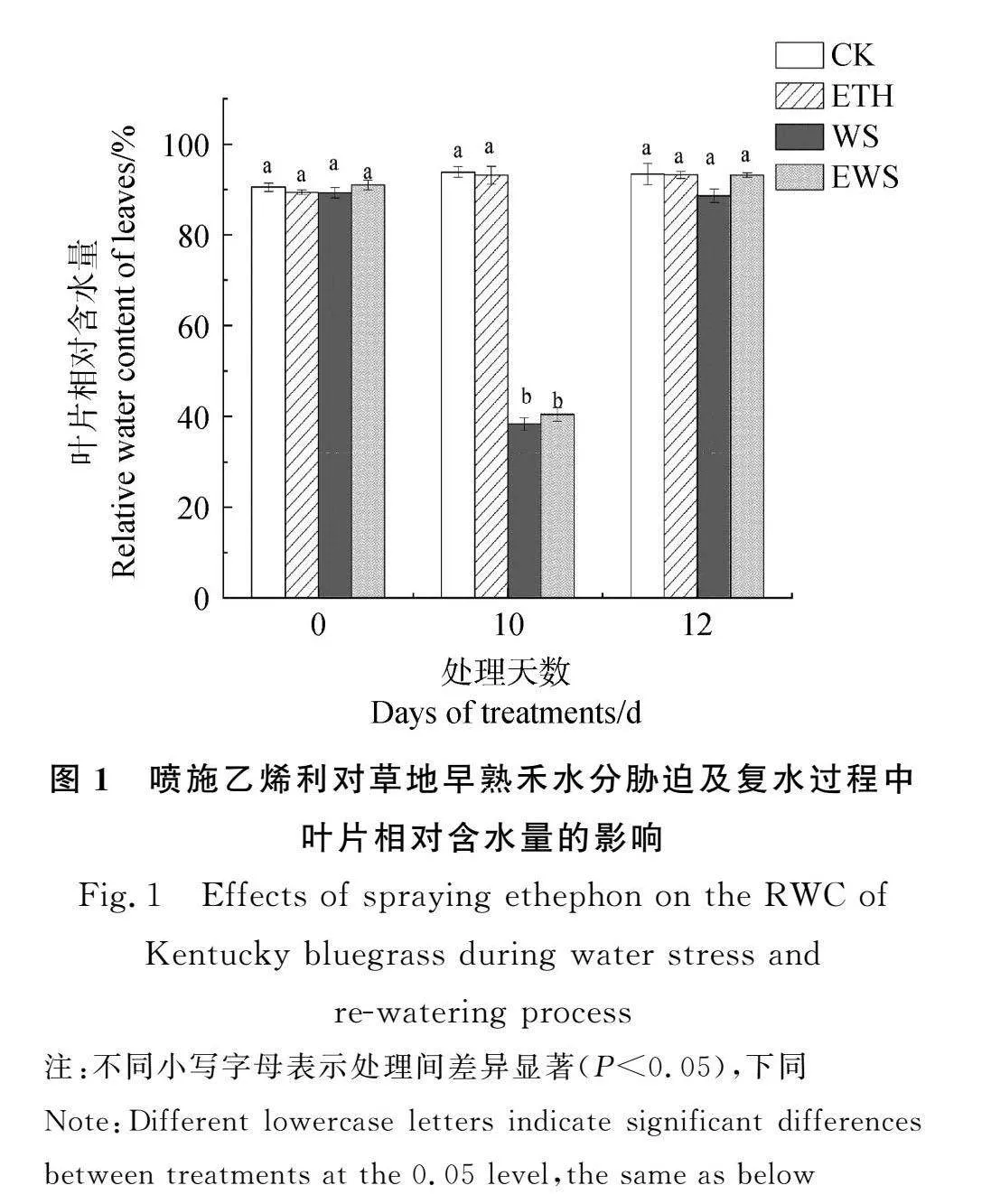
如图1所示,ETH处理下的RWC在第10 d和第12 d与CK相比均无显著差异。在第10 d,WS和EWS处理下的RWC与CK相比均显著下降(Plt;0.05),CK处理下的RWC分别是两种处理的2.45倍和2.32倍。但与WS相比,处理期间EWS处理下草地早熟禾的RWC并未显著升高,表明喷施乙烯利对提高草地早熟禾水分胁迫及复水过程中RWC无作用。
2.2 喷施乙烯利对草地早熟禾水分胁迫及复水过程中叶片膜透性的影响
如图2所示,0天时,四种处理下的EL(图2a),MDA(图2b)含量无显著差别。ETH处理下,EL和MDA在第10 d和第12 d与CK相比均无显著差异。在第10 d时,WS和EWS处理下草地早熟禾EL是CK处理的3.42倍和2.78倍,均显著上升(Plt;0.05)。但EWS处理下的EL显著低于WS处理(Plt;0.05),且WS处理下的EL是EWS处理下的1.23倍,说明乙烯利对减轻草地早熟禾叶片在水分胁迫下细胞膜电解质外渗的现象有一定作用,有助于草地早熟禾更好地适应水分胁迫。复水处理后,EWS处理下的MDA含量显著低于WS处理(Plt;0.05),WS处理下MDA含量是EWS处理下的1.24倍。表明乙烯利能够在草地早熟禾水分胁迫的复水恢复阶段,起到缓解细胞膜过氧化损伤的作用。
2.3 喷施乙烯利对草地早熟禾水分胁迫及复水过程中抗氧化酶活性的影响
2.3.1 喷施乙烯利对草地早熟禾水分胁迫及复水过程中SOD和CAT活性的影响 如图3所示,经过ETH处理后,SOD(图3a)和CAT(图3b)活性在处理第10 d和第12 d较CK均无显著差异,表明在正常浇水条件下,乙烯利对草地早熟禾这两种酶活性无调控作用。与CK相比,WS和EWS处理10 d后草地早熟禾叶片中SOD活性显著降低(Plt;0.05),CK处理下的SOD活性分别是两组处理的2.02倍和1.90倍;CAT活性则显著升高(Plt;0.05),两组处理的CAT活性分别为CK处理的1.54倍和1.66倍;但两组处理之间SOD和CAT活性并无显著差异。在复水恢复后,两种酶的活性均恢复到对照组水平,这说明在水分胁迫期间,喷施乙烯利对调节草地早熟禾水分胁迫和复水过程中的SOD和CAT活性没有作用。
2.3.2 喷施乙烯利对草地早熟禾水分胁迫及复水过程中POD和APX活性的影响 如图4所示,与CK相比,WS处理10 d时草地早熟禾叶片中POD(图4a)和APX(图4b)活性显著增加(Plt;0.05),且两种酶活性较CK处理分别增加2.25倍和2.45倍;第10 d时,EWS处理下POD活性明显高于其他三种处理(Plt;0.05),分别是CK处理的3.94倍,ETH处理的3.01倍和WS处理的1.75倍,但EWS处理下的APX活性与CK相比并未显著改变。复水恢复后,WS和EWS处理后的两种酶活性均下降至对照组水平。表明喷施乙烯利能够显著增强草地早熟禾在水分胁迫下POD的活性,从而提高草地早熟禾干旱胁迫下的自由基清除能力,APX无此作用。
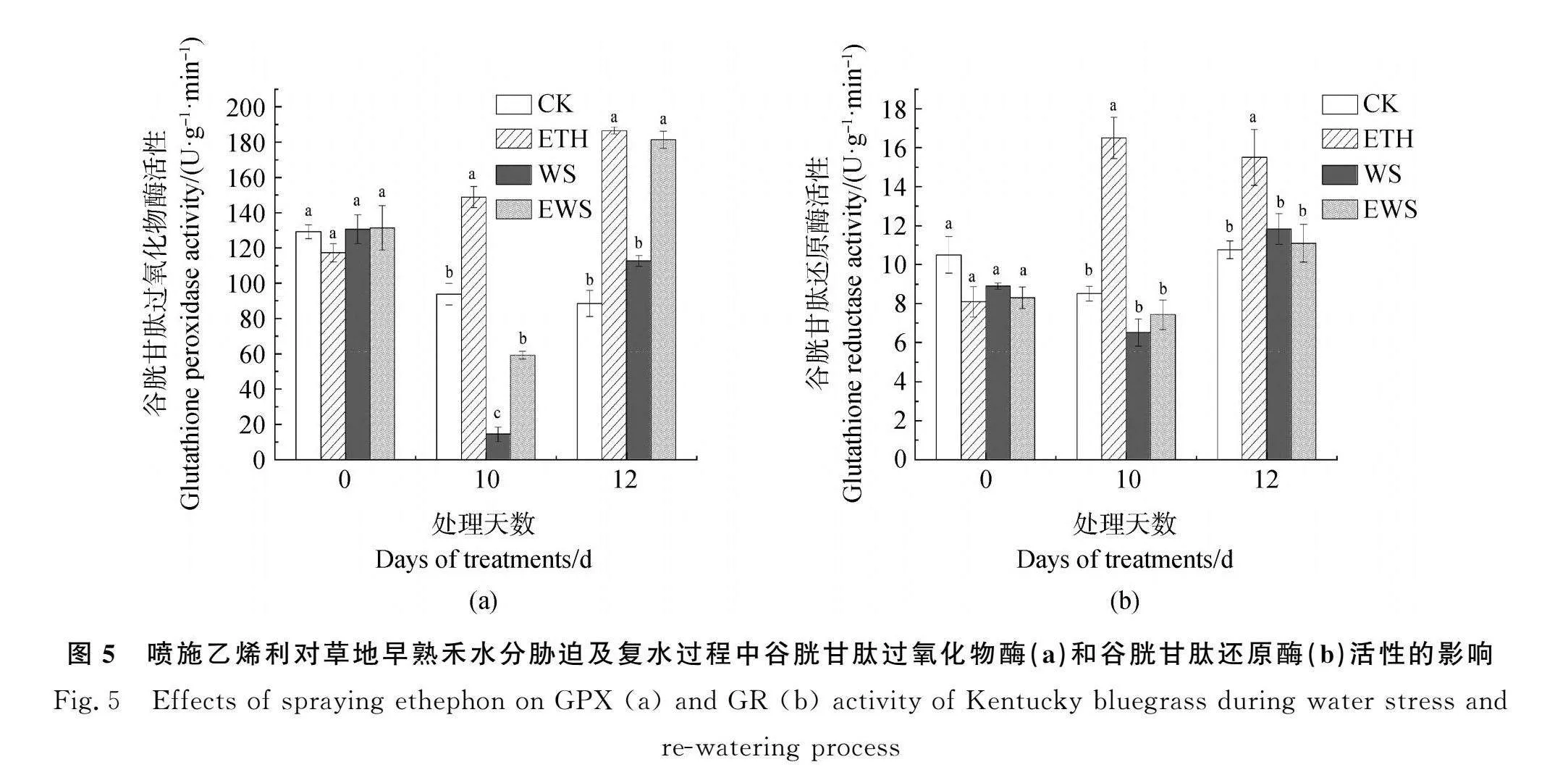
2.3.3 喷施乙烯利对草地早熟禾十分胁迫及复水过程中GPX和GR活性的影响 如图5所示,与CK相比,ETH处理下第10 d和12 d的GPX(图5a)和GR(图5b)活性均显著升高(Plt;0.05),其中GPX活性在10 d和12 d分别增加了1.59倍和2.11倍,GR活性分别增加了1.94倍和1.44倍。说明喷施乙烯利有助于提高草地早熟禾中这两种酶的活性。10 d后,WS处理下GPX活性与CK相比显著降低(Plt;0.05),CK处理的GPX活性是WS处理的6.51倍;EWS处理酶活性是WS处理酶活性的4.11倍,显著高于WS处理(Plt;0.05)。复水后,WS处理下的GPX活性恢复至对照水平,但依旧显著低于EWS处理(Plt;0.05),此时EWS处理下GPX活性是WS处理的1.61倍。说明乙烯利处理能够提高草地早熟禾正常浇水条件、水分胁迫及复水恢复阶段下的GPX活性水平,从而提高草地早熟禾自由基清除能力。但GR活性在WS和EWS处理下无显著变化,复水处理后得到相同的结果,表明GR对清除草地早熟禾水分胁迫及复水恢复阶段产生的自由基无明显作用。
2.3.4 喷施乙烯利对草地早熟禾水分胁迫及复水过程中DHAR和MDHAR活性的影响 如图6所示,第10 d时,各处理下DHAR(图6a)活性均无显著差别。复水后,EWS处理下的DHAR活性是WS处理下的是1.77倍,显著高于WS处理(Plt;0.05);但较CK并无显著升高。说明草地早熟禾中DHAR对水分胁迫不响应,但通过叶片喷施乙烯利,可以提高其在复水恢复过程中的活性,从而促进草地早熟禾逆境损伤的修复。ETH处理第10 d和第12 d,MDHAR(图6b)活性与CK相比均无显著差异,表明正常浇水条件下,乙烯利对MDHAR活性没有影响。与WS处理组相比,第10 d以及复水后EWS处理下草地早熟禾叶片中MDHAR活性无明显变化,表明乙烯利对水分胁迫下MDHAR活性无促进作用。
3 讨论
植物受到干旱胁迫时,通过调节渗透调节物质和抗氧化酶活性等机制提高自身抵抗逆境的能力[24]。一定程度的缺水胁迫,会导致RWC降低、EL及MDA上升[25-26]。本研究中,草地早熟禾生理指标响应干旱情况与其他研究类似,不同的是,本研究中草地早熟禾的RWC降低到约40%,相比其他草地早熟禾耐旱性研究[27-28],本研究处理属于中度水分胁迫,中度水分胁迫降低了SOD活性,促进了CAT和APX酶活性的升高。CAT和APX酶活性的升高说明植物通过这两种酶适应胁迫提升了清除过氧化氢的能力。SOD作为抗氧化系统的第一道防线,具有清除超氧阴离子的重要作用[29],这里SOD活性的下降说明水分胁迫使草地早熟禾清除超氧阴离子能力下降,不少研究也有类似研究结果[30-31]。但也有研究显示,干旱促进植物SOD活性上升[32],我们分析可能是干旱胁迫的程度不一致、植物基因型差异等因素所致。因此不同植物的抗氧化酶系统并不是以相同的模式响应干旱胁迫。干旱对植物抗氧化酶的影响由很多因素共同决定,包括干旱处理的时间、干旱胁迫的程度和植物的抗旱性、基因型差异等。
关于乙烯利的作用,我们发现叶面喷施乙烯利抑制了水分胁迫下草地早熟禾EL和MDA的增加,EL是衡量植物细胞膜透性的重要指标,MDA反映细胞脂质过氧化损伤[29],此结果说明乙烯利在水分胁迫下有助于提高草地早熟禾细胞膜的稳定性,进一步验证了乙烯利在提高草地早熟禾抗旱性中的作用。水分胁迫下POD和GPX两种酶活性在乙烯利作用下明显升高。APX和GPX两种酶均属于POD清除系统,主要作用是将SOD生成的H2O2转化为H2O[33]。乙烯利对干旱胁迫下玉米幼苗的影响研究中也发现乙烯利显著提高水分胁迫下POD的活性[34],但乙烯利对于水分胁迫下GPX活性的影响作用研究很少。本研究说明水分胁迫下,乙烯利主要是通过提高抗氧化酶系统中的POD和GPX的活性达到清除草地早熟禾体内ROS的作用。
MDA含量越高,表明细胞膜脂受到的损伤程度愈大,反之愈小[35-36]。复水恢复阶段,乙烯利显著抑制了草地早熟禾MDA含量的上升。同时,乙烯利显著提升复水过程中GPX和DHAR活性,马玉玲[37]在对大豆干旱复水的过程中(复水7 d)也得出了DHAR活性显著升高的结论。因此,GPX和DHAR这两种抗氧化酶对乙烯利促进草地早熟禾干旱后复水恢复能力具有重要作用。
4 结论
本研究结果表明,乙烯利处理可以缓解草地早熟禾水分胁迫诱导的轻度氧化胁迫损伤,当草地早熟禾受到水分胁迫时,乙烯利通过降低EL的增加,提高POD和GPX活性,以缓解草地早熟禾的氧化损伤。在复水恢复阶段,乙烯利通过减少水分胁迫下MDA的含量,增强GPX及DHAR的活性提升自由基清除能力,减轻细胞膜受氧化程度,进而加快草地早熟禾的胁迫后恢复过程。
参考文献
[1] 李雯婧,应忠敏. 全球干旱区气候特征分析[J]. 现代化农业,2020(5):4-5
[2] 徐松华. 逆境条件下植物体内活性氧代谢研究进展[J]. 安徽农学通报,2021,27(21):29-32
[3] RAJPUT V D,HARISH,SINGH R K,et al. Recent developments in enzymatic antioxidant defence mechanism in plants with special reference to abiotic stress[J]. Biology,2021,10(4):267
[4] 杜昕,李博,毛鲁枭,等. 褪黑素对干旱胁迫下大豆产量及AsA-GSH循环的影响[J]. 作物杂志,2022(1):174-178
[5] 陈雅君. 水分利用效率与草坪草抗旱性研究进展[J]. 东北农业大学学报,2011,42(10):1-5
[6] 叶文兴,张胜男,刘雪婷. 12个草地早熟禾品种幼苗耐盐性分析[J]. 草地学报,2023,31(9):2740-2747
[7] 聂宇东. 外源肌醇施用对草地早熟禾耐盐性的影响[D]. 呼和浩特:内蒙古农业大学,2022:45-48
[8] 陈润娟,雷娅伟,白小明,等. NO对低温胁迫下草地早熟禾抗氧化系统的调控[J]. 草原与草坪,2017,37(6):17-23
[9] 隋永超,冷暖,姜赫男,等. 乙烯利对干旱胁迫下草地早熟禾生理指标的影响[J]. 草业科学,2018,35(4):822-828
[10]DEMIR Y,OZTRK L. Influence of ethephon and 2,5-norbornadiene on antioxidative enzymes and proline content in salt-stressed spinach leaves[J]. Biologia Plantarum,2003,47:609-612
[11]XU C,ZHANG Y P,YANG H B. Effects of ethephon on physiological characteristics and gene expression of Tartary buckwheat under salt stress[J]. Chilean Journal of Agricultural Research,2022,82(2):234-243
[12]KHAN M I R,JAHAN B,ALAJMI M F,et al. Ethephon mitigates nickel stress by modulating antioxidant system,glyoxalase system and proline metabolism in Indian mustard[J]. Physiology and Molecular Biology of Plants,2020,26(6):1201-1213
[13]SHIONO K,EJIRI M,SHIMIZU K,et al. Improved waterlogging tolerance of barley (Hordeum vulgare) by pretreatment with ethephon[J]. Plant Production Science,2019,22(2):285-295
[14]MACIEL C,POLETINE J,RAIMONDI M,et al. Development of turfgrass submitted to application of growth regulators under different light conditions[J]. Planta Daninha,2011,29:383-395
[15]高娅楠. 乙烯利对草地早熟禾(Poa pratensis L.)干旱胁迫下抗氧化酶的影响[D]. 北京:北京林业大学,2021:37-38
[16]韩露,韩烈保,许立新. 乙烯利影响植物抗旱性研究进展[J]. 草地学报,2013,21(4):631-636
[17]DACOSTA M,HUANG B. Changes in antioxidant enzyme activities and lipid peroxidation for bentgrass species in response to drought stress[J]. Journal of the American Society for Horticultural Science,2007,132(3):319-326
[18]ZHANG X,WANG K,ERVIN E H. Bermudagrass freezing tolerance associated with abscisic acid metabolism and dehydrin expression during cold acclimation[J]. Journal of the American Society for Horticultural Science,2008,133(4):542-550
[19]KUK Y I,SHIN J S,BURGOS N R,et al. Antioxidative enzymes offer protection from chilling damage in rice plants[J]. Crop Science,2003,43(6):2109-2117
[20]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:211-213
[21]AEBI H. Catalase in vitro[M]. New york:Methods in Enzymology,1984:121-126
[22]KOCHHAR S,KOCHHAR V,KHANDUJA S. Changes in the pattern of isoperoxidases during maturation of grape berries cv Gulabi as affected by ethephon (2-chloroethyl) phosphonic acid[J]. American Journal of Enology and Viticulture,1979,30(4):275-277
[23]NAKANO Y,ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880
[24]DACOSTA M,HUANG B. Changes in antioxidant enzyme activities and lipid peroxidation for bentgrass species in response to drought stress[J]. Journal of the American Society for Horticultural Science,2007,132(3):319-326
[25]马福林,马玉花. 干旱胁迫对植物的影响及植物的响应机制[J]. 宁夏大学学报(自然科学版),2022,43(4):391-399
[26]苏玮娟,赵桂琴,琚泽亮,等. 干旱胁迫时间对6份饲用燕麦种质萌发期生理指标的影响[J]. 草地学报,2022,30(3):646-654
[27]许立新. 草地早熟禾适应干旱以及干旱后复水恢复机理研究[D]. 北京:北京林业大学,2011:21-22
[28]XU L X,YU J J,HAN L B,et al. Photosynthetic enzyme activities and gene expression associated with drought tolerance and post-drought recovery in Kentucky bluegrass[J]. Environmental and Experimental Botany,2013,89:28-35
[29]张俊霞,刘晓鹏,向极钎. 植物抗氧化系统对逆境胁迫的动态响应[J]. 湖北民族学院学报(自然科学版),2015,33(4):435-439
[30]TERZI R,KADIOGLU A. Drought stress tolerance and the antioxidant enzyme system in Ctenanthe setosa[J]. Acta biologica Cracoviens ia Series Botanica,2006,48(2):89-96
[31]FAROOQ M,RAFIQSHAHZAD,MUHAMMADSAJJAD,et al. Differential variations in total flavonoid content and antioxidant enzymes activities in pea under different salt and drought stresses[J]. Scientia Horticulturae,2021,287(3):110287
[32]ALTAF M A,SHAHID R,REN M,et al. Melatonin improves drought stress tolerance of tomato by modulating plant growth,root architecture,photosynthesis,and antioxidant defense system[J]. Antioxidants,2022,11(2):309
[33]YU H,YUSHIXIE,YANWANG,et al. Ethephon improved drought tolerance in maize seedlings by modulating cuticular wax biosynthesis and membrane stability[J]. Agricultural Economics,2017,48(2):123-133
[34]柳政戎,马明呈,吕才忠,等. PEG-6000模拟干旱胁迫对陕甘花楸耐旱性生理指标的影响[J]. 天津农林科技,2024(1):22-26
[35]GUO Y Y,YU H Y,YANG M M,et al. Effect of drought stress on lipid peroxidation,osmotic adjustment and antioxidant enzyme activity of leaves and roots of Lycium ruthenicum Murr. seedling[J]. Russian Journal of Plant Physiology,2018,65(2):244-250
[36]王晓雪,李越,张斌,等. 干旱胁迫及复水对燕麦根系生长及生理特性的影响[J]. 草地学报,2020,28(6):1588-1596
[37]马玉玲. 干旱胁迫及复水对大豆活性氧清除系统的影响[D]. 哈尔滨:东北农业大学,2018:66-68
(责任编辑 刘婷婷)

