含水量对柱花草青贮品质和微生物群落动态的影响


摘要:本试验旨在探究含水量对‘热研2号’柱花草(Stylosanthes guaianensis SW. ‘Reyan No. 2’)青贮品质及微生物群落动态影响。试验设鲜贮组(F组)和萎蔫组(S组),测定柱花草青贮饲料的动态发酵品质和营养成分,并在青贮14 d和60 d测定细菌群落。结果表明:S组粗蛋白和乙酸含量显著高于F组,丁酸含量显著低于F组(Plt;0.05)。青贮14 d和60 d后,S组青贮饲料梭菌属(Clostridium)丰度显著低于F组(Plt;0.05)。微生物群落(属水平)与发酵指标关联性分析发现柱花草青贮发酵14 d,F组肠杆菌属(Enterobacter)与水溶性碳水化合物含量呈显著负相关,S组肠杆菌属与氨态氮含量呈显著正相关,与CP含量呈显著负相关(Plt;0.05);发酵60 d后,S组肠杆菌属与WSC含量呈显著负相关(Plt;0.05)。综合来看,降低青贮前柱花草的含水量更有利于柱花草青贮饲料营养成分的保存和提高柱花草青贮饲料发酵品质。
关键词:干物质;柱花草;营养成分;微生物多样性;青贮品质
中图分类号:S816.5""" 文献标识码:A"""" 文章编号:1007-0435(2024)08-2648-11
Effects of Moisture Content on the Fermentation Quality and Microbial
Community Diversity of Stylo Silage
HUANG Nai-xin, LI Xue-feng, ZHAN Xiao-xia, CUI Zhi-hai, MAO Kai, CHAI Huan,
WANG Mu-sen, WANG Jian*
(College of Tropical Agriculture and Forestry, Hainan University, Haikou, Hainan Province 570228, China)
Abstract:This experiment aimed to investigate the influence of moisture content on the dynamics of quality of ‘Reyan No. 2’ stylo silage and the bacterial communities. Experimental treatments of fresh stylo (F group) and wilting (S group) were established to investigate the dynamic of fermentation quality and nutritional components. Additionally,the bacterial communities of stylo silages were analyzed on days 14 and 60. The findings revealed that both crude protein and acetic acid content of stylo silage were significantly higher in the S treatment than in the F treatment,while the butyric acid content was significantly lower in the S treatment (Plt;0.05). At the genus level,the relative abundance of Clostridium in the S treatment silage was significantly lower than that in the F treatment silage on days 14 and 60 (Plt;0.05). The correlation analysis of both microbial communities (at the genus level) and fermentation indicators showed that Enterobacter was negatively correlated with the water-soluble carbohydrates content in the F treatment silage after 14 days of ensiling of stylo forage. In addition,the Enterobacter of treatment silage showed a significant (Plt;0.05) positive correlation with ammonia nitrogen content and a significant negative correlation with crude protein content. The Enterobacter of the S treatment silage was negatively correlated with WSC content (Plt;0.05) after 60 days of ensiling. In conclusion,it would be a good approach for preserving nutritional components and enhancing the fermentation quality of stylo silage when reduced the moisture content of the fresh stylo material forage before ensiling.
Key words:Dry matter;Stylo silage; Nutrition composition;Microbial diversity;Silage quality
柱花草(Stylosanthes guaianensis SW. ‘Reyan No.2’)是原产于拉丁美洲的热带豆科牧草,其蛋白质含量高,适口性好,具有耐高温,抗旱适应性强等优点,被广泛种植于热带亚热带地区用作动物的饲草[1]。然而柱花草生产存在季节性,夏秋季节产量大,在冬春季节却几乎生长停滞,这种季节生产的不平衡导致柱花草未能够全年被充分利用,无法发挥出优质豆科牧草用于饲养反刍动物的优势。因此,在柱花草生物量高峰期将其刈割制作成青贮饲料既可保证柱花草能全年利用,也能使当地畜牧业可持续发展。青贮是一种用于青绿饲料长期保存的方法,是基于厌氧条件下产生的乳酸菌发酵,在这个过程中,乳酸菌将牧草中的水溶性碳水化合物转化为有机酸,主要是乳酸,从而降低青贮体系pH值抑制有害微生物的繁殖[2]。在青贮发酵过程中,青贮原料本身的含水量会在很大程度上影响青贮发酵进程和青贮品质。Su等[3] 研究表明降低苜蓿(Medicago sativa)原料的含水量显著影响了苜蓿青贮饲料发酵品质和微生物群落组成,干物质含量高的苜蓿原料在青贮60 d后青贮饲料与干物质含量低的相比具有更低的pH值和更高的乳酸含量。闫兴全等[4]研究发现苜蓿含水量在55%时青贮,发酵品质整体优于70%含水量,55%含水量苜蓿青贮饲料的丁酸含量显著低于70%含水量苜蓿青贮饲料。钟书等[5]对含水量分别为70%和60%的紫花苜蓿进行青贮,发现通过降低青贮原料含水量,能有效抑制酵母菌等有害微生物活性和植物呼吸作用,含水量为60%的紫花苜蓿青贮饲料青贮效果优于含水量为70%的紫花苜蓿青贮饲料。但亦有研究报道新鲜刈割的牧草制备的青贮饲料具有更好的发酵品质,如Ke等[6]研究表明含水量为70%的紫花苜蓿青贮发酵60 d后,pH值,氨态氮含量和干物质损失率显著低于含水量为62%的紫花苜蓿青贮饲料;Bao等[7]研究报道在相同添加剂处理下,原料水分较高的柱花草调制的青贮饲料发酵品质优于水分含量较低的柱花草,具体表现为低pH值,低氨态氮和高乳酸含量。
目前,关于柱花草的青贮研究多集中于不同添加剂对其青贮发酵品质及其营养成分的影响[8-10],对不同含水量柱花草青贮过程中发酵品质及微生物多样性变化报道还较少。因此,本试验对不同含水量的柱花草进行青贮,分析其动态青贮发酵品质,营养成分以及微生物群落的变化,为柱花草调制青贮饲料生产提供理论参考和技术指导。
1 材料与方法
1.1 试验材料
本试验所用材料为‘热研2号’柱花草(Stylosanthes guaianensis ‘Renyan No.2’)种植于海南大学农科试验地(20°06′N,110°32′E),原料采集时间为 2021 年7月12 日,此时柱花草为营养生长期,使用清洁消毒后的镰刀刈割材料,采样时尽量避免植株叶片的脱落,保持茎叶完整。
1.2 试验设计
使用消毒后的手动铡刀将柱花草鲜草切短至2~3 cm,混匀后,随机分为2组,一组为鲜草直接青贮(鲜贮组,简称F组,含水量80% 左右),另一组萎蔫4小时后青贮(萎蔫组,简称S组,含水量69% 左右)。按照试验设计每袋称取250 g柱花草原料分装至聚乙烯塑料袋(22×33 cm)中,每处理3重复,共42袋,使用真空封口机抽真空并密封室温保存,分别在青贮1,3,5,7,14,30 和60 d后进行开袋,取样测定分析其青贮指标及化学成分。
1.3 测定项目及分析方法
1.3.1 柱花草青贮发酵品质测定方法 分别称取不同发酵天数的青贮饲料20 g,放入清洁灭菌后的250 mL广口三角瓶中,加入70 g去离子水,在4℃冰箱浸提24 h后,经4层纱布和定性滤纸过滤后得到的浸提液用于测定pH值,有机酸[乳酸(Lactic acid,LA);乙酸(Acetic acid,AA);丙酸(Propionic acid,PA);丁酸(Butyric acid,BA)和氨态氮(Ammonia nitrogen,NH3-N)]含量。pH值通过CT-6021A型pH计对青贮饲料浸提液直接测定;有机酸采用高效液相色谱仪(日本岛津SHIMADZU-LC 20A) 测定,测定条件:色谱柱为Carbomix H-NP;检测器为SPD-M10AVP;流动相为0.2 mmol·L-1硫酸溶液,流速0.8 mL·min-1,柱温60℃,紫外检测波长 210 nm,进样量10 μL;苯酚-次氯酸钠比色法[11]测定氨态氮含量。
1.3.2 柱花草营养品质测定方法 取适量柱花草鲜草和柱花草青贮饲料用信封装好后置于65℃烘箱干燥 72 h测定干物质(Dry matter,DM);水溶性碳水化合物(Water soluble carbohydrate,WSC)采用蒽酮-硫酸比色法测定[12];粗蛋白质(Crude protein,CP)含量采用全自动凯氏定氮仪(K9860,山东海能科学仪器有限公司)进行测定;中性洗涤纤维(Neutral detergent fiber,NDF)和酸性洗涤纤维(Acid detergent fiber,ADF)含量按照范氏纤维分析法[13]测定样品中的中性和酸性洗涤纤维含量。
1.3.3 微生物计数 采用平板计数法[14]测定乳酸菌,肠杆菌,酵母菌和梭菌的数量。每个样品取10 g与100 mL无菌生理盐水(8.5 g·L-1)充分混合均匀后,将其放入37℃,140 r·min-1的摇床里均质15 min,进行连续梯度稀释(10-2 至10-8),进行涂布后计算微生物菌落数目。乳酸菌在MRS琼脂上 37℃厌氧培养24 h后计数;酵母菌在玫瑰红钠琼脂培养基上 28℃有氧培养 48 h后计数;肠杆菌在紫红胆盐葡萄糖琼脂上 37℃有氧培养72 h后计数;丁酸梭菌在RCM培养基上37℃厌氧培养48 h后计数;以上培养基均购于北京索莱宝科技有限公司。
1.3.4 微生物总DNA提取和细菌菌落分析 参考Long等[15]方法提取青贮14 d和60 d的柱花草青贮饲料样品的DNA,将提取的DNA送至上海派森诺生物科技有限公司进行测序,PCR扩增选用细菌 16S rRNA V3-V4区特异性引物338F(5′-+ACTCCTACGGGAGGCAGCAG-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。使用Illumina NovaSeq机器上利用NovaSeq 6000 SP Reagent Kit (500 cycles)进行 2×250 bp双端测序,再用QIIME2 2019.4 版本进行修改和完善的流程对微生物组生物学信息进行分析原始序列数据。使用demux插件进行解码处理,cutadapt插件进行引物切除,然后使用DADA2插件对序列进行质量过滤,去噪,拼接和嵌合体去除等数据处理。对上述获得的序列按100% 的序列相似度进行归并,生成特征性序列ASVs以及丰度数据表格。使用QIIME2软件计算分析alpha多样性指数(Chao1指数和Simpson指数等),并绘制箱线图,比较不同样品之间ASV的丰富度和均匀度。
1.3.5 数据处理与统计 在Excel 2010 中做数据的基本处理,使用SPSS 26.0 软件对各处理的营养指标和发酵指标进行方差分析,Duncan’s法对数据进行多重比较和显著性分析(Plt;0.05)。
2 结果与分析
2.1 柱花草青贮前的特性
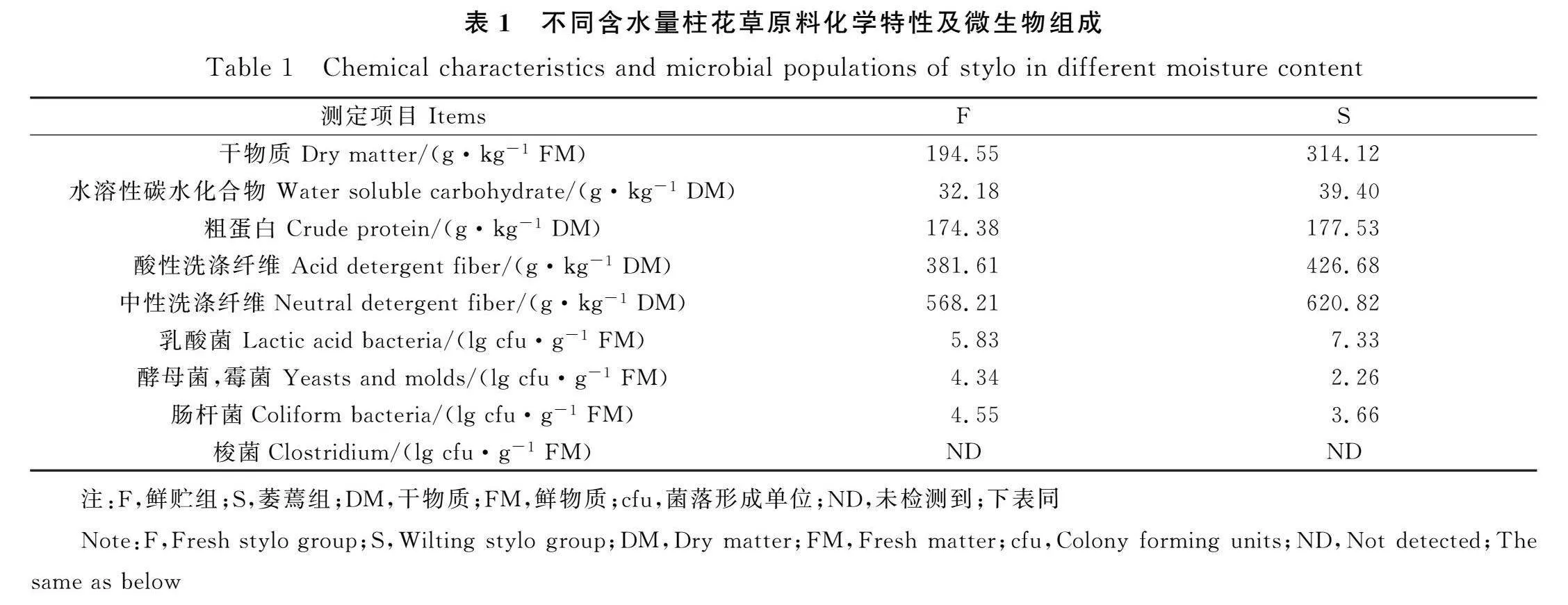
柱花草鲜草化学成分及微生物组成见表1。S组的DM含量为314.12 g·kg-1 FM,CP,ADF,NDF和WSC含量均高于F组。S组的乳酸菌数量为7.33 lg cfu·g-1,高于F组的5.83 lg cfu·g-1,萎蔫后酵母菌,霉菌和肠杆菌数量均低于F组,F组和S组柱花草中均未检测到梭菌。
2.2 柱花草青贮过程中营养成分动态变化
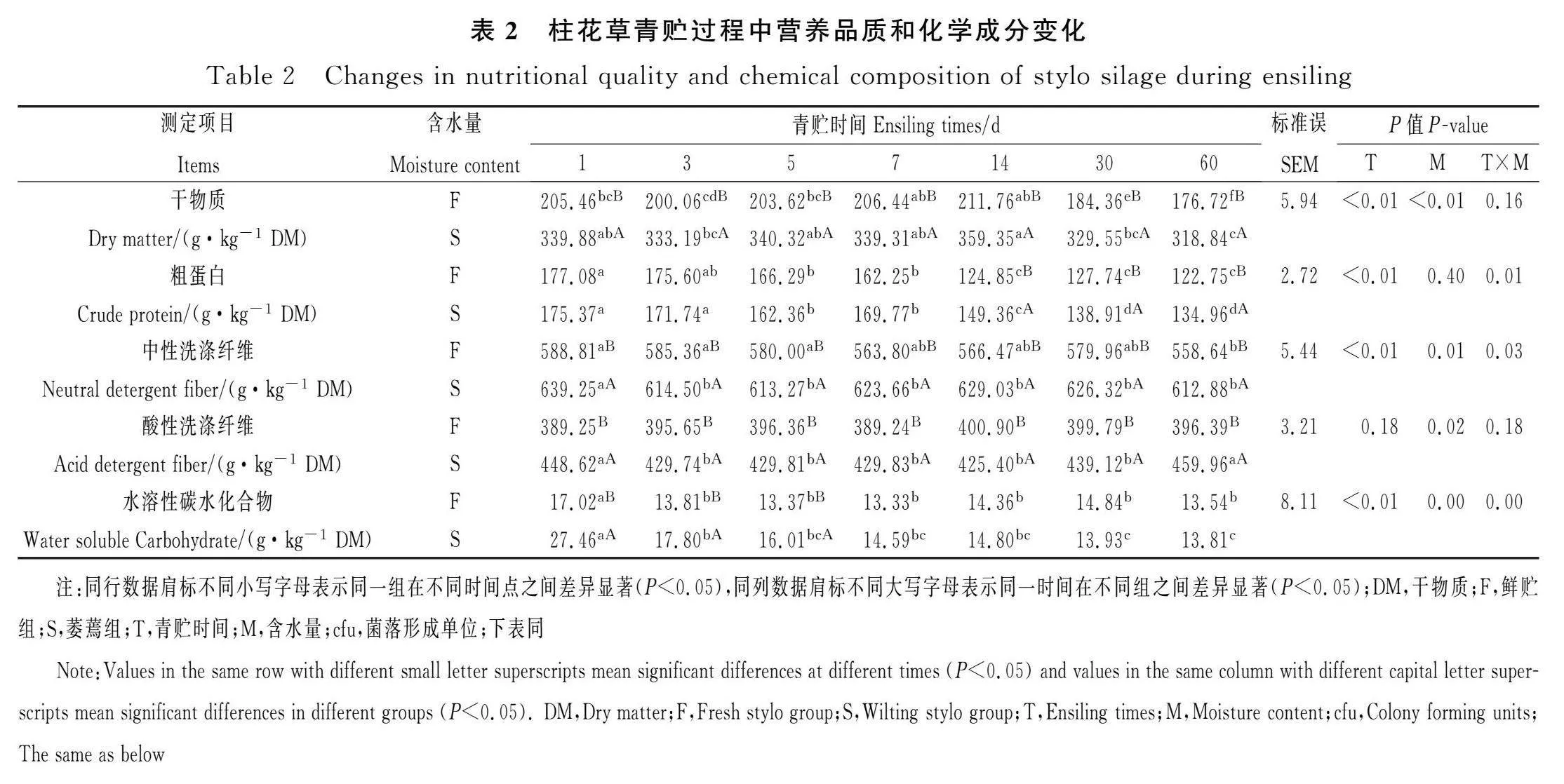
由表2可知,含水量对柱花草青贮饲料的NDF,WSC含量有显著影响(Plt;0.05),随着柱花草含水量的下降,NDF,WSC含量显著上升(Plt;0.05)。青贮时间对青贮饲料的DM,CP,WSC含量亦有显著影响(Plt;0.05),随着青贮天数的增加F组和S组青贮饲料的DM含量呈下降趋势,与青贮第1 d相比,青贮60 d后F组青贮饲料的DM含量显著下降了28.74 g·kg-1 FM(Plt;0.05),S组青贮饲料的DM含量显著下降了21.04 g·kg-1 FM(Plt;0.05);F组青贮饲料的CP含量显著下降了51.00 g·kg-1DM(Plt;0.05),S组青贮饲料的CP含量显著下降了40.41 g·kg-1DM(Plt;0.05);S组青贮饲料的WSC含量显著下降了13.65 g·kg-1DM(Plt;0.05)。含水量×青贮时间对青贮饲料的CP,NDF和WSC含量存在交互作用。
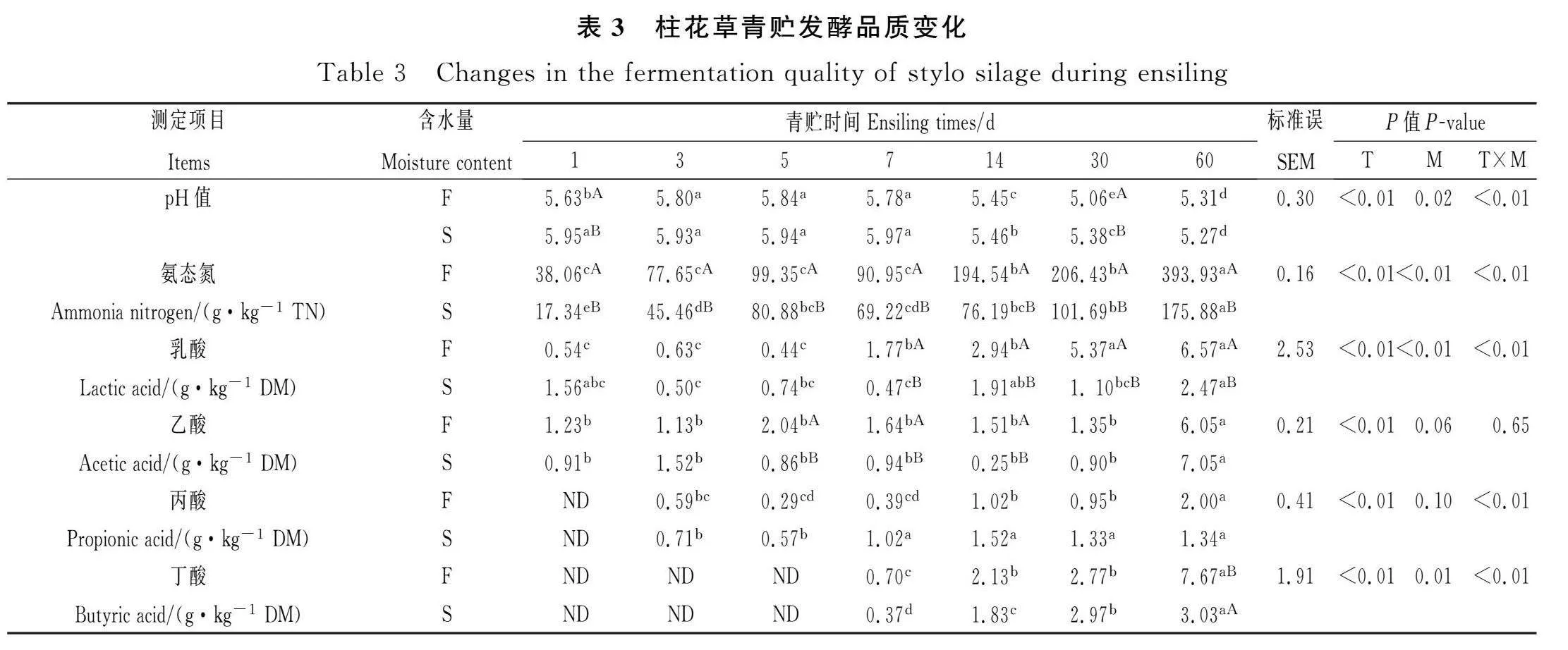
2.3 柱花草青贮过程中发酵品质动态变化
不同含水量柱花草青贮发酵品质变化见表3,含水量对青贮饲料的pH值、氨态氮、乳酸、丙酸和丁酸含量均有显著影响(Plt;0.05)。随着含水量的降低,青贮第30 d F组青贮饲料的pH值显著低于S组青贮饲料(5.06vs 5.38,Plt;0.05);S组青贮饲料的氨态氮在所有的青贮时间点均极显著低于F组青贮饲料(Plt;0.01);青贮第60 d F组青贮饲料乳酸和丁酸含量显著高于S组,F组的乳酸和丁酸的含量分别为6.57 g·kg-1 DM和7.67 g·kg-1 DM,S组的乳酸和丁酸的含量分别为2.47 g·kg-1 DM和3.03 g·kg-1 DM(Plt;0.05)。青贮天数对柱花草青贮饲料pH值,氨态氮,乳酸,乙酸,丙酸和丁酸含量均有显著影响(Plt;0.05)。随着青贮天数的增加,F组青贮饲料的pH值在青贮第30 d后显著下降至5.06(Plt;0.05),S组青贮饲料的pH值在青贮第60 d后显著下降至5.27(Plt;0.05)。F组青贮饲料和S组青贮饲料的NH3-N含量随着青贮时间的增加都呈极显著上升(Plt;0.01),但S组青贮饲料的NH3-N极显著低于F组(Plt;0.01)。在整个青贮发酵期间,F组青贮发酵至第60 d乳酸的含量最高为6.47 g·kg-1 DM;F组和S组青贮饲料的乙酸,丙酸和丁酸含量均随着青贮天数的增多显著增加(Plt;0.05),S组青贮发酵至第60 d乙酸含量最高为7.05 g·kg-1 DM,S组青贮饲料的丙酸含量在青贮14 d达到最大值2.14 g·kg-1 DM,F组青贮发酵至第60 d丁酸含量最高为7.67 g·kg-1 DM。青贮天数×含水量对青贮柱花草的pH值、氨态氮、乳酸、丙酸和丁酸含量存在交互作用(Plt;0.05)。
2.4 不同含水量柱花草青贮14 d和60 d微生物群落变化
2.4.1 alpha多样性 由图1可知,青贮14 d后,F组青贮饲料的Chao 1指数与S组青贮饲料的相比变化显著(Plt;0.05),但青贮60 d后F组青贮饲料的Chao 1指数与S组青贮饲料的相比无显著变化。此外,青贮14 d和60 d的F组青贮饲料和S组青贮饲料的Simpson指数描述微生物群落多样性的指标并无显著差异。
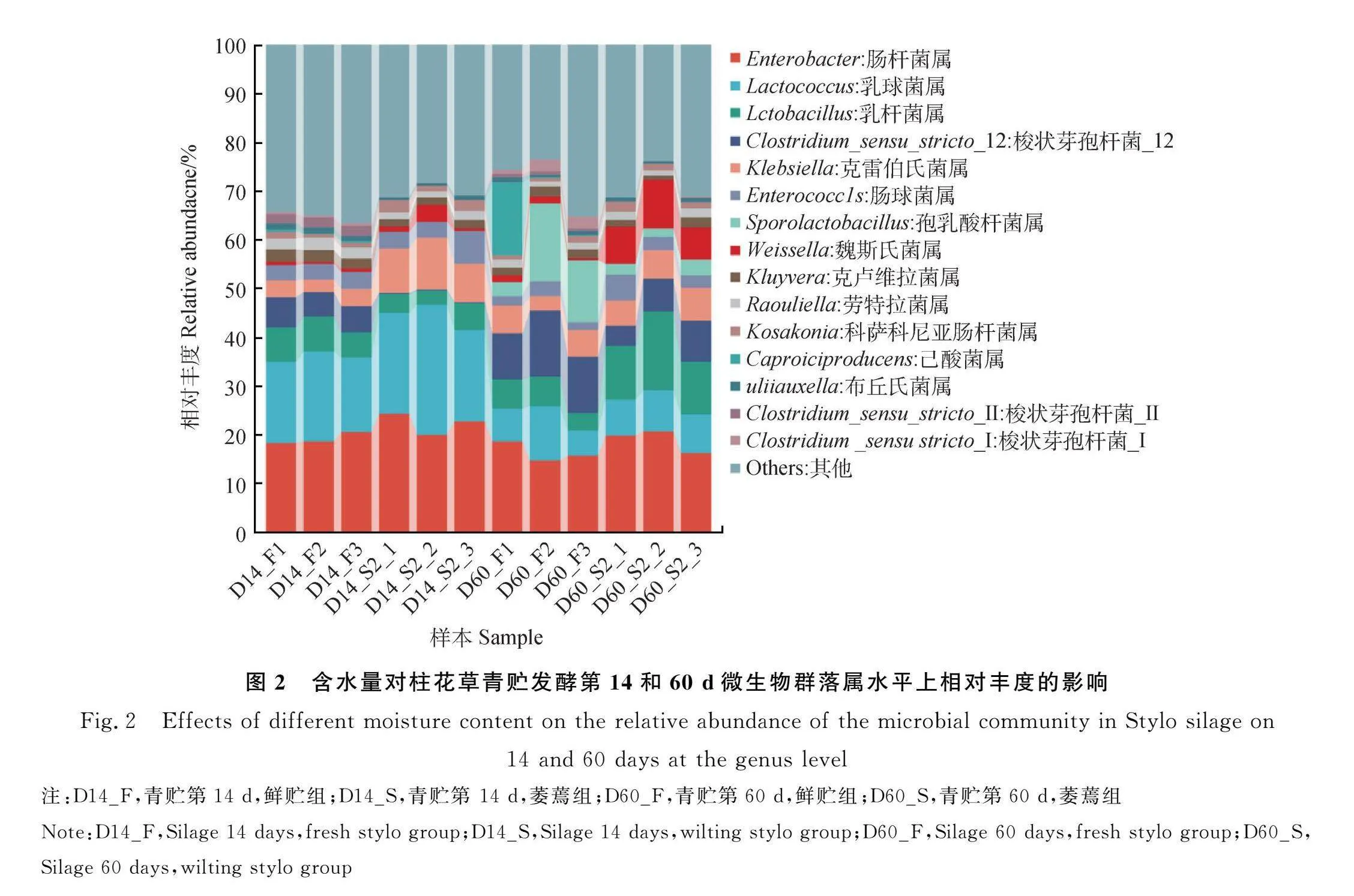
2.4.2 属水平上的微生物多样性分析 不同含水量柱花草在青贮14 d和60 d后在微生物在属水平上的相对丰度差异见图2。随着青贮天数的增加,F组青贮饲料中(D14_F,D60_F)乳球菌属(Lactococcus)相对丰度显著下降(D14_F,16.81%;D60_F,7.70%;Plt;0.05);梭状芽孢杆菌_12(Clostridium_sensu_stricto_12)相对丰度显著增多(D14_F,5.64%;D60_F,11.51%;Plt;0.05);芽孢乳酸杆菌属(Sporolactobacillus)相对丰度显著增多(D14_F,0.00%;D60_F,10.55%;Plt;0.05)。S组青贮饲料中(D14_S,D60_S),乳球菌属相对丰度显著减少(D14_S,21.96%;D60_S,7.89%;Plt;0.05);梭状芽孢杆菌_12相对丰度显著增多(D14_S,0.18%;D60_S,6.49%;Plt;0.05);乳杆菌属(Lactobacillus)相对丰度显著增多(D14_S,4.17%;D60_S,12.64%;Plt;0.05);魏斯氏菌属(Weissella)对丰度显著增多(D14_S,1.67%;D60_S,7.99%;Plt;0.05)。
F组青贮饲料和S组青贮饲料中主要微生物属为肠杆菌属(Enterobacter),乳球菌属,乳杆菌属和梭状芽孢杆菌_12 等。F组青贮饲料与S组青贮饲料相比并未抑制青贮发酵14 d和60 d肠杆菌属的相对丰度(D14_F,19.15%;D14_S,22.37%;D60_F,16.33%;D60_S,18.96%;Plt;0.05),但显著抑制了梭状芽孢杆菌_12 的相对丰度(D14_F,5.46%;D14_S,0.18%;D60_F,11.51%;D60_S,6.49%;Plt;0.05),并且在青贮发酵60 d,降低柱花草含水量显著提升了乳杆菌属和魏斯氏菌属相对丰度(Plt;0.05)。在整个青贮过程中,降低含水量并未对青贮饲料中乳球菌属,克雷伯氏菌属(Klebsiella),肠球菌属(Enterrococcus),克卢维拉菌属(Kluyvera)和劳特拉菌属(Raoultella)的相对丰度有明显影响。
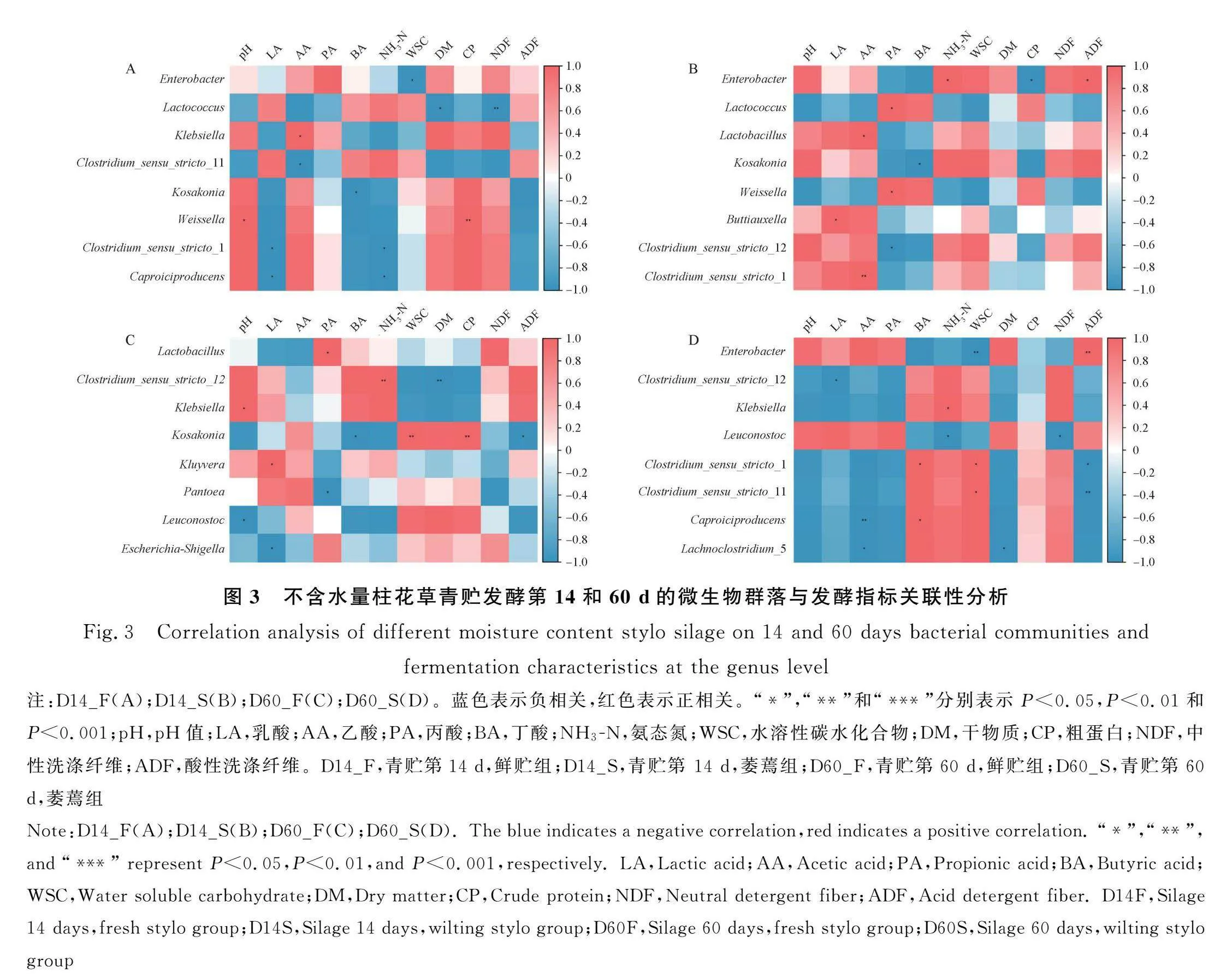
2.4.3 不同含水量柱花草青贮14 d和60 d微生物群落(属水平)与发酵指标关联性分析 通过对不同含水量柱花草青贮14 d和60 d微生物群落(属水平)与发酵指标Pearson关联性分析(图3),发现F组青贮第14 d后(图3A)肠杆菌属与WSC含量呈显著负相关(Plt;0.05);乳球菌属与DM含量呈显著负相关(Plt;0.05),与NDF含量呈极显著负相关(Plt;0.01);克雷伯氏菌属与AA含量呈显著正相关(Plt;0.05);梭状芽孢杆菌_12 与AA含量呈显著负相关(Plt;0.05);科萨科尼亚肠杆菌属(Caproiciproducens)与BA含量呈显著负相关(Plt;0.05);魏斯氏菌属与pH值和CP含量呈极显著正相关(Plt;0.01);梭状芽孢杆菌_1(Clostridium_sensu_stricto_1)与LA,NH3-N含量呈显著负相关(Plt;0.05);己酸菌属(Caproiciproducens)与LA,NH3-N含量呈显著负相关(Plt;0.05)。
F组青贮第60 d后(图3C)乳杆菌属与PA含量呈显著正相关(Plt;0.05);梭状芽孢杆菌_12 与NH3-N含量呈极显著正相关(Plt;0.01),与DM含量呈极显著负相关(Plt;0.01);克雷伯氏菌属与pH值呈显著正相关(Plt;0.05);科萨科尼亚肠杆菌属与BA,ADF含量呈显著负相关,与WSC,CP含量呈极显著正相关(Plt;0.01);克卢维拉菌属与LA含量呈显著正相关(Plt;0.05);泛菌属(Pantoea)与PA含量呈显著负相关(Plt;0.05);明串珠菌属(leuconostoc)与pH值呈显著负相关(Plt;0.05);大肠杆菌属(Escherichia-shigella)与LA含量呈显著负相关(Plt;0.05)。
S组青贮第14 d后(图3B)肠杆菌属与NH3-N含量呈显著正相关(Plt;0.05),与CP含量呈显著负相关(Plt;0.05);乳球菌属与PA含量呈显著正相关(Plt;0.05);乳杆菌属与AA含量呈显著正相关(Plt;0.05);科萨科尼亚肠杆菌属与BA含量呈显著负相关(Plt;0.05);魏斯氏菌属与PA含量呈显著正相关(Plt;0.05);布丘氏菌属(Buttiauxella)与LA含量呈显著正相关(Plt;0.05);梭状芽孢杆菌_12 与PA含量呈显著负相关(Plt;0.05);梭状芽孢杆菌_1与AA含量呈极显著正相关(Plt;0.01)。
S组青贮第60 d后(图3D)肠杆菌与WSC含量呈极显著负相关(Plt;0.01),与ADF含量呈显著正相关(Plt;0.05);梭状芽孢杆菌_12 与LA含量呈显著负相关(Plt;0.05);克雷伯氏菌属与NH3-N含量呈显著正相关(Plt;0.05);明串珠菌属与NH3-N,NDF含量呈显著负相关(Plt;0.05);梭状芽孢杆菌_1与BA,WSC含量呈显著正相关(Plt;0.05),与ADF含量呈显著负相关(Plt;0.05);梭状芽孢杆菌_11 与WSC含量呈极显著正相关(Plt;0.01),与ADF含量呈显著负相关(Plt;0.01);己酸菌属与AA含量呈显著负相关(Plt;0.01),与BA含量呈显著正相关(Plt;0.05);乳梭菌属(Lachnoclostridium_5)与AA,DM含量呈显著负相关(Plt;0.05)。
2.4.4 不同含水量柱花草青贮14 d和60 d微生物群落(属水平)的LEfSe差异物种分析 通过对不同含水量柱花草青贮14 d和60 d微生物群落进行LEfSe(LDA阈值为2)分析,由图4可知,有1个门,3个纲,6个目,11 个科,16 个属在组间丰度存在差异显著(Plt;0.05)。由图4可知,降低柱花草含水量明显会减少富集的青贮微生物种类,D14_F组在纲水平显著富集的物种为阴性菌纲(Negativicutes),在目水平上显著富集的物种为单胞菌目(Selenomonadales),在科水平上显著富集的物种为拜叶林克氏菌科(Beijerinckiaceae),毛螺旋菌科(Lachnospiraceae),韦荣球菌科(Veillonellaceae),在属水平上显著富集的物种为梭状芽孢杆菌属_11(Clostridium_sensu_stricto_11),甲基杆菌属(Methylobacterium),假结核杆菌属 (Pseudocitrobacter),梳状菌属(Pectinatus),乳梭菌属_5(Lachnoclostridium_5)。D14_S组在目水平上显著富集的物种为乳酸杆菌目(Lactobacillales)。在科水平上显著富集的物种为链球菌科(Streptococcaceae),莫拉菌科(Moraxellaceae),在属水平上显著富集的物种为乳球菌属,克雷伯氏菌,不动杆菌属(Acinetobacter)。D60_F组在门水平上显著富集的物种为(Actinobacteria)在纲水平上显著富集的物种为梭菌纲(Clostridia),放线菌纲(Actinobacteria),在目水平上显著富集的物种为梭菌目(Clostridiales),疣微菌目(Verrucomicrobiales),双歧杆菌目(Bifidobacteriales),在科水平上显著富集的物种为梭菌科_1(Clostridiaceae_1),瘤胃菌科(Ruminococcaceae),克曼菌科(Akkermansiaceae),双歧杆菌科(Bifidobacteriaceae),在属水平上显著富集的物种为梭状芽孢杆菌属_12,己酸菌属,梭状芽孢杆菌属_1,阿克曼氏菌属(Akkermansia),双歧杆菌属(Bifidobacterium)。D60_S组在目水平上显著富集的物种为丙酸杆菌目(Propionibacteriales);在科水平上显著富集的物种为乳杆菌科(Lactobacillaceae),丙酸杆菌科(Propionibacteriaceae);在属水平上显著富集的物种为乳杆菌属,嗜酸丙酸杆菌属(Acidipropionibacterium),明串珠菌属。
3 讨论
3.1 柱花草原料特点
在本试验中F组与S组柱花草原料的干物质含量分别为194.55 g·kg-1 FM和314.12 g·kg-1 FM,S组干物质含量与Bao等[7]报道的适宜柱花草青贮的DM含量接近。本试验柱花草CP含量高于Liu等[16]报道的104.1 g·kg-1 DM,NDF和ADF含量均低于邹璇等[17]的报道,相同原料中的营养成分含量有差别,可能是因为品种,生长地域,气候等不同所造成的[18]。本试验柱花草附着乳酸菌的数量已达到良好青贮饲料标准(>5.0 lg cfu·g-1 FW),但因水溶性碳水化合物含量低,缓冲能高等原因,酵母菌和霉菌以及其他有害微生物的附着等原因可能会降低柱花草的青贮品质[19]。
3.2 含水量对柱花草青贮营养品质和发酵特性的影响
青贮饲料营养成分含量会随着青贮时间变化而变化[20],而原料特性会直接影响青贮饲料的发酵品质[21]。本试验结果表明含水量对青贮饲料的DM,NDF,ADF,WSC,pH值,氨态氮,乳酸和丁酸含量均有显著影响,青贮时间对柱花草青贮饲料的DM,CP,NDF,WSC,pH值,氨态氮,乳酸,乙酸,丙酸和丁酸含量有显著影响。在本试验中,两组柱花草青贮饲料的DM,CP和WSC含量都随着青贮时间的增加而下降,在青贮过程中蛋白降解是不可避免的,主要是原料中的梭菌,肠杆菌等有害微生物活动以及植物所含的蛋白水解酶所引起[22]。蛋白质被分解后,会使青贮饲料品质下降,影响反刍动物对蛋白质的吸收和利用[23]。随着青贮时间的增加,本试验中两组青贮柱花草的蛋白质含量都极显著下降,氨态氮含量极显著上升,可能是因为原料中WSC含量远低于良好青贮所需的水溶性碳水化合物含量,乳酸菌等没有充足的发酵底物,无法使青贮饲料快速酸化降低pH值抑制梭菌,肠杆菌等有害微生物对粗蛋白的分解。但通过降低青贮前柱花草含水量有效的抑制了柱花草青贮饲料的粗蛋白的分解,提高柱花草青贮饲料营养成分的保存率。S组柱花草青贮饲料的氨态氮含量显著低于F组柱花草青贮饲料的氨态氮含量,可能是低含水量抑制了如梭菌等微生物活性,而梭菌被认为是引起蛋白分解产生氨态氮的主要微生物[24],本试验中16s rRNA测序数据结果S组梭菌属相对丰度显著低于F组也印证了该推测。本试验S组的NDF和ADF含量显著高于F组,其原因可能是随着植物的含水量下降,其他溶解性化合物的浓度可能会增加,包括矿物质和一些有机物,这些物质不会被纤维测定过程所提取,因此在相对浓缩的状态下,NDF和ADF含量可能会升高,这与郭香等[25]的研究结果相一致。青贮饲料NDF和ADF含量随青贮天数的增加呈下降趋势,与郝俊峰等[26-27]研究结果一致,这可能是因为青贮发酵过程中乳酸菌等微生物分泌特殊的胞外酶会使植物细胞壁中的纤维素,半纤维素等物质降解[28]。
青贮饲料的pH值低于4.2 以下是高品质青贮饲料的标准之一[24],但豆科类作物具有高缓冲能力,自然青贮后的豆科牧草pH值达到4.2 以下并不是作为判断豆科牧草青贮饲料是否为优质饲料的唯一标准[29]。S组青贮饲料pH值高于F组青贮饲料,可能是低水分含量会影响微生物活性和代谢速率,使产酸菌处于生理干旱状态,青贮体系中的无机离子的积累受到抑制,pH值难以下降[5]。青贮发酵60 d,S组青贮饲料乙酸含量高于F组青贮饲料,原因可能是S组青贮饲料中Lactobacillus相对丰度显著高于F组,Lactobacillus会因为发酵糖含量不足而利用乳酸产生更多乙酸[30];S组青贮饲料丁酸含量低于F组青贮饲料,可能是因为梭菌的活性易受青贮体系中水分活度的影响,在低含水量条件下会抑制梭菌的活性,从而降低柱花草青贮饲料中的丁酸的产生[31],亦有研究报道当青贮原料中的干物质含量大于30% 时,可以使青贮发酵过程中的梭菌发酵的风险降低[32]。在柱花草青贮发酵过程中,丁酸含量随着青贮天数的呈上升趋势,这与Silva等[33]的研究一致,这表明本试验柱花草青贮饲料中存在较高的丁酸含量这也可能是造成柱花草青贮饲料整体pH值> 5.0 的原因之一。结合属水平上微生物群落分析结果,在青贮发酵14 d和60 d时都可以检测到梭菌属的存在,这与较高的pH值和丁酸的存在一致。
3.3 含水量对柱花草青贮微生物多样性的影响
青贮是由多种微生物共同参与的群落演替过程,涉及许多复杂微生物的相互作用,因此研究青贮饲料的微生物群落结构具有十分重要的意义[34]。本试验分析了不同含水量柱花草青贮14 d和60 d青贮发酵微生物多样性。在不同处理组之间,随含水量的降低,青贮14 d微生物群落丰富度显著下降,青贮60 d后对微生物群落丰富度无显著影响,这与Chen等[35]的青贮发酵天数对大蒜皮混合高水分皇竹草(Pennisetum hydridum)青贮发酵品质和微生物群落影响研究结果相似,因此可以推测青贮微生物群落丰富度的变化不仅与青贮原料含水量有关联,还与青贮时间有关联。
属水平的微生物丰度分析表明,柱花草青贮发酵60 d后,肠杆菌属,乳球菌属,乳杆菌属和梭菌属等是最主要的微生物属,这与He等[36] 的研究结果不一致,其研究发现柱花草青贮60 d后优势微生物属种类为乳杆菌属,梭菌属,肠球菌属和魏斯氏菌属等,相同材料青贮发酵后优势微生物不同可能是受生长地域气候,原料特性或栽培管理条件的不同所导致[37]。
F组与S组相比,通过降低青贮原料含水量显著降低了青贮发酵体系中梭菌属的相对丰度。发酵60 d后,相较于F组,S组青贮饲料的乳杆菌属的相对丰度显著提升,这与Fang等[24]的研究结果一致,表明降低柱花草含水量可以显著降低有害菌梭菌属相对丰度,提高有益菌乳杆菌属相对丰度。随着青贮时间的增加,F组和S组乳球菌属相对丰度均显著下降,这与McDonald等[38]的研究结果一致,这可能是因为乳球菌属主要在青贮前期参与青贮发酵进程,产生乳酸,降低青贮饲料pH值[39];F组和S组梭菌属相对丰度显著上升,可能是梭菌属于严格厌氧芽孢菌,在青贮前期植物纤维空隙中残留的氧气对梭菌活性具有抑制作用,随着青贮时间的增加,青贮体系内的氧气被好氧微生物消耗殆尽,梭菌芽孢恢复活性[40]。
通过Pearson相关性分析发现,D14_F组肠杆菌属与WSC含量呈显著负相关(Plt;0.05),D14_S组肠杆菌属与氨态氮含量呈显著正相关(Plt;0.05),与CP含量呈显著负相关(Plt;0.05),D60_S组肠杆菌属与WSC含量呈极显著负相关(Plt;0.01),研究发现[35]肠杆菌会利用青贮饲料中的WSC和CP,产生丁酸、氨态氮和生物胺等不良发酵产物,抑制乳酸菌繁殖和生长,影响青贮饲料的品质,Pearson相关性分析表明肠杆菌属可能抑制了柱花草的青贮发酵进程,与乳酸菌等有益微生物争夺青贮原料中的发酵底物,代谢产生不良产物。乳酸菌被认为是决定青贮饲料品质的最关键的微生物,本试验研究发现D60_F组乳杆菌属与柱花草青贮饲料丙酸含量呈显著正相关(Plt;0.05),这与Zeng等[41] 的研究结果不一致,其作用还需进一步研究。
4 结论
降低青贮前柱花草含水量提高了柱花草青贮饲料的粗蛋白含量,降低氨态氮和丁酸含量。此外,降低含水量显著影响柱花草青贮属水平上的细菌群落结构,萎蔫后柱花草青贮饲料中的不良微生物梭菌属相对丰度显著低于高含水量柱花草青贮饲料,有益微生物魏斯氏菌属和乳杆菌属相对丰度显著高于高含水量柱花草青贮饲料。综上所述,降低青贮前柱花草的含水量更有利于改善柱花草青贮饲料发酵品质和营养成分的保存。
参考文献
[1] 韩建成,吴群,蔺红玲,等. ‘热研2号’柱花草和‘热研4号’王草混合青贮对其营养成分及发酵品质的影响[J]. 热带作物学报,2023,44(4):809-815
[2] KUNG JR L,SHAVER R,GRANT R,et al. Silage review:Interpretation of chemical,microbial,and organoleptic components of silages[J]. Journal of Dairy Science,2018,101(5):4020-4033
[3] SU R,KE W,USMAN S,et al. Dry matter content and inoculant alter the metabolome and bacterial community of alfalfa ensiled at high temperature[J]. Applied Microbiology and Biotechnology,2023,107(11):3443-3457
[4] 闫星全,贾玉山,格根图,等. 原料含水量及添加剂种类对青贮苜蓿品质的影响[J]. 草地学报,2023,31(6):1861-1866
[5] 钟书,张晓娜,杨云贵,等. 乳酸菌和纤维素酶对不同含水量紫花苜蓿青贮品质的影响[J]. 动物营养学报,2017,29(5):1821-1830
[6] KE W,DING Z,LI F,et al. Effects of malic or citric acid on the fermentation quality,proteolysis and lipolysis of alfalfa silage ensiled at two dry matter contents[J]. Journal of Animal Physiology and Animal Nutrition,2022,106(5):988-994
[7] BAO J,WANG L,YU Z,et al. Effects of different moisture levels and additives on the ensiling characteristics and in vitro digestibility of stylosanthes silage[J]. Animals,2022,12(12):1555
[8] HE L,LI S,WANG C,et al. Effects of vanillic acid on dynamic fermentation parameter,nitrogen distribution,bacterial community,and enzymatic hydrolysis of stylo silage[J]. Frontier in Microbiology,2021(12):690801
[9] 黄佩珊,张超,陈丹丹,等. 辣木叶提取物对柱花草和象草青贮品质的影响[J]. 草地学报,2023,31(7):2194-2202
[10]王坚,李雪枫,王学梅,等. 添加剂对柱花草青贮过程中蛋白降解及营养成分影响[J]. 饲料研究,2020,43(10):84-89
[11]WEATHERBURN M W. Phenol-hypochlorite reaction for determinations of ammonia[J]. Annual of Chemistry,1967,39 (8):971-974
[12]OWENS V N,ALBRECHT K A,MUCK R E,et al. Protein degradation and fermentation characteristics of clover and alfalfa silage harvested with varying levels of total nonstructural carbohydrate[J]. Crop Science,1999,9 (6):1873-1880
[13]VAN SOEST P J,ROBERTSON J B,LEWIS B A. Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science,1991,74 (10):3583-3597
[14]FU Z,SUN L,HOU M,et al. Effects of different harvest frequencies on microbial community and metabolomic properties of annual ryegrass silage[J]. Frontiers in Microbiology,2022(13):971449
[15]LONG S,LI X,YUAN X,et al. The effect of early and delayed harvest on dynamics of fermentation profile,chemical composition,and bacterial community of king grass silage[J]. Frontiers in Microbiology,2022(13):864649
[16]LIU Q,ZHANG J,SHI S,et al. The effects of wilting and storage temperatures on the fermentation quality and aerobic stability of stylo silage[J]. Animal Science Journal,2011,82(4):549-553
[17]邹璇,王成,陈晓阳,等. 桉叶油和迷迭香油对柱花草青贮品质的影响[J]. 中国草地学报,2022,44(2):89-97
[18]付东青. 南北疆两个区域青贮玉米农艺性状与青贮品质研究[D]. 石河子:石河子大学,2021:3-6
[19]ZANG Y C,LI D X,WANG X K,et al. Fermentation dynamics and diversity of bacterial community in four typical woody forages[J]. Annals of Microbiology,2019,69 (3):233-240
[20]MCENIRY J,O’KIELY P,CLIPSON N J W,et al. Assessing the impact of various ensilage factors on the fermentation of grass silage using conventional culture and bacterial community analysis techniques[J]. Journal of Applied Microbiology,2010,108(5):1584-1593
[21]GUAN H,YAN Y,LI X,et al. Microbial communities and natural fermentation of corn silages prepared with farm bunker-silo in Southwest China[J]. Bioresource Technology,2018(265):282-290
[22]BORREANI,GTABACCOE,SCHMIDT R J,et al. Silage review:factors affecting dry matter and quality losses in silages[J]. Journal of Dairy Science,2018,101(5):3952-3979
[23]CHEN R,LI M,YANG J,et al. Exploring the effect of wilting on fermentation profiles and microbial community structure during ensiling and air exposure of king grass silage[J]. Frontiers in Microbiology,2022(13):971426
[24]FANG D,DONG Z,WANG D,et al. Evaluating the fermentation quality and bacterial community of high-moisture whole-plant quinoa silage ensiled with different additives[J]. Journal of Applied Microbiology,2022,132(5):3578-3589
[25]郭香,陈德奎,陈娜,等. 含水量和添加剂对黄梁木叶青贮发酵品质的影响[J]. 草业学报,2021,30(8):199-205
[26]郝俊峰,于浩然,贾玉山,等. 青贮密度和青贮时间对紫花苜蓿发酵品质及营养成分的影响[J]. 草地学报,2022,30(9):2492-2496
[27]胡炜东,曹晓娟,武俊英,等. 发酵时间对燕麦青贮发酵品质和微生物群落的影响[J]. 饲料研究,2022,45(17):106-110
[28]ZHANG J,LIU Y,WANG Z,et al. Effects of different types of LAB on dynamic fermentation quality and microbial community of native grass silage during anaerobic fermentation and aerobic exposure[J]. Microorganisms,2023,11(2):513
[29]JOBIM C C,NUSSIO L G,REIS R A,et al. Methodological advances in evaluation of preserved forage quality [J]. Revista Brasileira de Zootecnia,2007(36):101-119
[30]NISHINO N,LI Y,WANG C,et al. Effects of wilting and molasses addition on fermentation and bacterial community in guinea grass silage[J]. Letters in Applied Microbiology,2012,54(3):175-181
[31]ZHENG M L,NIU D Z,JIANG D,et al. Dynamics of microbial community during ensiling direct-cut alfalfa with and without LAB inoculant and sugar[J]. Journal of Applied Microbiology,2017,122(6):1456-1470
[32]KUNG L,STOUGH E C,MCDO NELL E E,et al. The effect of wide swathing on wilting times and nutritive value of alfalfa haylage [J]. Journal of Dairy Science,2010,93(4):1770-1773
[33]DA SILVA J S,RIBEIRO K G,PEREIRA O G,et al. Nutritive value and fermentation quality of palisade grass and stylo mixed silages[J]. Animal Science Journal,2018,89(1):72-78
[34]郑明利. 苜蓿青贮中梭菌多样性及其诱发梭菌发酵的机理研究[D].北京:中国农业大学,2017:11-15
[35]CHEN J,HUANG G,XIONG H,et al. Effects of mixing garlic skin on fermentation quality,microbial community of high moisture Pennisetum hydridum Silage[J]. Frontiers in Microbiology,2021(12):770591
[36]HE L,WANG C,XING Y,et al. Ensiling characteristics,proteolysis and bacterial community of high-moisture corn stalk and stylo silage prepared with Bauhinia variegate flower[J]. Bioresource Technology,2020(296):122336
[37]HUANG Y,QIU C,WANG Y,et al. Effect of tea polyphenols on the fermentation quality,protein preservation,antioxidant capacity and bacterial community of stylo silage[J]. Frontiers in Microbiology,2022(13):993750
[38]MCDONALD P,HENDERSON A R,HERON S J. The biochemistry of silage (2nd Editon) [M]. Aberystwyth:Mambrian Printers Ltd,1991:15-238
[39]GUO X,ZHENG P,ZOU X,et al. Influence of pyroligneous acid on fermentation parameters,co2 production and bacterial communities of rice straw and stylo silage[J]. Frontiers in Microbiology,2021(12):1434
[40]徐莹. 丁酸梭菌清液发酵工艺的研究[D]. 武汉:华中农业大学,2009:6-9
[41]ZENG T,LI X,GUAN H,et al. Dynamic microbial diversity and fermentation quality of the mixed silage of corn and soybean grown in strip intercropping system[J]. Bioresource Technology,2020(313):123655
(责任编辑 刘婷婷)

