水分胁迫对兰花“曙光”生理生化指标的影响研究
徐锐仙+刘忠贵
摘 要:以兰花“曙光”为材料,研究初花期水分胁迫对植株的叶绿素、可溶性糖、可溶性蛋白、淀粉和氨基酸含量的影响。结果表明:与对照处理(5d)浇水一次的处理对植株产生的效果相比,每隔15d浇水一次植株的叶绿素、可溶性糖、可溶性蛋白和游离氨基酸含量最高,每隔10d浇水一次和每隔15d浇水一次植株的淀粉都较高,且差异不显著,同时每隔20d浇水一次时,上述生理生化指标含量均下降,表明随水分胁迫强度的加剧,叶绿素、可溶性糖、可溶性蛋白和游离氨基酸积累下降。
关键词:兰花“曙光”;水分胁迫;生理生化指标
中图分类号 S68 文献标识码 A 文章编号 1007-7731(2015)12-32-04
1 引言
‘曙光是由母本西藏虎头兰‘黄素花(Cymbidium tracyanum L.Castle)和父本大雪兰(Cymbidium mastersii)杂交选育而成的兰花新品种。四季常绿,叶带状,14~20枚;花葶高52~55cm,着花6~12朵,花朵自然水平展开9.6~13.2cm,有香味;萼片和花瓣均为金黄至卵黄色,切花瓣稍宽(1.4±0.2)cm,唇瓣左右裂片之间有2行金黄色毛,合蕊柱背和腹面为红色;花期40~60d,瓶插期20~45d。适宜在亚热带或气候相近的温暖地区保护地栽培,并且该植物具有适应范围、温度的广泛性的特点,为其推广性的栽培及观赏方面的应用提供了可能性[1]。
植物除因土层中缺水引起水分胁迫外,干旱、淹水、冰冻、高温或盐碱条件等不良环境作用于植物体时,都可能引起水分胁迫。不同植物及品种对水分胁迫的敏感度不同,影响不一。如刘福建等[2]报道了水分胁迫对澳洲坚果生理生化指标的影响,表明在水分胁迫下,处理间的叶绿素、总糖和淀粉含量随水分胁迫强度的加剧而下降。王丹等[3]报道了水分胁迫对草莓叶片生理特性的影响,表明随着胁迫程度的增加和胁迫时间的延长,可溶性糖和脯氨酸的积累增加。王存纲等报道了水分胁迫对大岩桐生理生化指标的影响[4],汤伟权等报道了水分胁迫对大叶铁线莲生理生化指标的影响[5],李光等报道了[6]水分胁迫对金线兰地上茎组培苗生理生化的影响。而对于水分胁迫下兰花新品种“霞光”花期植株的生理特性指标的研究目前尚未见报道。为此,本研究通过测定分析水分胁迫不同时间与对照处理下兰花“霞光”的生理生化的变化规律,探索水分胁迫与兰花“霞光”花期的关系,为兰花的抗旱机理和栽培技术提供理论依据。
2 材料与方法
2.1 试验材料 供试材料为兰花‘曙光植株,选择外形、株高和叶片数大致相当的,第3年复花的优良植株,均为本课题组的自主培育的具有自主知识产权的兰株。
2.2 试验方法 试验于2013年7月在公司大棚内进行,将挑选出的12盆植株分为4组,每组3盆,对植株进行编号。采用每隔5d、10d、15d、20d浇一次水的控水方法,待到植株开花的初期,于早晨8:00~9:00,选取开花植株的叶片,并洗净待测。栽培环境:大棚内布有20%的遮光网,栽培基质一律使用1/4树皮+1/4泥炭+1/4椰糠+1/4陶粒的混合基质[7],日温(22±2℃),夜温(12±2℃)。
2.3 测定方法
2.3.1 叶绿素的测定方法[8] 称取新鲜叶片0.1g,剪碎,放入研钵中,加入少量石英砂、碳酸粉及2~3mL80%丙酮,研磨匀浆,再加入纯丙酮10mL研成匀浆,暗处静置约10min。将提取液过滤到25mL棕色容量瓶中,用丙酮反复冲洗研钵与研棒数次,并用少量丙酮反复冲洗滤纸和残渣,直到无绿色为止,以便色素全部转移入容量瓶,最后用纯丙酮定容至25mL刻度线,摇匀,并保存于暗处备用检测。在波长663nm和645nm下测定吸光度(A663和A645),依据公式(1)~(4),分别计算出叶绿素a和叶绿素b的浓度:
Ca=12.72A663-2.59A645 (1)
Cb=20.13A645-5.03A663 (2)
叶绿素CT=Ca+Cb (3)
式中:Ca和Cb分别为叶绿素a和叶绿素b的浓度(mg·g-1)。
叶绿体色素含量(mg·g-1FM)=
[C×提取液总体积(mL)×稀释倍数FM(g)×1000] (4)
式中:C:叶绿体色素的浓度(mg·g-1);FM:鲜重(g)。
2.3.2 可溶性糖、淀粉含量的测定方法(蒽酮法)[8] 称取兰花叶片鲜样0.5g,剪碎放入具塞试管中,然后加入蒸馏水10mL,在水浴锅中沸水浴20min,冷却后过滤,滤液收集在100mL容量瓶中,定容即为可溶性糖待测液。每组样品重复3次。将提取可溶性糖以后剩余的残渣移入试管中,添加20mL蒸馏水,沸水浴15min,加入9.2mol·L-1的高氯酸溶液2mL,提取15min冷却后过滤,定容至100mL,即为淀粉待测液,每组样品重复3次。待测液分别在620nm波长下测定吸光度。代入公式(5)、(6)计算结果:
可溶性糖(mg·g-1)=[标准曲线所查出的值(μg)/103×提取液总体积(mL)×稀释倍数样品鲜重(g)×测量时加样量(mL)×100] (5)
淀粉含量(mg·g-1)=[标准曲线所查出的值(μg)/103×提取液总体积(mL)×0.9样品鲜重(g)×测量时加样量(mL)] (6)
2.3.3 可溶性蛋白含量测定方法[8](考马斯亮蓝法) 称取兰花叶片鲜样0.2g,剪碎加入少许的石英砂和蒸馏水研磨,之后转入10mL的容量瓶(用蒸馏水冲洗研钵2~3次合并于容量瓶中),定容至10mL。摇匀之后,取3mL匀浆移入离心管中,5 000g,离心10min,上清液移入烧杯中即为待测溶液。在595nm处,测定吸光度,并通过标准曲线查的蛋白质的含量。代入公式(7)计算结果:
可溶性蛋白含量=[标准曲线所查出的值(μg)/103×提取液总体积(mL)×稀释倍数样品鲜重(g)×测量时加样量(mL)] (7)
2.3.4 游离氨基酸含量的测定方法(茚三酮法)[9] 取叶片0.5g,剪成0.5cm宽的碎段,放入20mL的刻度试管中,加10mL蒸馏水,沸水浴加热提取20min,冷却后备用。用7200分光光度计比色(610nm、1cm光径的比色皿),读出吸光度(A)查标准曲线,求出样品氨基态氮的含量。代入公式(8)计算结果:
氨基酸含量=[标准曲线所查出的值(μg)/103×提取液总体积(mL)×稀释倍数样品鲜重(g)×测量时加样量(mL)] (8)
2.4 数据处理 数据用Excel 2003进行绘制,处理;用统计分析软件dps7.05进行方差分析
3 结果与分析
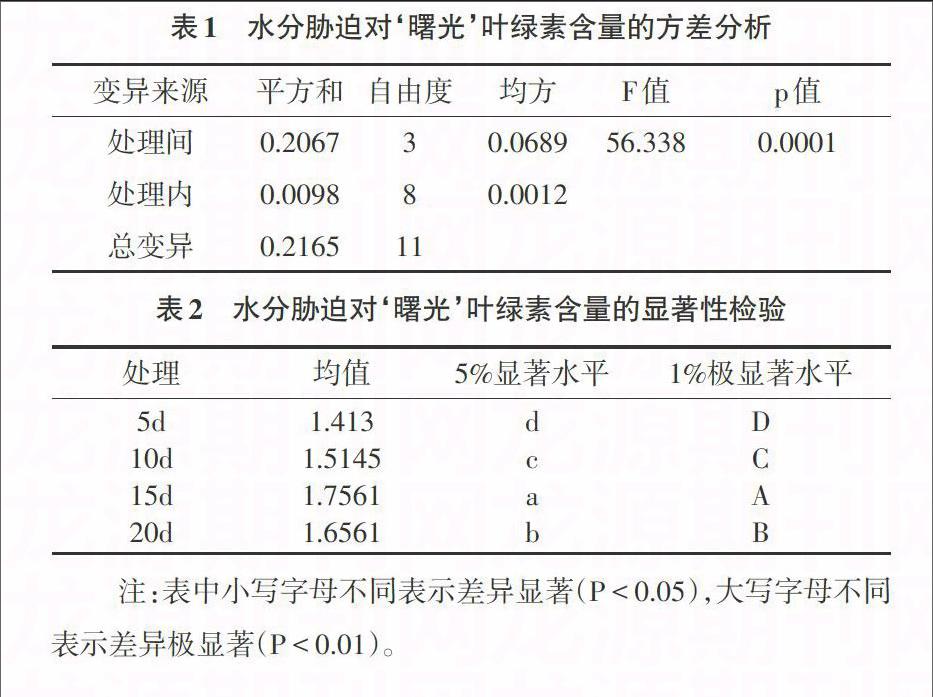
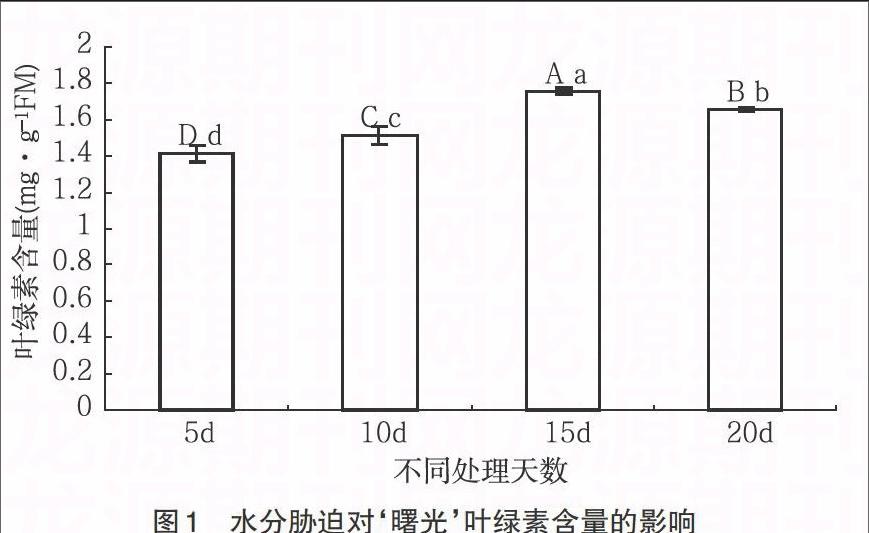
3.1 水分胁迫对叶绿素含量的影响 从试验结果可以看出,随着水分胁迫处理天数不同,兰花“曙光”叶片中的叶绿素含量有明显的差异(表1、表2)。由图1可知,以对植株进行5d浇水为对照,对植株进行15d处理过的兰花叶绿素含量显著增加,增加幅度最大,叶绿素含量高于对照5d24.3%,10d16%,20d6.0%(P<0.01);对植株进行10d的处理与对照相较,叶绿素含量上升不显著,上升幅度不显著,高于对照7.2%(P<0.01);而进行隔20d浇水一次的处理兰花叶片中的叶绿素含量上升量在10d处理和15d处理之间,分别高于10d处理9.3%,低于15d处理5.7%(P<0.01)。
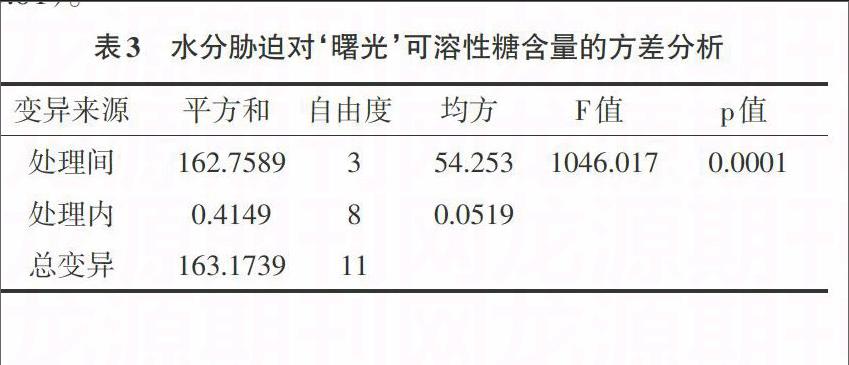
3.2 水分胁迫对可溶性糖含量的影响 从试验结果可以看出,水分胁迫对可溶性糖有明显影响(表3、表4)。由图2可知,以5d浇水一次的处理为对照,对植株15d浇水一次的处理中可溶性糖含量显著增加,高出216.8%(P<0.01),其增加量为最高;对兰花进行15d浇水的组增加趋势不明显,上升趋势最小,比5d浇水的高出47.6%(P<0.01);水分胁迫处理天数为20d的处理中可溶性糖含量增加幅度介于15d处理与10d处理之间,高于对照组189.3%,低于15d处理8.7%,高于10d处理95.7%(P<0.01)。
3.3 水分胁迫对淀粉的影响 从试验结果可以看出,水分胁迫对叶片中淀粉含量有一定影响(表5、表6)。由图3可知,以兰花进行5d浇水的水分胁迫处理组为对照,相隔10d浇水的组植株叶片中淀粉含量明显增加,增加量最高,为47.6%(P<0.01),15d浇水一次的处理次之,为32.6%(P<0.01),每20d浇水一次的处理中淀粉含量增加幅度较之对照最不显著,上升量最低,高于对照17.5%(P<0.01)。
3.4 水分胁迫对可溶性蛋白的影响 从试验结果可以看出,受水分胁迫影响,可溶性蛋白含量有着明显变化(表7、表8)。由图4可知,每隔15d进行浇水的组与每隔5d浇水的处理(对照)相比,叶片中的可溶性蛋白含量显著增加,增加91.3%(P<0.01)。10d浇水一次的处理中的可溶性蛋白含量与对照组中的差异不显著,高出48.3%(P<0.01)。20d浇水的处理有上升趋势,比5d浇水的对照高76.9%,高出变化趋势低于15d处理14.9%但高于10d处理10.7%(P<0.01)。
3.5 水分胁迫对游离氨基酸含量的影响 从试验结果可以看出,随着对土壤中水分含量的改变,兰花叶片中游离氨基酸的含量有明显差异(表9、表10)。由图5可知,对兰花进行15d浇水处理的组,其叶片中的游离氨基酸含量明显高于5d浇水的处理164.7%(P<0.01),浇水10d的处理与对照5d为为浇水相比,兰花叶片中的氨基酸含量,没有变化,间隔最长(20d)的组中游离氨基酸含量明显下降,显著低于对照27.3%,低于氨基酸含量最高的15d处理62.2%(P<0.01)。
4 讨论
叶绿素是植物光合色素中最重要的一类色素,其含量可受多种逆境的胁迫而改变。叶绿素含量的多少在一定程度上反映了植物光合作用强度的高低,从而影响植物生长。在水分胁迫环境中,植物为了减缓由胁迫造成的生理代谢不平衡,细胞大量积累一些小分子有机化合物,如脯氨酸、甜菜碱等,以通过渗透调节来降低水势,维持较高的渗透压,保证细胞的正常生理功能。植物中的可溶性糖是水分胁迫诱导的小分子溶质之一,可溶性糖类参与渗透调节,并可能在维持植物蛋白质稳定方面起到重要作用[10]。水分亏缺时细胞合成过程减弱而水解过程加强,淀粉水解为糖,蛋白质水解形成氨基酸,水解产物又在呼吸中消耗;水分亏缺初期由于细胞内淀粉、蛋白质等水解产物增亥,吸呼底物增加,促进了呼吸,时间稍长,呼吸底物减少,呼吸速度即降低,导致正常代谢进程紊乱,代谢失调。在水分胁迫下,植物内的正常蛋白质合成会受到抑制。可溶性蛋白与调节植物的渗透势有关,高含量的可溶性蛋白可以维持植物细胞较低的渗透势,抵抗干旱带来的迫害[11]。氨基酸是一类带有氨基(-NH2)或亚氨基(-NH)的有机酸的总称,是细胞的重要组成部分,在植物生命活动中担负着各种生理作用[12]。水分胁迫使植物中游离氨基酸增高,这些游离氨基酸的增加,对维持植物水势起到渗透调节作用,同时也是胁迫下植物贮存物质和能量的一种形式,以免造成过多的损害消耗并缓解分解产物引起的毒害[13]。由本次研究结果表明,每隔15d浇水一次的水分胁迫处理的植株叶绿素、可溶性糖、可溶性蛋白和游离氨基酸含量最高,每隔10d浇水一次和每隔15d浇水一次植株的淀粉都较高,且差异不显著,而每隔20d浇水一次时,上述生理生化指标含量均下降,说明每隔20d浇水一次时,已对兰花植株产生了毒害。本研究的结论与上述相关研究结论一致。
5 结论
对兰花“曙光”植株开花前和花期进行每间隔15d一次的浇水的水分胁迫处理,促进了叶绿素、可溶性糖、淀粉、可溶性蛋白和游离氨基酸的合成;每隔20d浇水一次时,上述生理生化指标含量均下降,说明随着水分胁迫强度的加剧,叶绿素、可溶性糖、淀粉、可溶性蛋白和游离氨基酸积累均在下降。因此,在栽培基质通透性较好的情况下,建议兰花‘曙光不超过15d浇一次水为宜。
参考文献
[1]王玉英,李枝林.兰花新品种‘曙光[J].园艺学报,2013,40(6):1217-1218.
[2]刘建福,李道高,蒋建国,等.水分胁迫对澳洲坚果生理生化指标的影响[J].云南热作科技,2001,24(4):1-4.
[3]王丹,孙存华.水分胁迫对草莓叶片生理特性的影响[J].山东农业科学,2013,45(2):72-74.
[4]王存纲,郭 丽.水分胁迫对大岩桐生理生化指标的影响[J].浙江农业科学,2013(1):35-37,43.
[5]汤伟权,韩曦,王佳巍,等.水分胁迫对大叶铁线莲生理生化指标的影响[J].防护林科技,2013,119(8):28-31.
[6]李光,龚宁,余霜.水分胁迫对金线兰地上茎组培苗生理生化的影响[J].广东农业科学,2013,19:38-40.
[7]王玉英,凌青,苏俊,等.栽培基质及配方施肥对虎雪兰“霞光”的生长影响试验[J].西部林业科学,2013,42(6):51-56.
[8]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:267-268.
[9]叶尚红.植物生理生化实验教程[M].昆明:云南科技出版社,2010.
[10]赵江涛,李晓峰,李航,等.可溶性糖在高等植物代谢调节中的生理作用[J].安徽农业科学,2006,24.
[11]康俊梅,杨青川,樊奋成.干旱对苜蓿叶片可溶性蛋白的影响[J].草地学报,2005,03.
[13]刘建兵,喻方圆,胡晓健.水分胁迫下植物体内小分子有机化合物积累研究综述[J].湖南林业科技,2010,1:80-84.
[14]Ingram J,Bartels D.The molecular basis of dehydration tolerance in plants [A].Russell L J.Annu Rev Plants Physiol and Plants Mel[C].California,USA:Management of Annual Reviews Inc,1996:377-403. (责编:张宏民)

