百合玻璃化试管苗的生理生化特性及其调控
鲍庆晗++赵一欣++明玥彤++杨博文
摘要:以百合品种Pollyanna、Eleganza和Renoir为试材,研究了玻璃化试管苗发生特征、影响因素及预防措施。结果表明:芽增殖期与壮苗期为百合试管苗发生的主要时期;玻璃化苗干物质、蛋白质和叶绿素的含量显著低于正常试管苗;玻璃化苗ZR含量偏低,而ABA含量与乙烯释放量显著高于正常试管苗。在诱芽、壮苗和生根阶段分别采用以下培养基:MS+0.5 mg/L 6-BA+0.5 mg/L NAA,MS+0.1 mg/L 6-BA+0.5 mg/L NAA,1/2MS+0.2 mg/L NAA,其中琼脂与蔗糖添加量分别为8.0、50 g/L,百合玻璃化苗比例可控制在5%以下。本研究结果为百合试管苗的高效生产提供了理论依据。
关键词:百合;试管苗;玻璃化;激素;生理生化指标;蔗糖
中图分类号: S682.2+65.04+3文献标志码: A
文章编号:1002-1302(2016)12-0104-03
收稿日期:2015-10-15
基金项目:国家自然科学基金(编号:31370683)。
作者简介:鲍庆晗(1982—),男,吉林四平人,硕士,助理研究员,主要从事植物学方面的研究。E-mail:315211139@qq.com。
百合(Lilium brownii)属百合科百合属多年生草本球根植物,具有较高的观赏价值,同时兼有食用和药用的功效,深受人们喜爱。传统上,百合可通过珠芽、小子球和鳞片等进行繁殖。由于组织培养技术具有节省时间、空间、无病虫害、快速高效等诸多优点,已经成为了百合繁殖的主要手段之一[1]。试管苗玻璃化是组织培养过程中常出现的一种导致繁殖效率下降的现象,表现为组培苗的组织呈半透明状,外观异常,更重要的是玻璃化苗生理功能不健全,多难以移栽成活[2]。百合组织培养过程中常出现试管苗玻璃化现象,导致试管苗生产效率明显降低[3]。本研究通过确定百合试管苗发生的时期、正常苗与玻璃化苗激素含量差异,在此基础上,研究了植物激素浓度与配比、琼脂与糖含量对玻璃化苗产生的影响,以期为百合试管苗的高效生产提供科学依据。
1材料与方法
1.1材料
以3个百合品种Pollyanna、Eleganza和Renoir的球茎为组织培养的材料,以上材料均购自浙江虹越花卉股份有限公司。
1.2方法
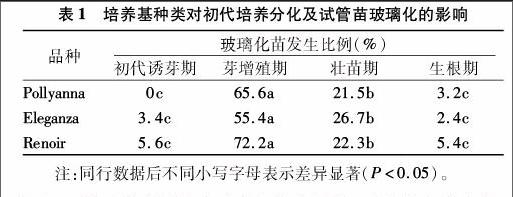
1.2.1培养基种类对初代培养分化及试管苗玻璃化的影响
将3个品种的球茎置4 ℃冰箱放置1个月左右以确保完成休眠。取其球茎,分离并挑选无损伤、无病虫危害的中部鳞片,洗净晾干。接种前,将鳞片置于70%乙醇中浸泡30 s、01%的HgCl2中浸泡10 min后,转无菌水浸泡3次以去除残余乙醇和HgCl2。无菌滤纸吸干材料表面水分,将材料切分为 1.0 cm×0.5 cm的小块,表面用解剖刀刻伤,接种入初代培养基中进行培养,待分化丛芽后,将生长正常的丛芽转入芽增殖培养基进行培养,选择生长正常的丛芽依次转入壮苗与生根培养基进行培养。前3种培养的培养基均为MS,生根培养基为1/2 MS。其中,初代诱芽期培养基和芽增殖期的培养基的激素配比为0.75 mg/L 6-BA+0.75 mg/L NAA,壮苗培养基的激素配比为0.1 mg/L 6-BA+0.2 mg/L NAA,生根期的培养基的激素配比为0.2 mg/L NAA,培养30 d左右统计试管苗玻璃化的比例。以上培养基pH值为5.8~6.0,琼脂 7.0 g/L,蔗糖20 g/L,組培瓶为240 mL透气覆膜组培瓶,在1.2 kg/cm2 压力下灭菌20 min。接种后置于25 ℃、光照度 1 500 lx、每天光照12 h的光照培养箱中进行培养。
1.2.2百合正常试管苗与玻璃化苗若干生理生化指标的比较
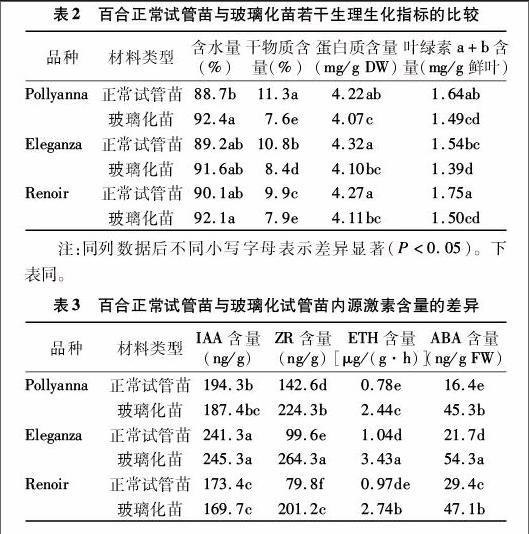
比较了百合正常试管苗与玻璃化苗的含水量、干物质含量、蛋白质含量和叶绿素含量。把称过鲜质量的组培苗装入纸袋中,放入烘箱内,100~105 ℃杀青10 min,80 ℃左右烘至恒质量,放入干燥器中冷却至室温,计算含水量与干物质含量。蛋白质含量的测定用考马斯亮蓝G-250染色法[4],叶绿素含量采用分光光度法测定[5]。
1.2.3植物内源激素含量测定
IAA、ZR和ABA的测定采用中国农业大学的植物酶联免疫试剂盒进行测定[6],具体操作见说明书,乙烯的测定采用气相色谱法[7]。
1.2.4激素浓度配比对试管苗生长、增殖及玻璃化的影响
以百合品种Pollyanna为材料。6-BA设置0.2、0.5、0.7、1.0 mg/L 共计4个浓度梯度,NAA设置0.5、1.0、2.0 mg/L共3个梯度,合计12个处理,基础培养基为MS,琼脂、蔗糖、光照度、pH值、组培瓶等条件如前所述。培养约30 d时统计试管苗高、单个外植体出芽数、玻璃化芽苗比例,有效增殖倍数采用以下公式进行计算:有效增殖倍数=单个外植体出芽数×(1-玻璃化芽苗百分比)。
1.2.5蔗糖与琼脂浓度对试管苗生长及玻璃化的影响
以百合品种Pollyanna为材料。琼脂设置7.0、8.0、9.0 g/L 3个浓度梯度,蔗糖设置30、40、50 g/L 3个浓度梯度,共计9个处理。芽苗为百合品种Pollyanna,芽高大于2cm,培养基为 MS+0.5 mg/L 6-BA+0.5 mg/L NAA,其他培养条件如前所述。
1.3统计分析
以上试验重复3次。玻璃化试管苗统计及生长指标调查研究中,每次重复5瓶以上,每瓶接种外植体5~8个,试验结果为5次重复的平均值。应用统计分析软件SAS 8.2的GLM过程进行数据的邓肯氏新复极差显著性分析,百分率数据经过反正弦转化后再进行运算。
2结果与分析
2.1百合组培过程不同阶段试管苗发生比例及其成活率
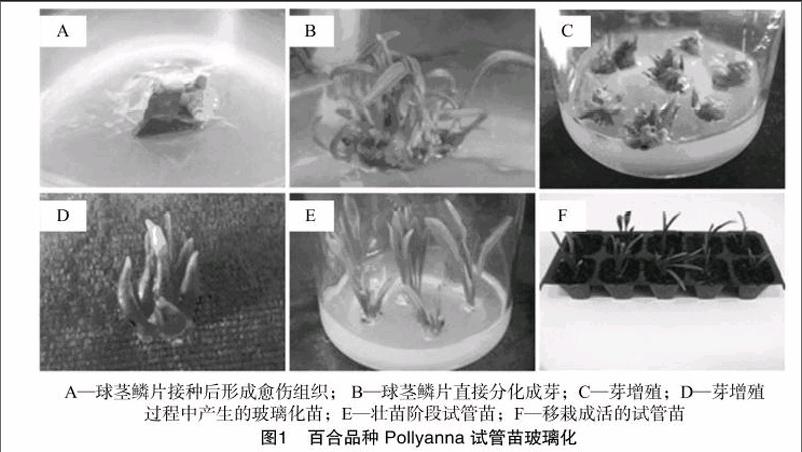
为确定百合试管苗玻璃化发生的时期,将百合的组织培养过程分为初代诱芽期、芽增殖期、壮苗期和生根期4个阶段。结果表明,对于Pollyanna等3个百合品种而言,初代培养过程中,约30%左右的鳞片形成愈伤组织(图1-A),约60%左右的外植体直接分化成芽(图1-B)。与正常芽苗相比(图1-C),玻璃化苗呈深绿色,叶片肥厚,含水量较高(图1-D)。诱芽期与生根期玻璃化苗发生比例均较低,且无显著差异(P>0.05),芽增殖期与壮苗期玻璃化苗发生比例显著高于上述2个时期(P<0.05)。其中,芽增殖期玻璃化苗发生比例显著高于壮苗期(P<0.05)(图1-E,表1)。可见,芽增殖期与壮苗期是百合试管苗玻璃化发生的主要时期,其中,芽增殖期的试管苗玻璃化又远高于壮苗期。
2.2百合正常试管苗与玻璃化苗若干生理生化指标的比较
比较了百合正常试管苗与玻璃化苗的含水量、干物质含量、蛋白质含量和叶绿素含量,结果如表2所示。3个百合品种的玻璃化苗含水量均高于正常试管苗,其中,百合品种 Pollyanna 的玻璃化苗含水量显著高于正常试管苗(P<0.05),百合品种Eleganza和Renoir玻璃化苗与正常试管苗相比无显著差异(P>0.05)。从干物质含量、蛋白质含量和叶绿素a+b含量来看,3个百合品种玻璃化苗的干物质含量、蛋白质含量和叶绿素a+b含量均显著低于正常试管苗(P<0.05)。
2.3正常与玻璃化试管苗内源激素含量的差异
比較了3个百合品种正常试管苗与玻璃化苗生长素(IAA)、玉米素核苷(ZR)、乙烯(ETH)和脱落酸(ABA)含量的差异,结果如表3所示。同一品种相比较,3个百合品种的玻璃化苗IAA含量与正常试管苗较为接近,差异均未达到显著水平(P>0.05)。3个百合品种玻璃化苗ZR含量显著高于正常试管苗(P<0.05),而乙烯释放量(ETH)及ABA含量均显著高于正常试管苗(P<0.05)。
2.4激素浓度配比对试管苗生长、增殖及玻璃化的影响
在芽增殖期,不同6-BA与NAA配比对试管苗生长、增殖及玻璃化均有不同程度的影响(表4)。相同6-BA浓度条件下,试管苗的高度随着NAA浓度的升高有一定程度的上升。从单个外植出芽数来看,随着6-BA浓度上升,单个外植体出芽数呈下降趋势。玻璃化芽苗比例与6-BA浓度关系十分密切,在6-BA浓度高于0.5 mg/L的条件下,玻璃化芽苗比例在34.7%~82.4%间波动。在6-BA浓度为 0.5、0.2 mg/L的条件下,玻璃化芽苗比例在7.9%~14.6% 间波动。可见,高浓度的6-BA是导致百合试管苗玻璃化的重要原因之一。从有效增殖倍数来看,在6-BA浓度为 0.5 mg/L、NAA浓度为0.5~1.0 mg/L时,百合的有效增殖倍数较高,而且,试管苗高度也保持较高水平,因此,这一浓度组合对于百合的芽增殖较为有利。
2.5芽增殖期蔗糖与琼脂浓度对试管苗生长及玻璃化的影响
在12个琼脂与蔗糖浓度组合处理中,单个外植体出芽数相比多数没有显著差异(P<0.05)。试管苗平均高度受琼脂与蔗糖浓度组合处理的影响,其中,7.0 g/L琼脂与50 g/L蔗糖的组合试管苗平均高度为最高。在8.0 g/L琼脂与50 g/L蔗糖的组合中,玻璃化苗比例最低,而有效增殖倍数最高。综上,8.0 g/L琼脂与50 g/L蔗糖的组合对于百合的有效增殖较为有利,其试管苗的高度也维持在较高水平。
2.6优化条件下试管苗生长、玻璃化苗比例及移栽
在以上研究结果的基础上,对优化的培养条件进行了整合,以验证对百合玻璃化苗发生及试管苗生长的影响。在百合的诱芽阶段采用MS+0.5 mg/L 6-BA+0.5 mg/L NAA,在壮苗阶段采用MS+0.1 mg/L 6-BA+0.5 mg/L NAA,在生根阶段采用1/2MS+0.2 mg/L NAA,以上培养基琼脂与蔗糖分别为8.0、50 g/L。结果(表6)表明,试验的3个百合品种均可以以相同的配方进行快繁,苗高、壮实,玻璃化苗比例均可控制在5%以下,移栽的成活率较高(图1-F),均可达到94%以上。
3讨论
试管苗玻璃化的发生与试管苗的生产效率密切相关。在本研究中,试管苗在不太适宜的培养基中玻璃化比例最高可达到82.4%,因此,研究百合试管苗玻璃化问题对于指导其组培生产有重要意义。已有的研究表明,与正常试管苗相比,玻璃化苗的形态解剖特点异常,蛋白质合成和光合作用能力低下[8-9]。本研究的结果表明,玻璃化试管苗干物质含量、蛋白质含量及叶绿素含量明显偏低,这与前人的报道相一致。在激素合成方面,有研究表明玻璃化苗内源激素发生明显变化[10-11],酸樱桃玻璃化试管苗叶片及茎尖中IAA、ABA和乙烯的含量极显著上升,茎叶极度玻璃化时CTK含量显著降低[10]。本研究结果表明,正常试管苗与玻璃化苗IAA合成能力差异似乎并不大,但玻璃化苗中的玉米素核苷ZR含量显著低于正常试管苗。另外,与逆境胁迫相关的激素乙烯含量与ABA含量明显上升。在组织培养过程中,6-BA可促进酸樱桃组培苗内源IAA和ZR的生物合成,降低ABA的质量分数[12-13],而培养基中的细胞分裂素(如6-BA)容易导致玻璃化[14-16]。在本研究中,6-BA与NAA的适当组合大幅降低玻璃化苗的比例,这可能与培养基中的6-BA促进百合内源ZR的合成、降低ABA含量相关。有研究表明,添加乙烯前体物质或乙烯生物合成的抑制剂并不影响玻璃化的发生[17],这可能意味着本研究中玻璃化试管苗产生的高浓度乙烯是环境胁迫的结果,而不是导致试管苗玻璃化的原因。植物培养基成分、碳源等因素也与试管苗的玻璃化相关[14,18],糖与琼脂浓度常与玻璃化苗呈负相关关系。丝石竹在含糖20 g/L的培养基中,玻璃化苗比例高达100%,在含糖20 g/L的培养基中玻璃化苗比例降低至70%[18],高浓度的蔗糖也有利于降低石竹玻璃化苗的比例[2]。在本研究中,玻璃化苗比例随含糖量与琼脂浓度的升高大致呈下降趋势(表5),但高浓度的糖与琼脂影响到了试管苗的长势,试管苗高度降低,总体而言,有效增殖倍数有一定程度的增加。通过激素组合、琼脂和蔗糖等条件的优化,本研究中的3个百合品种都能获得有效的增殖与生长,移栽成活率在94%以上,验证了百合试管苗玻璃化发生相关技术措施能有效改善其产量损失,这为其工厂化生产提供了科学依据。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1]张悦,张正海,李爱民,等. 优质观赏百合品种“索邦”愈伤组织培养研究[J]. 江苏农业科学,2015,43(8):49-51.
[2]程云清,刘剑锋,刘春明,等. 中国石竹离体快繁与试管苗玻璃化研究[J]. 广西植物,2012,32(4):531-535.
[3]周春华,尤超,陈凝华. 百合组织培养研究进展[J]. 北方园艺,2013,37(4):193-195.
[4]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:164-260.
[5]舒展,张晓素,陈娟,等. 叶绿素含量测定的简化[J]. 植物生理学通讯,2010,46(4):399-402.
[6][JP2]年悅,王楠,崔震海,等. 北方粳稻灌浆期水分胁迫条件下叶片内源激素变化的研究[J]. 中国农学通报,2012,28(21):33-37.
[7]程云清,赵桂兰,刘剑锋,等. 乙烯抑制剂AVG和促进剂ACC对大豆幼苗叶片光合特征的影响[J]. 浙江大学学报:农业与生命科学版,2010,36(4):419-426.
[8]蔡祖国,徐小彪,周会萍. 植物组织培养中的玻璃化现象及其预防[J]. 生物技术通讯,2005,16(3):353-355.
[9]吕敏,夏秀英,徐品三,等. 蓝莓玻璃化试管苗的显微结构及生理生化特性变化[J]. 植物生理学报,2014,50(4):453-460.
[10]常有宏,张玉娇,李晓刚,等. ‘黄冠梨正常试管苗与玻璃化苗生理生化及超微结构的比较研究[J]. 园艺学报,2011,38(2):225-232.
[11]牛自勉,王贤萍,戴桂林. 苹果砧木玻璃化过程中内源激素的含量变化[J]. 华北农学报,1995,10(3):15-19.
[12]高红兵,唐晓杰,孟庆繁. 高浓度 6-BA诱导酸樱桃苗的玻璃化苗内源激素含量变化[J]. 林业科学研究,2006,19(4):488-490.
[13]高红兵,王朋飞,刁绍启,等. 6-BA对酸樱桃组培苗4种内源激素质量分数动态变化的影响[J]. 东北林业大学学报,2007,35(7):46-48.
[14]王爱芝,沈海龙,张鹏,等. 花楸组织培养中玻璃化现象的发生与防治[J]. 东北林业大学学报,2009,37(10):18-22.
[15]牛自勉,王贤萍,许月明. 苹果砧木茎尖培养玻璃化与内源激素的关系[J]. 园艺学报,1994,21(4):396-399.
[16]李瑶,王利华,时鸣明,等. 影响香石竹试管苗玻璃化的因素[J]. 植物生理学通报,1997,33(4):256-258.
[17]Kevers C,Gaspar T. Vitrification of carnation in vitro:changes in [JP3]ethylene production,ACC level and capacity to convert ACC to ethylene[J]. Plant Cell Tissue and Organ Culture,1985,4(3):215-223.
[18]张燕玲,姚军,王润珍,等. 满天星组织培养中克服玻璃化现象的初探[J]. 广西植物研究,1997,17(3):246-248.

