花生金属蛋白酶家族基因FtsH的鉴定、分类和盐胁迫表达分析
郑春花++孔祥远++隋炯明++束晨++赵春梅

摘要:FtsH是一种ATP和Zn2+依赖型金属蛋白酶,在植物抗逆胁迫中发挥了重要作用。为分析花生中FtsH家族成员情况,构建花生叶片转录组数据文库,筛选出19个FtsH家族基因,位于花生A组野生种的8条染色体上,与拟南芥、水稻的FtsH基因进行同源序列比对后发现,多数FtsH基因没有聚到已报道的亚类。利用花生耐盐突变体(S2)和对照(S4)构建盐胁迫处理前后各时间段的表达谱文库,进行FtsH基因盐胁迫表达分析,结果表明,9个FtsH基因受盐胁迫诱导表达,绝大多数FtsH基因在耐盐突变体和对照中表现出不同的表达模式。该研究为花生金属蛋白酶基因的功能研究与耐盐分子育种提供了基础。
关键词:花生;FtsH基因;基因表达谱;耐盐突变体;盐胁迫
中图分类号: S565.201文献标志码: A
文章编号:1002-1302(2016)12-0074-03
收稿日期:2016-08-30
基金项目:国家自然科学基金(编号:31571705、31301356、31471542);山东省科技发展计划(编号:2014GNC110002)。
作者简介:郑春花(1979—),女,山西忻州人,硕士,图书馆员,主要从事生物信息学分析。E-mail:zchsjm@163.com。
通信作者:赵春梅,博士,副教授,主要从事作物分子育种研究。E-mail:meiwei2002@163.com。
FtsH属于AAA蛋白酶家族,是一种ATP和Zn2+依赖型蛋白,在生物体内广泛分布[1]。FtsH负责细菌原生质膜、线粒体膜、叶绿体膜上未装配蛋白的降解,通过降解非复合体形式的自由亚基,可以避免有害物质的大量积累[2-3]。在高等植物中,FtsH蛋白参与D1蛋白光氧化损伤产物的降解,现己证实FtsH具有降解快速周转的蛋白的功能,FtsH是植物抵抗光抑制过程中PSⅡ复合物修复的关键成分之一[4]。FtsH蛋白除了作为蛋白酶发挥功能外,还作为分子伴侣参与蛋白的装配和折叠[5-7]。
已有研究表明,拟南芥的12个FtsH基因和水稻的FtsH基因可以分为8个亚族,每个亚族的成员蛋白序列高度保守,种内同源物相似性大于80%,且种间同源物的相似性也大于70%[8]。FtsH不仅参与生物体内正常的代谢调节过程,而且与多种逆境胁迫响应密切相关,有些成员在植物抵抗热激和高渗、盐害、冷胁迫和病原菌等胁迫中发挥着重要作用[9-11]。
笔者前期以花生胚小叶为外植体,通过平阳霉素离体诱变和羟脯氨酸定向筛选,获得了一批羟脯氨酸耐性苗及其后代[12],其中1个突变体(S2)在0.7%盐溶液中发芽率超过50%,且具有较高的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性,而对照花育20(S4)在相同浓度的盐溶液中发芽率只有6.7%。
为从整个转录组水平了解花生FtsH家族基因的情况,笔者用上述材料构建花生叶片转录组文库,利用生物信息学研究手段,鉴定花生FtsH家族基因,进行FtsH基因的染色体定位和分类。然后构建耐盐突变体S2和对照S4在盐胁迫处理前后的表达谱,分析FtsH家族各成员在盐胁迫处理前后表达量的变化,为全面了解FtsH家族成员在花生中的功能以及耐盐分子育种奠定了基础。
1材料与方法
1.1材料
本研究所用材料为平阳霉素离体诱变和羟脯氨酸定向筛选后稳定遗传的耐盐突变体(S2)和对照花育20(S4)。
1.2转录组数据库构建
用250 mmol/L NaCl处理耐盐突变体S2和对照S4,在0、6、12、24、48 h取叶片,每个样品包含2个生物学重复。混合后构建转录组文库,送交北京诺和致源公司进行双向测序,组装处理后获得非冗余Unigene序列,在NCBIA数据库注册(注册号SRR3114511)。用NR、NT、SwissProt、PFAM、KOG、GO、KEGG数据库进行基因功能注释。
1.3盐胁迫处理前后表达谱数据库构建
由北京诺和致源公司对盐胁迫处理前后20个样品进行数字化表达谱测序,构建花生叶片盐胁迫处理前后的表达谱数据库(NCBI注册号SRR3210665、SRR3210666)。
1.4基因家族成员鉴定、基因结构分析和染色体定位
根据NR、NT、SwissProt、PFAM、KOG、GO、KEGG數据库的基因功能预测,搜索FtsH基因。利用生物信息学软件分析蛋白结构域、分子量、理论等电点和可能的亚细胞定位。从花生全基因组数据(http://www.peanutbase.org)下载A组野生种基因组序列,进行基因序列比对,取相似度最高的序列作为目标基因,并根据数据库的预测结果和比对结果进行基因结构分析。根据与数据库比对后的结果,标示基因在染色体上的位置,得到各个基因在染色体上的分布情况。
1.5系统进化树的构建
通过Clustal X软件对拟南芥、水稻FtsH蛋白进行序列比对分析,采用邻接法生成FtsH基因的系统进化树。
1.6盐胁迫响应分析
将S2或S4样品中,某一基因在胁迫处理前后0、6、12、24、48 h的任何2个时间段间的表达量进行比较,如果调整后的P<0.05,则认为该基因对盐胁迫有响应。
2结果与分析
2.1花生FtsH家族基因的鉴定及它们在染色体上的分布
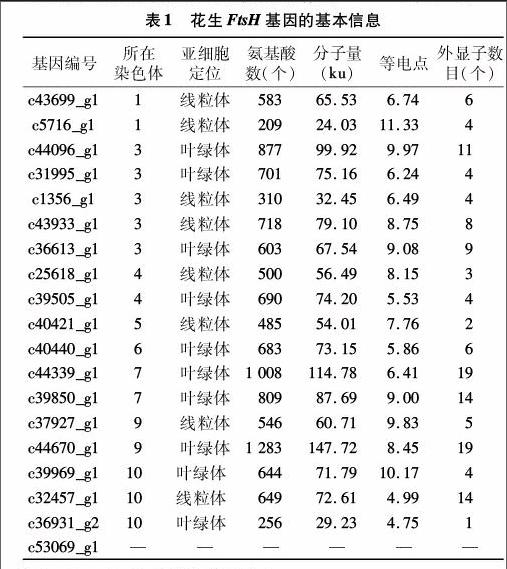
根据上述7大数据库的基因功能预测结果,笔者从花生叶片转录组数据库中筛选出25个候选FtsH基因。将其与公布的花生A组野生种基因组序列进行比对,其中6个基因(编号分别为c40440_g2、c35114_g1、c38335_g1、c44670_g2、c41532_g1和c19813_g1)因与其他基因比对到同一位置被剔除,最终得到19个花生FtsH基因。根据与花生A组野生种基因组的比对结果,确定了18个FtsH基因在A染色体组的分布情况,这些基因分布在8条染色体上,其中第2、8号染色体上不含有FtsH基因,第3、4、9、10号染色体分布的成员数量最多,有3~5个,其他各染色体含有1~2个FTSH基因,[JP2]c53069_g1在A染色体组没有比对到相应序列(表1)。花生FtsH蛋白最长有 1 283 个氨基酸残基,最短的有209个氨基酸残基,其等电点范围为4.91~10.09,除c53069_g1无法进行亚细胞定位外,其余18个蛋白中10个定位于叶绿体,8个定位于线粒体。基因结构分析显示,外显子数为1~19个(表1)。
2.2花生FtsH基因的聚类分类
模式植物拟南芥、水稻分别有12、9个FtsH基因,可分为8个亚家族[8]。根据FtsH蛋白家族成员长度差异、含不同特征的结构域等特点,将花生19个FtsH蛋白与拟南芥和水稻基因组中全部FtsH蛋白进行多重序列比对和系统进化分析。聚类结果显示,4、5、7亚家族只有拟南芥和水稻的FtsH基因,暂时没有找到花生的FtsH基因;1、2、3、6、8亚家族分别包含1、2、1、1、1个FtsH基因,其他13个FtsH基因没有聚到这8个亚家族,它们可能属于一些新的亚族(图1)。
[FK(W27][TPZCH1.tif]
2.3花生FtsH家族基因的盐胁迫响应分析
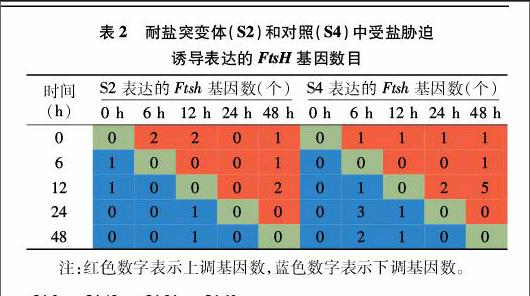
笔者利用盐胁迫处理前后S2、S4的20个数字表达文库谱,在胁迫处理前后对19个FtsH基因的任意2个时间段的表达量进行比较,根据调整后的P值,确定其是否受盐胁迫诱导表达,结果见表2和图2。可以看出,在S2中,与胁迫处理前相比,胁迫处理6、12 h后,差异表达的基因各有3个;胁迫处理48 h与12 h相比,也有3个差异表达的基因。而在S4中,胁迫处理48 h与12 h相比,差异表达的基因数最多,有5个上调,1个下调。
进一步分析发现,5个基因(c25618_g1、c40440_g1、c53069_g1、c37927_g1、c40421_g1)在S2和S4中均受胁迫诱导表达;2个基因(c32457_g1、c36613_g1)只在S2中受胁迫诱导表达;2个基因(c44096_g1、c31995_g1)只在S4中受胁迫诱导表达(表2、图2)。S2中,c53069_g1和c44096_g1表达模式相同,均为上调—下调—上调—上调,c32457_g1和c36613_g1表达模式相同,均为上调—上调—下调—下调;S4中,c25618_g1和c40440_g1表达模式相同,均为下调—下调—上调—上调,c44096_g1和c40421_g1表达模式相同,均为上调—下调—下调—下调。只有c53069_g1和c37927_g1这2个基因在S2和S4中表达模式完全一致,其他基因表达模式都有差别,特别是c25618_g1、c32457_g1,c44096_g1和c36613_g1在S2和S4中表达模式差别非常大。
各基因百万外显子的碱基片段(FPKM)值差异很大,S2中FPKM值的变化范围为0.68~537.85,而S4中FPKM值的变化范围为2.64~632.78。与胁迫处理前相比,胁迫处理后,c53069_g1在S2中的表达量明显上调,log2(变化表达量)最高达到3.29,而在S4中的多个时间段的比值都超过2.70,最高达到4.99;胁迫处理后c25618_g1在S4中的log2(变化表达量)最高达到 4.15;而c37927_g1在胁迫处理后的某些时间段出现了显著下调,在S2、S4中的log2(变化表达量)最低分别为-3.08、-2.03。由此可见,不同的FtsH基因在胁迫处理后的表达模式差异很大。
3结论与讨论
生物体内的FtsH种类繁多,拟南芥中有12种FtsH蛋白酶,其中AtFtsH3、AtFtsH4和AtFtsH10定位于线粒体,其余9种定位于叶绿体[8],本研究筛选到的FtsH蛋白酶均定位于叶绿体和线粒体。FtsH参与多种调控途径,有些FtsH基因与某些生物和非生物胁迫响应密切相关。烟草叶绿体FtsH蛋白同系物DS9与植株抗病性有关,其表达量降低后叶片对病毒侵染产生超敏反应[13]。拟南芥AtFtsH1参与D1蛋白光氧化损伤产物的降解[4],AtFtsH2和AtFtsH5参与光保护和类囊体发育过程,2个基因突变都会引起叶片花斑和对光抑制敏感性提高[14-15]。定位于叶绿体中的一个苜蓿FtsH基因只受低温和和光照调控,而不受脱落酸、NaCl或脱水胁迫诱导[9]。来源于番茄叶片组织的LeFtsH6基因也定位于叶绿体,该基因只受热激胁迫诱导表达,而不受冷害、盐、干旱或光胁迫诱导,其启动子中的顺式调控元件热激响应元件(HSE)可以与热激因子互作[10]。在冰叶日中花中筛選到的FtsH基因可受盐胁迫表达[11]。由此可见,高等植物中FtsH家族成员功能发生了分化。
为了分析花生中FtsH基因的情况,笔者利用构建的花生叶片转录组数据库,通过生物信息学手段,鉴定出19个FtsH基因,位于花生A组野生种的8条染色体上。聚类分析表明,只有1、2、3、6、8这5个亚家族含有花生FtsH基因,花生的绝大多数FtsH基因可能属于一些新的亚家族。拟南芥中多个FtsH基因成对存在,有些成对基因之间表达模式相似且功能可以互补,如AtFtsH3和AtFtsH10,AtFtsH2和AtFtsH8,AtFtsH1和AtFtsH5等[8],而在笔者的试验中这种现象并不多见,可能是由于笔者获得的FtsH基因只是来源于叶片组织,而未包括花生全部的FtsH基因。利用花生耐盐突变体(S2)和对照(S4)构建盐胁迫处理前后各时间段的表达谱数据,进行基因盐胁迫表达分析,结果表明,共9个基因在S2和(或)S4中受盐胁迫诱导表达,绝大多数FtsH基因在耐盐突变体和对照中的表达模式有较大差异,这些FtsH基因可能在花生抵御盐胁迫中发挥着重要作用。该结果为进一步研究其功能以及利用它们来改良花生的耐盐性提供了重要依据。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]Schumann W. FtsH-a single-chain charonin[J]. FEMS Microbiol Rev,1999,23(1):1-11.
[2]Ostersetzer O,Adam Z. Light-stimulated degradation of an unassembled Rieske FeS protein by a thylakoid-bound protease:the possible role of the FtsH protease[J]. Plant Cell,1997,9(6):957-965.
[3]Akiyama Y,Kihara A,Ito K. Subunit ɑ of proton ATPase F0 sector is a substrate of the FtsH protease in Escherichia coli[J]. FEBS Lett,1996,399:26-28.
[4]Lindahl M,Spetea C,Hundal T,et al. The thylakoid FtsH protease plays a role in the light-induced turnover of the photosystem Ⅱ D1
[HT8.]
[KG1*2/3][ZK(#]protein[J]. Plant Cell,2000(12):419-431.
[5]Akiyama Y,Shirai Y,Ito K. Involvement of FtsH in protein assembly into and through the membrane. Ⅱ. Dominant mutations affecting FtsH functions[J]. J Biol Chem,1994,269(7):5225-5229.
[6]Jayasekera M M,Foltin S K,Olson E R,et al. Escherichia coli requires the protease activity of FtsH for growth[J]. Arch Biochem Biophys,2000,380:103-107.
[7]Makino S,Makinoa T,Abe K,et al. Second transmembrane segment of FtsH plays a role in its proteolytic activity and homo-oligomerization[J]. FEBS Letters,1999,460(3):554-558.
[8]張杰道,孙爱清. 拟南芥和水稻金属蛋白酶FtsH基因家族的基因组比较分析[J]. 生物工程学报,2009,25(9):1402-1408.
[9]Ivashuta S,Imai R,Uchiyama K,et al. Changes in chloroplast FtsH-like gene during cold acclimation in alfalfa (Medicago sativa)[J]. J Plant Physiol,2002,159:85-90.
[10][ZK(#]Sun A Q,Yi S Y,Yang J Y,et al. Identification and characterization of a heat-inducible FtsH gene from tomato (Lycopersicon esculentum Mill.)[J]. Plant Sci,2006,170:551-562.
[11]Kore-eda S,Cushman M A,Akselrod I,et al. Transcript profiling of salinity stress responses by large-scale expressed sequence tag analysis in Mesembryanthemum crystallinum[J]. Gene,2004,341:83-92.
[12]Sui J M,Wang Y,Wang P,et al. Generation of peanut drought tolerant plants by pingyangmycin-mediated in vitro mutagenesis and hydroxyproline-resistance screening[J]. PLoS One,2015,10(3):e0119240.
[13]Seo S,Okamoto M,Iwai T,et al. Reduced levels of chloroplast FtsH protein in tobacco mosaic virus-infected tobacco leaves accelerate the hypersensitive reaction[J]. Plant Cell,2000,12:917-932.
[14]Chen M,Choi Y,Voytas D F,et al. Mutations in the Arabidopsis VAR2 locus cause leaf variegation due to the loss of a chloroplast FtsH protease[J]. Plant J,2000,22:303-313.
[15]Sakamoto W,Tamura T,Hanba-Tomita Y,et al. The VAR1 locus of Arabidopsis encodes a chloroplastic FtsH and is responsible for leaf variegation in the mutant alleles[J]. Genes Cells,2002(7):769-780.

