水稻粒形基因GS3的功能标记开发与鉴定
裔传灯++李玮++王德荣++蒋伟++王颖++周勇++梁国华++顾铭洪


摘要:籽粒的大小和形状是影响水稻产量和稻米品质的主要性状。在基因GS3序列分析的基础上,对该基因第2外显子A/C和第5外显子13 bp Indel的2个变异位点分别开发功能标记,并将其用于294份水稻微核心种质和2007—2013年江苏省审定的65份粳稻品种的基因型鉴定。研究结果表明,第2外显子的A/C变异在籼粳亚种中有着相似的分布频率,并且都对粒长、粒厚和长宽比有极显著的影响。相对于基因型C而言,基因型A在籼粳亚种中都有更长的粒长、更薄的粒厚和更大的长宽比。但是第5外显子的13 bp 缺失变异只在粳稻中极低频率(074%)出现,属于稀有变异类型,比13 bp插入变异有着更短的粒长和更小的长宽比。这些研究结果为水稻产量和品质育种中充分利用基因GS3的优异等位基因奠定了基础。
关键词:水稻;粒形;基因GS3;功能标记;变异
中图分类号: S511.032文献标志码: A
文章编号:1002-1302(2016)12-0064-04
收稿日期:2016-04-06
基金项目:国家自然科学基金(编号:31571624、31071382);国家重点基础研究发展计划(编号:2010CB125904、2013CBA01405);江苏省高校自然科学研究重大项目(编号:15KJA210004);扬州大学大学生学术科技创新基金(编号:x2015616);江苏高校优势学科建设工程项目。
通信作者简介:裔传灯(1973—),男,江苏盐城人,博士,副教授,主要从事水稻遗传育种研究。Tel:(0514)87937619;E-mail:cdyi@yzu.edu.cn。
由于人口数量持续增长、耕地面积日益减少、自然灾害频发和水资源不足等原因,水稻育种研究者不断致力于提高水稻产量水平,确保国家的粮食安全。同时随着生活水平的不断提高,稻米消费者对稻米品质也提出了更高的要求。水稻的产量和稻米品质都是受多因素控制的复杂性状[1-2],其中粒形是影响水稻产量和稻米品质的重要因素之一[3]。在目前已经克隆的水稻基因中,通过调节粒形提高水稻产量的基因有GS3[4]、qPE9-1[5]、GW2[6]、 qGL3/GL3.1[7- 8]、qSW5/GW5[9-10]、GS5[11]、GS6[12]、GW7[1]、GW8[3]、SLG7[13]和TGW6[14];通过调节粒形改善稻米品质的基因有GW7[1]和GW8[3]。因此粒形性状调控机理的研究对水稻的产量育种和品质育种有着重要的参考价值。
GS3是控制水稻粒形的重要基因。Fan等研究发现基因GS3是控制水稻粒长和粒质量的负调控因子,以短粒水稻品种川7基因GS3的基因组序列DQ355996为参照,来自长粒水稻品种明恢63的第2外显子1 670 bp处的A碱基变异是无义突变,导致目标蛋白C端截短了178个氨基酸[4]。结合180个水稻品种的关联分析,Fan等进一步证实在籼粳亚种中基因型A比C都有更大的平均粒长[15]。除此变异外,Wang等还发现第4内含子的(AT)n变异和第5外显子的(TCC)n变异也与水稻的粒长有关[16]。目前该基因还有哪些变异位点以及它们对水稻粒形性状效应还不清楚。
为了加快基因GS3有利等位变异在水稻育种工作中的应用,本研究在序列比对的基础上,对第2外显子已知的功能变异和第5外显子未知功能的错义突变开发了相应的功能标记,结合水稻微核心种质和近年来江苏省审定粳稻品种的基因型检测,分析了这些变异位点对水稻粒形性状的影响,为我国尤其是江苏省的水稻产量和品质育种提供理论依据和快捷的选择手段。
1材料与方法
1.1供试材料
本研究的供试水稻材料包括籼稻品种明恢63、粳稻品种日本晴和苏粳2号、从中国农业大学引进的294份水稻微核心种质和从江苏省农业科学研究院引进的65份江苏省在2007—2013年期间审定的粳稻品种[17]。水稻微核心种质包含96份国外栽培稻品种和198份中国栽培稻品种[18],具有丰富的遗传多样性。供试材料来自国内外不同稻作区的水稻品种,它们的感光性存在较大的差异。为了确保能够正常抽穗,所有供试水稻品种2014年11月于海南省陵水县播种和育苗,2015年1月移栽大田,田间管理同于常规水稻品种。待水稻籽粒完全成熟后收种,晒干后进行水稻籽粒相关性状的测量。
1.2水稻成熟种子粒形相关性状数据的测定
参照《水稻种质资源描述规范和数据标准》的方法,水稻种子收获并风干后,挑选饱满成熟种子使用游标卡尺(精确到0.01 mm)测量粒长、粒宽和粒厚,5次重复,计算平均值。千粒质量使用电子天平测定1 000粒成熟烘干种子的质量,3次重复,计算平均值。
1.3基因GS3序列变异的分析和功能标记的设计
根据水稻粒形基因GS3的研究结果,从Rice genome annotation project网站(http://rice.plantbiology.msu.edu/)下载GS3基因的基因组DNA序列DQ355996。以该序列为种子序列,在NCBI网站核酸序列数据库中找到高度同源的3个基因组DNA序列(来自籼稻品种9311的基因GS3序列Ctg009226、來自粳稻品种日本睛的基因GS3序列AB488612和来自粳稻品系H343的基因GS3序列AB743895[19])和1个来自广陆矮4号的cDNA序列(CT835094)。借助BioEdit软件对上述序列进行比对分析。
本研究利用Primer Premier 5.0 软件,对基因GS3的第2外显子A/C序列点突变和第5外显子的13 bp Indel的序列变异分别设计了CAPs标记GS3-1和GS3-2。引物的合成和序列的测定在生工生物工程(上海)股份有限公司完成。
1.4DNA提取
收集供试材料分蘖盛期新鲜幼嫩的叶片,采用CTAB法[20]提取水稻基因组DNA。
1.5PCR扩增、酶切和电泳
[JP2]PCR反应体系含50 ng/ μL基因组DNA 2.0 μL,2 μmol/L引物F和R各2.5 μL,10×缓冲液2.0 μL,25 mmol/L MgCl2 2.0 μL,2.5 mmol/L dNTP 1.6 μL,5 U/μL Taq DNA聚合酶(TaKaRa Code:R001C) 0.2 μL,灭菌双蒸馏水补足至20 μL。PCR反应在Eppendorf Master cycler proS PCR仪上进行,反应条件为94 ℃预变性5 min;94 ℃ 30 s,55~60 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃再延伸10 min。反应产物在3.0%的琼脂糖上分离电泳。
利用PCR引物扩增基因GS3的目标片段,进一步用于酶切反应。酶切反应体系为10 μL,分别包含PCR反应产物 5 μL,10×buffer 1 μL,10 U/μL酶0.25 μL,ddH2O 3.75 μL。混勻后置于37 ℃恒温水浴锅酶切3~4 h,酶切产物在3.0%琼脂糖上电泳,EB染色,经紫外凝胶成相系统成像。
1.6数据分析
本研究中所有数据的分析和处理利用Excel和SPSS软件进行。
2结果与分析
2.1基因序列分析和分子标记设计
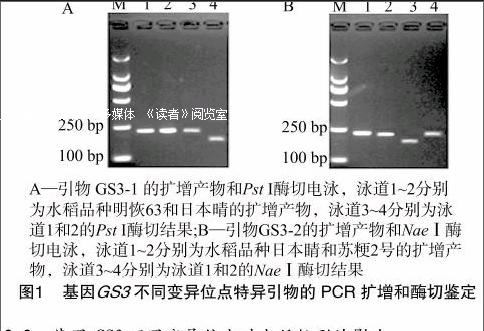
序列比对分析结果表明,基因GS3包含5个外显子和4个内含子,编码区有59处序列变异,其中57个变异发生在内含子区。除了Fan等已报道位于第2外显子区的A/C变异与该基因功能密切相关外,笔者发现该基因的第5外显子还有1个13 bp的Indel变异位点[4]。以基因GS3的编码序列DQ355996为参照,本研究对基因GS3第2外显子第 1 670 bp 处的A/C错义突变和第5外显子第5 354 bp处的13 bp Indel变异分别开发了CAPs标记GS3-1和GS3-2(表1)。
对于基因GS3第2外显子第1 670 bp处的A/C单碱基变异,笔者利用分子标记GS3-1能够在水稻品种中扩增出长度为216 bp的PCR产物(如图1-A的泳道1和2),经过限制性内切酶PstⅠ酶切后,能够被切成160 bp条带的水稻品种日本睛基因型为C(如图1-A的泳道4);PCR产物仍为216 bp的水稻品种明恢63基因型为A(如图1-A的泳道3)。
对于基因GS3第5外显子第5 354 bp处的13 bp Indel变异,利用标记GS3-2能够在水稻品种中扩增出长度为 224 bp 或211 bp的2种类型PCR产物(如图1-B的泳道1和2)。由于这2种PCR产物片段差异较小,无法用普通琼脂糖电泳加以区别;但是通过限制性内切酶NaeⅠ酶切处理后,224 bp 的PCR产物能够被切成176 bp条带的水稻品种日本睛基因型为13 bp的插入型(如图1-B的泳道3);PCR产物仍为211 bp的水稻品种苏粳2号基因型为13 bp的缺失型(如图1-B的泳道4)。
[FK(W12][TPYCD1.tif]
2.2基因GS3不同变异位点对水稻粒形的影响
为了探明基因GS3第2和第5外显子的2个序列变异位点对水稻籽粒相关性状的影响,笔者利用上述发展的分子标记[CM(25]GS3-1和GS3-2分别对294份水稻微核心种质的基因[CM)]
型进行了测定,并对每个位点的不同变异类型进行了t测验,结果列于表2。
从表2中可以看出,在基因GS3第2外显子的A/C序列变异中,不论籼稻还是粳稻,相对于基因型C而言,基因型A对增加粒长、减小粒厚、提高长宽比都有着极显著的影响。在籼稻群体中,笔者还发现基因型A有极显著减小粒宽的效应。对基因GS3第5外显子13 bp的Indel序列进行变异,在粳稻群体中,笔者发现具有13 bp插入的基因型对增加粒长和提高长宽比有着极显著的影响,但在籼稻群体中没有发现13 bp缺失的基因型。
从基因型分布频率来看,在基因GS3第2外显子的A/C变异中,基因型A的频率在籼稻品种中为27.85%,在粳稻品种中为23.53%,表明这种长粒形的基因型在籼稻和粳稻中都已经被育种研究者加以应用。但是对于基因GS3第5外显子的13 bp Indel变异而言,在136个粳稻品种中,笔者发现1个品种具有13 bp缺失的基因型,其分布频率为074%,而在158个籼稻品种中没有发现该基因型,表明13 bp缺失的基因型为稀有基因型。
另外笔者发现基因GS3第2和第5外显子的2个变异位点对水稻千粒质量的影响都没有达到显著水平。
2.3近年来江苏省育成品种中基因GS3的基因型分析
为了更好地指导育种研究者在水稻育种中对籽粒相关性状的选择,本研究对2007—2013年江苏省审定的65个粳稻品种基因GS3的2个目标变异位点进行了基因型测定,结果列于表3。在基因GS3第5外显子的13 bp Indel变异中,65个粳稻品种都是基因型为13 bp插入类型。在基因GS3第2外显子的A/C变异中,近年来江苏省审定的粳稻品种内,4个水稻品种的基因型为A;其余61个水稻品种的基因型为C,t测验结果表明基因型A有极显著增加粒长和提高长宽比的效应,这表明江苏省水稻育种研究者已经将长粒基因型应用到当前的粳稻育种实践中。
[FK(W6][HT6H][JZ]表3近年来江苏省审定水稻品种基因[WTHX][STHX]GS3[WTHZ]不同基因型的籽粒粒形性状[HTSS]
[HJ*5][BG(!][BHDFG3,WK5。2,WK10。5W]基因型样本数粒长(mm)粒宽(mm)粒厚(mm)长宽比千粒质量(g)
[BHDG1*2,WK5,WK5,WK10。5DWW]A47.99±0.19*[KG-*3]*3.34±0.082.33±0.062.41±0.12*[KG-*3]*28.74±1.46
[BHDW]C617.36±0.043.38±0.022.38±0.012.18±0.0227.34±0.23[BG)F]
注:“*[KG-*3]*”表示差異极显著(P<0.01);表中籽粒相关性状的数据为平均数±标准误。
3讨论与结论
籽粒是水稻光合产物贮存的主要目标器官。调节籽粒的大小和形状(即粒形),增大光合产物的库容量,对于提高水稻产量(尤其是产量的构成因子千粒质量)有着重要的作用。Mao等研究发现,以基因型为gs3的水稻品种明恢63为受体亲本,互补和过表达试验都能使粒长变短,粒质量下降;而以基因型为GS3的水稻品种川7为受体亲本,RNA干扰试验使粒长变长,粒质量增加[21]。但是在本研究中笔者利用水稻品种的自然群体(水稻微核心种质)分析了基因GS3第2和第5外显子的2个功能变异位点对水稻粒形的效应,结果发现第2外显子的A/C变异对水稻的粒长、粒厚和长宽比有着极显著的影响,第5外显子的13 bp Indel变异对粒长和长宽比有极显著的影响,但是这2个变异位点对千粒质量的影响没有达到显著水平,这可能是由于水稻的千粒质量与粒形有着不同的遗传控制系统,在遗传背景复杂的水稻微核心种质中,无法准确检测到基因GS3对水稻千粒质量的效应。
随着水稻分子生物学的进展,虽然许多与水稻产量相关的重要功能粒形基因已被克隆[1,3-4,7-14],但是这些基因还很少在水稻育种工作中得以利用,其原因主要有这些基因缺乏开发成本低廉且简便实用的基因功能标记、这些基因等位变异类型未知、各等位变异类型的效应如何不清楚等等。利用关联分析和转基因的方法,Fan等证实了基因GS3第2外显子的A/C变异对水稻粒长和粒质量有着重要的影响,并开发了相应的功能标记SF28[15,21]。本研究开发的CAPs标记 GS3-1 也是基于该A/C变异的另一个功能标记,酶切前后的条带大小差异更大,易于鉴别。另外笔者还对基因GS3第5外显子的稀有变异(13 bp Indel变异)开发了功能标记 GS3-2。利用标记GS3-2和限制性内切酶NaeⅠ配合使用,将原来差异较小的224 bp和211 bp DNA片段,分别转变成易于鉴别的176 bp和211 bp片段,可以直接使用普通琼脂糖水平电泳加以分离和识别,为构建该变异位点的水稻近等基因系和水稻育种中的分子标记辅助选择提供了准确快捷的选择方法。
致谢:感谢中国农业大学李自超教授和张洪亮博士提供的水稻微核心种质;感谢江苏省农业科学院王军博士提供的2007—2013年江苏省审定的粳稻品种,这些水稻品种为本研究中分子标记的筛选和基因型的鉴定提供了便利。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]Wang S K,Li S,Liu Q,et al. The OsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality[J]. Nature Genetics,2015,47(8):949-954.
[2]Xing Y,Zhang Q. Genetic and molecular bases of rice yield[J]. Annual Review of Plant Biology,2010,61:421-442.
[3]Wang S K,Wu K,Yuan Q B,et al. Control of grain size,shape and quality by OsSPL16 in rice[J]. Nature Genetics,2012,44(8):950-954.
[4]Fan C C,Xing Y Z,Mao H L,et al. GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J]. Theoretical and Applied Genetics,2006,112(6):1164-1171.
[5]Zhou Y,Zhu J Y,Li Z Y,et al. Deletion in a quantitative trait gene qPE9-1 associated with panicle erectness improves plant architecture during rice domestication[J]. Genetics,2009,183(1):315-324.
[6]Song X J,Huang W,Shi M,et al. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J]. Nature Genetics,2007,39(5):623-630.
[7]Zhang X J,Wang J F,Huang J,et al. Rare allele of OsPPKL1 associated with grain length causes extra-large grain and a significant yield increase in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(52):21534-21539.
[8]Qi P,Lin Y S,Song X J,et al. The novel quantitative trait locus GL3.1 controls rice grain size and yield by regulating Cyclin-T1;3[J]. Cell Research,2012,22(12):1666-1680.
[9]Shomura A,Izawa T,Ebana K,et al. Deletion in a gene associated with grain size increased yields during rice domestication[J]. Nature Genetics,2008,40(8):1023-1028.
[10][ZK(#]Weng J F,Gu S H,Wan X Y,et al. Isolation and initial characterization of GW5,a major QTL associated with rice grain width and weight[J]. Cell Research,2008,18(12):1199-1209.
[11]Li Y B,Fan C C,Xing Y Z,et al. Natural variation in GS5 plays an important role in regulating grain size and yield in rice[J]. Nature Genetics,2011,43(12):1266-1269.
[12]Sun L Y,Li X J,Fu Y C,et al. GS6,a member of the GRAS gene family,negatively regulates grain size in rice[J]. Journal of Integrative Plant Biology,2013,55(10):938-949.[HJ1.67mm]
[13]Zhou Y,Miao J,Gu H Y,et al. Natural variations in SLG7 regulate grain shape in rice[J]. Genetics,2015,201(4):1591-1599.
[14]Ishimaru K,Hirotsu N,Madoka Y,et al. Loss of function of the IAA-glucose hydrolase gene TGW6 enhances rice grain weight and increases yield[J]. Nature Genetics,2013,45(6):707-711.
[15]Fan C C,Yu S B,Wang C R,et al. A causal C-A mutation in the second exon of GS3 highly associated with rice grain length and validated as a functional marker[J]. Theoretical and Applied Genetics,2009,118(3):465-472.
[16]Wang C R,Chen S,Yu S B. Functional markers developed from multiple loci in GS3 for fine marker-assisted selection of grain length in rice[J]. Theoretical and Applied Genetics,2011,122(5):905-913.
[17]王軍,杨杰,徐祥,等. 水稻千粒重基因TGW6功能标记的开发与利用[J]. 中国水稻科学,2014,28(5):473-478.
[18]Zhang H L,Zhang D L,Wang M X,et al. A core collection and mini core collection of Oryza sativa L. in China[J]. Theoretical and Applied Genetics,2011,122(1):49-61.
[19]Takano-Kai N,Jiang H,Powell A,et al. Multiple and independent origins of short seeded alleles of GS3 in rice[J]. Breeding Science,2013,63(1):77-85.
[20]Tapia-Tussell R,Quijano-Ramayo A,Rojas-Herrera R,et al. A fast,simple,and reliable high-yielding method for DNA extraction from different plant species[J]. Molecular Biotechnology,2005,31(2):137-139.
[21]Mao H L,Sun S Y,Yao J,et al. Linking differential domain functions of the GS3 protein to natural variation of grain size in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(45):19579-19584.

