水分胁迫下柠条叶片气孔导度对环境因子的响应
韩磊+++孙兆军++焦炳忠
doi:10.15889/j.issn.1002-1302.2016.10.073
摘要:以宁夏河东沙地沙生灌木柠条为试验材料,研究不同水分条件下柠条叶片气孔导度对环境主要驱动因子的响应及敏感性。结果表明:随着水分胁迫程度的增强,柠条叶片气孔导度明显降低,其过程与蒸腾速率的变化一致但不同步;在柠条叶片气孔导度对光合有效辐射的响应方面,随着土壤含水量的降低,气孔启动速度下降,但轻度水分胁迫下该响应过程的敏感性较高;充分供水、轻度水分胁迫、中度水分胁迫条件下,柠条叶片气孔导度的主导因素为气温;对于重度水分胁迫(田间最大持水量的20%~40%),柠条叶片气孔导度对温度的敏感性降低,重度胁迫下水汽压饱和亏缺成为影响柠条气孔导度的主要因素,其贡献率为76.6%(P<0.01)。
关键词:柠条;气孔导度;水分胁迫;环境因子;响应机制;河东沙地
中图分类号: S184;S157文献标志码: A文章编号:1002-1302(2016)10-0265-04
收稿日期:2016-04-14
基金项目:宁夏自然科学基金(编号:NZ13025)。
作者简介:韩磊(1985—),男,宁夏石嘴山人,博士,副研究员,主要从事水土保持、生态修复研究。E-mail:layhan@163.com。柠条(Caragana korshinskii Kom.)作为治理水土流失和退化沙化草场的先锋植物,具有广泛的适应性和很强的抗逆性。处于干旱、半干旱农牧交错带的宁夏河东沙区,长期以来大面积种植柠条人工林用于防风固沙和草地生态系统的恢复。但是由于该地区降水量稀少且无效蒸发量大,人工林的营造将改变沙地水分的再分配。近年来,随着全球气温升高,该地区降水量以20~40 mm/10年的速度逐渐减少[1],气候总体上呈现干化趋势[2-3]。植物叶片对气温升高、降水减少的响应比较明显,植物气孔影响蒸腾、光合等生理机能,且随着所处的环境状况而时刻发生变化,在植物中起平衡调节作用[4],气孔特性的具体变化则随物种、干旱程度而呈现不同的特点。如干旱环境使大多数植物气孔密度增大,气孔相对开度变小[5-6];在干旱条件下,柠条受到明显的水分胁迫,表现出明显的光抑制现象[7]。诸多研究表明,植物叶片气孔特性的异质性使其对胁迫环境响应也有很大差异[8],因此,研究不同水分条件下柠条叶片气孔导度对环境主要驱动因子响应的敏感性,在全球变暖加速地球系统水循环的背景下,对于分析干旱胁迫下环境因子对河东沙地林木水分利用的影响机制尤为重要。
1材料与方法
1.1研究区概况
试验地点位于宁夏河东沙地南缘的同心县,地理坐标为36°52′06″N,105°59′7″E,海拔1 568 m,在气候区上属于温带大陆性气候,年平均气温为8.7 ℃,极端最高气温为38.5 ℃,极端最低气温为-27.3 ℃,≥10 ℃年平均积温为 2 963.1 ℃,无霜期为165~183 d;雨热同季,多年平均降水量为251 mm,降水多集中在7—9月,占年降水量的72.4%;多年平均蒸发量为 2 340 mm;年日照时间多年平均值为 2 900~3 055 h。试验区土壤类型为灰钙土区的沙化土壤,田间最大持水量为21.3%,表层土壤平均容重为1.47 g/cm3。
1.2试验方法
在试验区选取3年生柠条植株,于2014年4月植入试验花盆(高33 cm,上口径35 cm,下口径29 cm),试验盆内土壤与试验区大田土壤一致,栽植后将其置于试验地的温室内并充分补水,使其成活并正常生长。7月分别人工控制土壤水分含量(SWC)为田间最大持水量(w)的80%~100%(T1处理:充分供水)、60%~80%(T2处理:轻度水分胁迫)、40%~60%(T3处理:中度水分胁迫)、20%~40%(T4处理:重度水分胁迫),即各处理土壤水分含量:T1处理,17.0%~21.3%;T2处理,12.8%~17.0%;T3处理,8.5%~12.8%;T4处理,4.3%~8.5%。以上区间均含下不含上。每个处理3次重复,待长势稳定后,于2014年8月开始观测不同水分梯度下苗木叶片气孔导度变化节律及其影响因子。
1.2.1植物叶片气孔导度采用Li-6400(Li-Cor Inc.,Lincoln,USA)观测,选择苗木中上部向阳面生长良好的叶片,在生长季典型晴天,从7:00—19:00每隔2 h测定1次,每张叶片每次连续采集6个稳定的数据,取平均值。测定内容有气孔导度(Gc)、蒸腾速率(Tr)、胞间CO2浓度(Ci)等。
1.2.2气孔导度对光合有效辐射(PAR)的响应利用Li-6400-02B红蓝光源(Li-Cor Inc.,Lincoln,USA)设定模拟光辐射强度,模拟光辐射强度的梯度设置为0、50、100、200、400、600、800、1 000、1 200、1 500、1 800、2 000、2 200 μmol/(m2·s),观测苗木叶片气孔导度对光辐射强度的响应。
1.2.3环境因子采用美国Vantage pro 2 自动气象站(Davis Inc.,USA),10 min记录1次气温、相对湿度(2 m处)、光量子通量密度、降水量等气象因子;同时采用ML3X土壤水分速测仪(Delta-T Inc.,UK)测定盆栽土壤单位体积含水量;土壤水分速测仪在测定前用烘干法标定。
1.3数据分析
采用SPSS 19. 0统计分析软件对数据进行相关分析、单因素方差分析、多变量偏相关分析。
2结果与分析
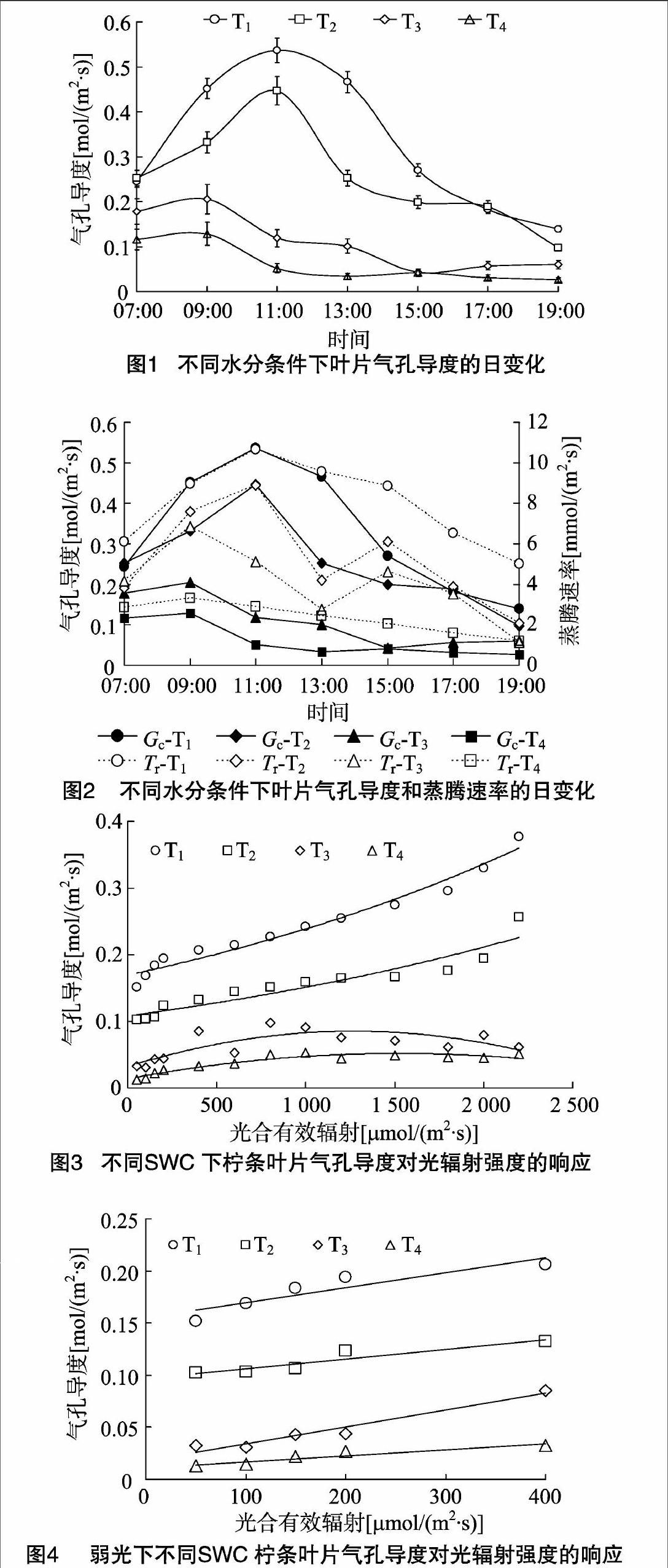
2.1不同土壤水分下柠条叶片气孔导度的日变化节律
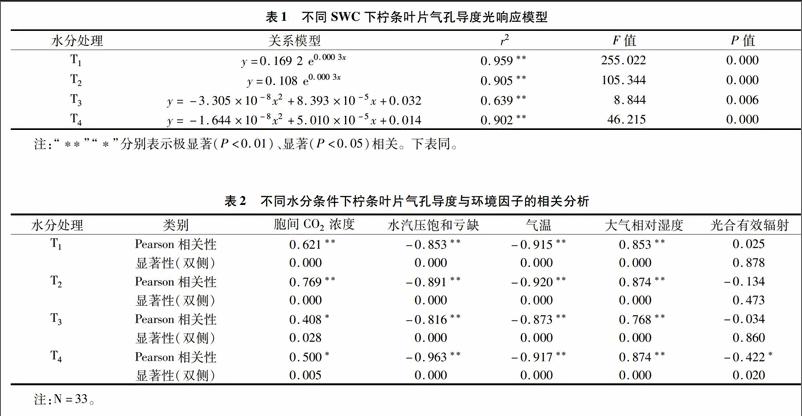
气孔是植物叶片与外界环境进行气体、水分交换的重要通道,在调节植物水分状况中起关键作用。当供水和蒸腾需水之间不平衡,特别是供小于需时,植物会适时作出各种响应以减轻胁迫[9]。由图1可见,柠条叶片在水分胁迫下(T3、T4处理),气孔导度峰值前移,于09:00达到峰值,之后叶部水分亏缺提早出现,正午前后叶片气孔逐渐闭合,气孔导度逐渐降低;而T1、T2处理下气孔导度在11:00达到峰值,T1、T2处理日均值分别为(0.327±0.156)、(0.253±0.112)mol/(m2·s);在低水平的土壤含水量下,苗木叶片气孔导度的日变化相差不大,都维持在较低的水平,T3、T4处理的日均值分别为(0.109±0.063)、(0.061±0.043) mol/(m2·s)。受水分胁迫,T3、T4处理植物叶片气孔导度峰值与T1、T2处理相比分别下降了61.7%、54.1%,76.1%、71.4%。气孔的运动直接调控着蒸腾速率的变化,柠条气孔导度与蒸腾速率的变化规律较为一致但并不同步(图2)。中午由于光照度大、气温高、空气湿度低,植物为减少过度蒸腾失水,叶片气孔开度会减小或关闭;15:00,在T2、T3处理下,蒸腾的减弱使叶细胞的含水量得到一定程度的恢复,Tr分别出现峰值,而Gc值则处于较低点,这是由于此时大气温度较高甚至达到最高值,保卫细胞因气温升高失水使气孔逐渐关闭,而植物的蒸腾作用因组织储存水而滞后于气孔变化[10-11]。随着光照度的减弱,日落前后气孔逐步关闭,蒸腾作用逐渐减弱。
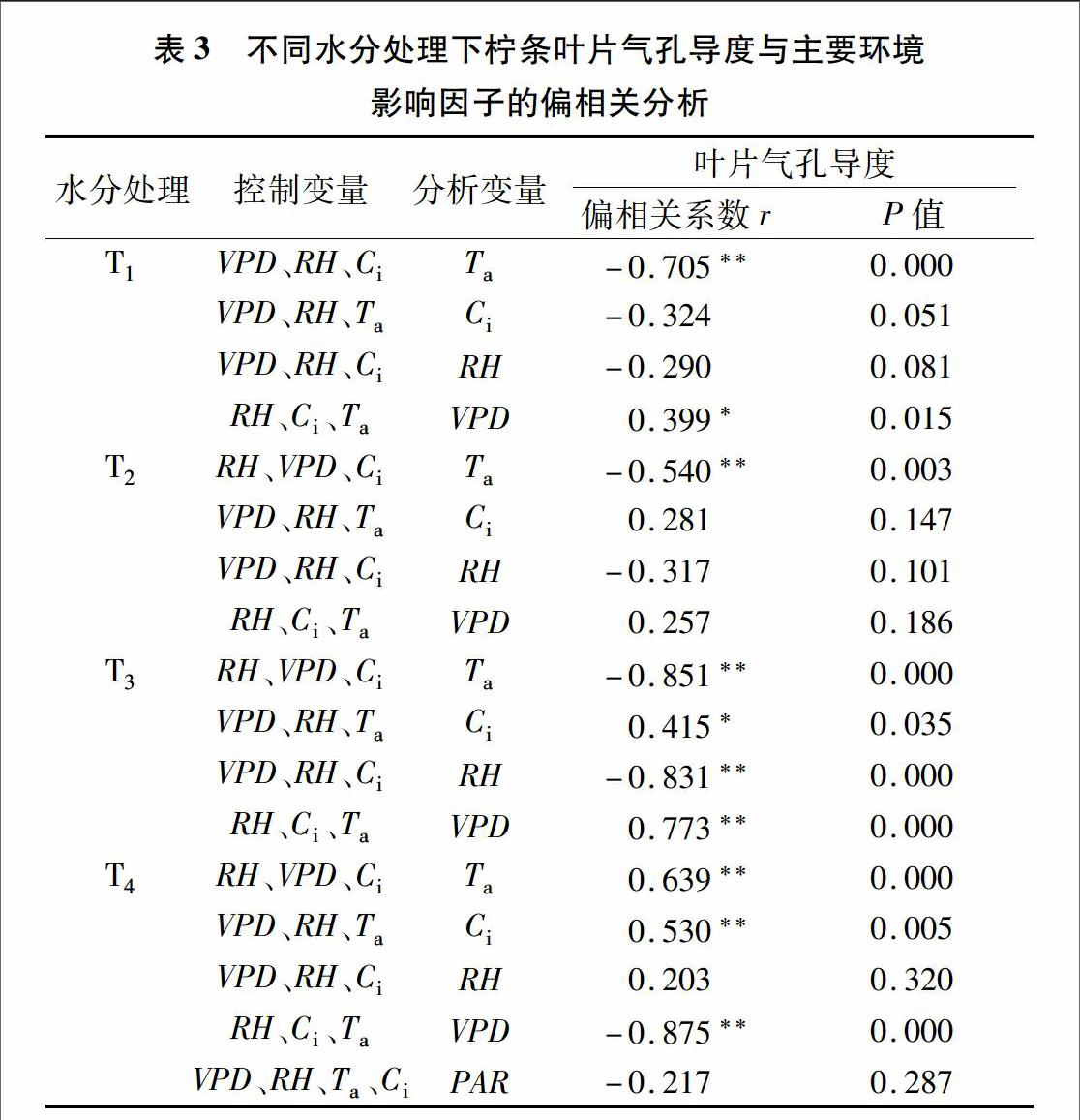
2.2不同土壤水分条件下柠条叶片气孔导度对光合有效辐射的响应
在假设水汽、温度、湿度恒定的条件下,分析Gc对PAR的响应。由图3、图4可见,T1、T2水分处理下,Gc、PAR呈现指数正相关关系(P<0.001),拟合方程为Gc=aePAR,可以解释95.9%、90.5%的变量,同时随着土壤含水量的增加,Gc对PAR的敏感性(a值)增加;当水分胁迫(T3、T4处理)增大时,柠条叶片气孔导度随着光辐射强度的增加先增大后减小,即在PAR<400 μmol/(m2·s)时,Gc随着PAR的增加迅速增大,之后柠条叶片气孔导度对光合有效辐射的响应强度变弱;当光合有效辐射达到1 000 μmol/(m2·s)左右时,PAR进一步增强,植物叶片气孔导度逐渐下降,以防组织水势过度降低造成植物萎蔫,用拟合方程Gc=aPAR2+bPAR+c来描述,可以解释63.9%、90.2%的变量(P<0.01),详见表1。在较低光照度[PAR<400 μmol/(m2·s)]下,无论是充分供水还是水分胁迫条件下,柠条叶片气孔导度随着PAR的增加而增大,拟合方程为Gc=kPAR+c,但启动速度(可用常数c代表)不同,由小到大依次为T1处理(0.155)>T2处理(0.097)>T3处理(0.018)>T4处理(0.011);在低光照度下,Gc对PAR的敏感性(k)由高到底依次为T3处理(k=0.000 2,r2=0932**,P=0.005)>T1处理(k=0.000 1,R2=0.776*,P=0.031)>T2处理(k=9.322×10-5,r2=0.829*,P=0.02)>T4处理(k=5.838×10-5,r2=0.871*,P=0.013)。由此可见,在低光照度下,随着土壤含水量的降低,柠条叶片气孔导度对光合有效辐射的响应表现为气孔启动速度下降,但轻度水分胁迫下该响应过程的敏感性较高。
2.3不同土壤水分条件下柠条叶片气孔导度与主要环境因子的相关性分析
由表2可以看出,从环境因子对柠条叶片气孔导度的影响来看,柠条叶片气孔导度与气温(Ta)、水汽压饱和亏缺(VPD)、相对湿度(RH)、辐射强度、胞间CO2浓度有显著相关关系,但在不同土壤水分条件下,影响气孔导度的主要因子略有不同。在T1、T2处理下,Ta、VPD、RH、Ci是影响柠条叶片气孔导度的主要因子,且呈现极显著的相关关系。由表3偏相关分析结果可知,在T1、T2、T3处理下,柠条叶片气孔导度的主导因素为大气温度(Ta),贡献率r2分别为49.7%、292%、72.4%。在充分供水(T1处理)下,柠条气孔导度的主要影响因子由大到小排序:Ta(偏相关系数r=-0.705,P<0.01)>VPD(偏相关系数r=0.399,P<0.05);在轻度水分胁迫(T2处理)下,除Ta外(偏相关系数r=-0.540,P<001),其他气象因子对气孔导度的影响不显著;在中度水分胁迫(T3处理)下,柠条气孔导度的主要影响因子由大到小排序:Ta(偏相关系数r=-0.851,P<0.01)>RH(偏相关系数r=-0.831,P<0.01)>VPD(偏相关系数r=0.773,P<001)>Ci(偏相关系数r=0.415,P<0.05),其贡献率r2分别为 72.4%、69.1%、56.7%、17.2%;在重度水分胁迫(T4处理)下,柠条叶片气孔导度对温度的敏感性降低,且随着温度的升高呈现显著的正相关,其影响因子由大到小排序:VPD(偏相关系数r=-0.875,P<0.01)>Ta(偏相关系数r= 0639,P<0.01)>Ci(偏相关系数r=0.530,P<0.01)。可以看出,重度胁迫下VPD成为影响柠条气孔导度的主要因素,其贡献率为76.6%。
3讨论与结论
植物气孔是调控“土壤-植被-大气”连续体之间物质和能量交换的关键环节[12],气孔对环境因子的响应过程及其对主要驱动因子响应的敏感性随物种、干旱程度而不同。水分对叶片气孔导度的影响表现为水分的降低会对气孔导度产生抑制作用。随着水分胁迫程度的增强,柠条叶片气孔导度明显降低,蒸腾失水减弱,柠条气孔导度与蒸腾速率的变化规律较为一致但并不同步,表现在午后(15:00)植物的蒸腾作用因组织储存水而滞后于气孔变化。正午前后气孔关闭后的叶组织细胞水分得到一定程度的恢复,Tr出现2次峰值,而此时Gc值仍处于较低点;之后随着光照度的减弱,蒸腾作用随着气孔导度的降低逐渐下降。该过程说明,柠条通过控制气孔的开放程度来适应较干旱的环境,以至于在较干旱、高温的环境下表现出较强的水分调节能力。这与柯世省等研究水分胁迫对云锦杜鹃、紫花苜蓿蒸腾速率和气孔导度的影响结果[13-14]较为一致。
光合有效辐射强度对柠条叶片气孔导度的影响与土壤有效水供给能力有关。在充分供水、轻度水分胁迫下,气孔导度对光合有效辐射的敏感性随着土壤含水量的增加而增加;当中度、重度水分胁迫出现时,柠条叶片气孔导度随着光辐射强度的增加先增大后减小,即在PAR<400 μmol/(m2·s)时,Gc随着PAR的增加迅速增大,之后柠条叶片气孔导度对光合有效辐射的响应强度变弱,当光合有效辐射达到 1 000 μmol/(m2·s) 左右时,PAR进一步增强,植物叶片气孔导度逐渐下降,以防止组织水势过度降低造成植物萎蔫,这与干旱胁迫下柠条叶片蒸腾的光响应过程较为一致[15]。在低光照度下,柠条叶片气孔导度对光合有效辐射的响应表现为随着土壤含水量的降低,气孔启动速度下降,但轻度水分胁迫下该响应过程的敏感性较高。
由于不同植物的遗传特性、测定时的环境、时间尺度的不同,以及未考虑各个环境因子的相互作用对气孔导度的影响,由此得到的气孔导度与环境因子之间的关系也不尽一致[16]。不同土壤水分条件下主要环境因子对柠条叶片气孔导度的综合影响表明,在充分供水、轻度水分胁迫、中度水分胁迫条件下,柠条叶片气孔导度的主导因素为大气温度;对于重度水分胁迫(田间最大持水量的20%~40%),柠条叶片气孔导度对温度的敏感性降低,重度胁迫下水汽压饱和亏缺(VPD)成为影响柠条气孔导度的主要因素,说明在缺水情况下柠条气孔对VPD的响应比较高土壤水分含量处理敏感。气孔对环境因子的响应规律是十分复杂的,各种环境因子间以及环境因子对植物体的作用都存在交互作用[17-20],叶片气孔特性具有异质性,且其对胁迫环境响应也有很大的差异[8,21-22],如左应梅等分析土壤相对含水量、光合有效辐射和空气相对湿度对华南8号木薯的综合影响发现:当土壤相对含水量较低时,土壤相对含水量是影响气孔导度的主导因子[23];随着土壤相对含水量的增加,影响气孔导度的主导因子由土壤相对含水量转变为光合有效辐射。孙林等对华北落叶松冠层气孔导度的影响因子研究认为,PAR是Gc的驱动因子,VPD则是Gc的限制因子[24]。气孔对干旱的适应方式有前馈式反应、反馈式反应2种[4],对于柠条在重度水分胁迫下的表现则为前馈式反应,即水气压亏缺直接作用而引起气孔关闭以阻止水势的进一步下降,从而建立预警系统。
参考文献:
[1]方锋,孙兰东,郭俊琴,等. 中国西北地区城市经济发展对降水趋势的影响[J]. 自然资源学报,2014,29(11):1878-1887.
[2]徐小玲,延军平. 近30年毛乌素沙区的气候与厄尔尼诺/拉尼娜事件的相关分析[J]. 干旱区研究,2003,20(2):117-122.
[3]王亚军,高尚玉,马玉贞,等. 基于树轮重建的宁夏河东沙地西部公元1899年来年降水量的变化[J]. 干旱区地理,2010,33(3):377-382.
[4]司建华,常宗强,苏永红,等. 胡杨叶片气孔导度特征及其对环境因子的响应[J]. 西北植物学报,2008,28(1):125-130.
[5]高彦萍,冯莹,马志军,等. 水分胁迫下不同抗旱类型大豆叶片气孔特性变化研究[J]. 干旱地区农业研究,2007,25(2):77-79.
[6]Martinez J P,Silva H,Ledent J F,et al. Effect of drought stress on the osmotic adjustment,cell wall elasticity and cell volume of six cultivars of common beans (Phaseolus vulgaris L.)[J]. European Journal of Agronomy,2007,26(1):30-38.
[7]肖春旺. 施水量变化对毛乌素沙地4种优势植物叶绿素荧光的影响[J]. 草业学报,2002,11(2):85-90.
[8]王碧霞,曾永海,王大勇,等. 叶片气孔分布及生理特征对环境胁迫的响应[J]. 干旱地区农业研究,2010,28(2):122-126.
[9]孙谷畴,赵平,曾小平,等. 亚热带森林演替树种叶片气孔导度对环境水分的水力响应[J]. 生态学报,2009,29(2):698-705.
[10] Han L,He K N,Hu X B,et al. Canopy transpiration response to environmental variations in Platycladus orientalis:Properties and modeling[J]. Pakistan Journal of Botany,2012,44(2):541-545.
[11]赵秀华,赵平,朱丽薇,等. 不同树高对荷木液流密度、整树蒸腾量和时滞的效应[J]. 广西植物,2015,35(1):53-60.
[12]唐凤德,武耀祥,韩士杰,等. 长白山阔叶红松林叶片气孔导度与环境因子的关系[J]. 生态学报,2008,28(11):5649-5655.
[13]柯世省,魏燕,陈贤田,等. 云锦杜鹃气孔导度和蒸腾速率对水分的响应[J]. 安徽农业科学,2007,35(21):6363-6365.
[14]罗永忠,成自勇. 水分胁迫对紫花苜蓿叶水势、蒸腾速率和气孔导度的影响[J]. 草地学报,2011,19(2):215-221.
[15]韩磊,孙兆军,展秀丽,等. 宁夏河东沙区柠条植株叶片蒸腾对干旱胁迫的响应[J]. 生态环境学报,2015,24(5):756-761.
[16]高冠龙,张小由,常宗强,等. 植物气孔导度的环境响应模拟及其尺度扩展[J]. 生态学报,2016,36(6):1491-1500.
[17]吴大千,徐飞,郭卫华,等. 中国北方城市常见绿化植物夏季气孔导度影响因素及模型比较[J]. 生态学报,2007,27(10):4141-4148.
[18]刘广志,陈炳佑,侍福梅. MAP18参与了脱落酸调控的拟南芥气孔关闭及根生长[J]. 江苏农业科学,2015,43(11):55-57.
[19]杨天梅,许宗亮,左应梅,等. 横断山区珠子参不同居群叶片形态变异及其与环境因子的关系[J]. 江苏农业科学,2015,43(9):276-280.
[20]朱美瑛,王康才,李雨晴. 金线莲叶片气孔与光合特性研究[J]. 江苏农业科学,2014,42(11):210-212.
[21]冯海萍,曲继松,张丽娟,等. 典型旱作区不同田间持水量对塑料拱棚春茬番茄光合生理特性的影响[J]. 江苏农业学报,2014,30(2):381-387.
[22]徐刚,彭天沁,高文瑞,等. 氮肥水平对木薯渣复合基质栽培黄瓜生长及光合作用的影响[J]. 江苏农业学报,2015,31(1):68-72.
[23]左应梅,陈秋波,邓权权,等. 土壤水分、光照和空气湿度对木薯气孔导度的影响[J]. 生态学杂志,2011,30(4):689-693.
[24]孙林,管伟,王彦辉,等. 华北落叶松冠层平均气孔导度模拟及其对环境因子的响应[J]. 生态学杂志,2011,30(10):2122-2128.

