有机肥和微生物菌剂配施对‘赤霞珠’葡萄根际土壤细菌群落多样性的影响








摘 要 为了研究有机肥与微生物菌剂配施对‘赤霞珠’葡萄根际土壤性质及细菌群落的影响,并提出高效可行的有机肥配施模式。以7 a生‘赤霞珠’葡萄为研究对象进行田间试验,设置7个施肥处理:CK(传统施肥)、A1(蚯蚓粪+未腐熟枝条+100倍光合细菌菌剂)、A2(蚯蚓粪+未腐熟枝条+200倍光合细菌菌剂)、A3(蚯蚓粪+未腐熟枝条+300倍光合细菌菌剂)、B1(蚯蚓粪+腐熟枝条+100倍光合细菌菌剂)、B2(蚯蚓粪+腐熟枝条+200倍光合细菌菌剂)、B3(蚯蚓粪+腐熟枝条+300倍光合细菌菌剂)。结果表明:与CK处理比较,B2处理显著降低土壤pH,提高土壤有机质、碱解氮、速效钾、全氮含量。A2处理显著提高Chao1 87.60%,且其OTU数量最多,说明A2处理可显著提高根际细菌群落丰富度。与CK比较,B2处理改变根际土壤细菌群落结构,显著增加变形菌门、放线菌门和拟杆菌门的相对丰度,降低厚壁菌门的相对丰度。与施用未腐熟枝条A2比较,施用腐熟枝条B2处理显著增加拟杆菌门的相对丰度。相关分析结果表明,土壤中速效钾、碱解氮、全氮、有机质的含量与细菌群落优势菌群存在显著正相关关系。因此,B2处理为最佳施肥配比方案,其次为A2处理。
关键词 蚯蚓粪;微生物菌剂;葡萄园根际土壤;土壤养分;细菌群落
葡萄(Vitis vinifera" L.)是一种多年生藤本植物,由于其适应性强,广泛分布在世界各地[1],是常见的一类经济作物,以葡萄为原料加工生产的产品在全球市场中十分常见,发展前景广阔。近年来,越来越多的人注重养生和保健,对葡萄酒的热爱越来越强[2]。宁夏贺兰山东麓葡萄酒产区位于中国中温带干旱气候区,具有典型的大陆性气候特征,降水稀少,光照充足,昼夜温差大,是重要的葡萄酒地理标志保护产区,被誉为酿酒葡萄的‘黄金生长地带’[3]。然而,该区土壤富含砂砾、有机质含量偏低,氮磷钾等养分供给不足,是制约该区葡萄生产的重要因素。
与化肥相比,有机肥料对土壤中氮、磷、钾等土壤养分的提高作用优于化肥[4]。施用有机肥可以通过调节微生物群落,增强农田生态系统中多种土壤功能对生物多样性丧失的适应性与恢复能力[5]。土壤细菌是影响土壤碳动态、养分循环和植物生长的重要因素[6]。已有研究指出,施用微生物菌剂后土壤菌群发生了明显变化,利用其特殊功能或与土壤中的菌群共同作用,进而影响根际的微生物活性和植株的生长[7-8]。刘璐等[9]研究发现,施用胶冻样芽孢杆菌0.5 kg能更好地增加土壤养分释放,增强土壤生物活性,从而促进葡萄更好地生长和土壤性质的提升,实现土壤的可持续利用。说明微生物菌剂可提高土壤养分供应能力,提高土壤肥力。同时,Wang等[10]将猪粪与小麦秸秆混合制成有机肥进行堆肥试验,在处理中加入了微生物菌剂,对堆肥过程中的细菌群落特征进行分析,结果表明在门水平上,变形杆菌和绿弯曲菌的相对丰度较高,这表明在堆肥过程中,微生物菌肥可显著改变其理化性质和细菌群落结构。
针对宁夏贺兰山东麓长期大量使用化肥造成土壤板结,有机质含量低,土壤养分失衡以及细菌群落多样性降低等问题,本研究在宁夏银川市君祥酒庄的葡萄园中施用有机肥(蚯蚓粪+葡萄枝条渣)配施微生物菌剂,通过高通量测序对根际土壤细菌群落结构进行研究,对土壤物理化学性质、菌群结构以及有机肥配施微生物菌剂的关系进行分析,提出高效可行的配施方案,以期为宁夏贺兰山东麓葡萄园合理施肥提供重要的理论依据。
1 材料与方法
1.1 试验地概况
试验地点位于宁夏银川市君祥酒庄,海拔 "1 010~1 150 m。试验样地年平均温度≥10" ℃,有效积温1 534.9 ℃,7-9月有效积温961.6 ℃,年降水量为193.4 mm,全年日照达3 000 h。地形平坦,土壤侵蚀度轻,土壤为淡灰钙土,土质为沙壤土,土壤呈碱性。
1.2 试验设计
试验于2021年4月至2022年10月在宁夏银川市君祥酒庄葡萄园进行,株行距为2.5 m×0.8 m,选取7个小区,总面积为60 m2,无隔离行,南北走向,“厂”字型架势栽培。供试品种为 "7 a生的‘赤霞珠’葡萄;有机肥为蚯蚓粪(含有机质26.6%,N 1.69%,P2O5 1.09%,K2O" "3.13%)、腐熟(含有机质33.1%,N 1.0%,P" "1.0%,K" "1.3%)/未腐熟葡萄枝条(直接将田间采集的葡萄枝条粉碎后施入),蚯蚓粪由宁夏万辉生物环保科技有限公司生产,腐熟葡萄枝条渣由宁夏中青生物技术有限公司生产;微生物菌剂由山西果粟康生物技术有限公司生产,功能菌为光合细菌菌剂,沼泽红假单细胞≥2.0。
试验采用双因素随机区组设计,共设置7种处理,每个处理设置3 个重复,共24 个处理。于2021年4月6日采用穴施方式,施入蚯蚓粪和葡萄枝条各5 kg,光合细菌菌剂4.5 mL,稀释倍数为100倍、200倍、300倍,分别于5月31日、6月15日和6月30日进行叶面喷施。各处理的施肥方案如表1所示。施肥后每隔10~15 d浇1次水,后期不进行任何追肥措施,11月埋土。
1.3 采样与分析
1.3.1 土样采集 2022年10月1日,收集收获期距离植株10~20 cm的根际土壤,首先将表层5 cm左右土壤碎石及枯落叶清除,通过五点取样法,用灭菌的取土器挖取距葡萄根际约0~20 cm的土壤,轻轻抖动以除去较大的土块,混合均匀后利用四分法使每个处理保留1 kg土壤。将采集的土壤其中一份放入无菌自封袋中,将其风干[11],用1 mm筛子过筛,用于测定土壤养分指标。另一份土样迅速通过1 mm筛子后,加入到5 mL冻存管中,转移至液氮中暂时保存,随后将样品转移到-80 ℃冰箱中,利用高通量测序测定细菌群落多样性。
1.3.2 土壤的理化性质分析 土壤电导率(EC)和pH分别用电导率仪和pH计测定。土壤速效钾检测利用火焰光度法,有效磷检测利用NaHCO3钼锑抗比色法,全磷检测通过HClO4-H2SO4法,碱解氮和全氮含量通过凯氏定氮法测定,有机质检测通过重铬酸钾容量法-外加热法。以上指标的检测方法参照鲍士旦《土壤农化分析》[12]。
1.3.3 土壤DNA提取、PCR扩增和高通量基因测序分析 每个样品取0.5 g土样,利用SDS或CTAB法提取样品基因组DNA,通过琼脂糖凝胶电泳对DNA的浓度及纯度进行检测,取一定量样品,加入无菌水将浓度稀释到1 ng/μL[13]。
以稀释后的基因组DNA为模板,基于测序区域的序列,使用带Barcode的特异引物,New England Biolabs公司的Phusion High-Fidelity PCR Master Mix with GC Buffer。高保真和高效的酶保证PCR的准确性与效率。前引物序列为5′-GGAAGTAAAAGTCGTAACAAGG-3′,后引物序列为5′-GCTGCGTTCTTCATCGATGC-3′。
将扩增产物进行等浓度混样,混合均匀后通过2%琼脂糖凝胶电泳对扩增产物进行检测,Thermo Scientific公司的GeneJET胶回收试剂盒对产物进行回收[14]。
文库构建采用New England Biolabs公司的Neb Next UltraTMDNA Library Prep Kit for Illumina建库试剂盒,利用Qubit进行检测和定量,再利用Miseq进行上机测序。
1.3.4 统计与分析 将试验数据输入Excel 2022,利用SPSS 23.0软件分析土壤理化因子差异、细菌多样性指数和组间显著性。采用Mothur(version v.1.30)软件进行Alpha多样性分析。利用Canoco 5.0做冗余分析(RDA)以及主成分分析(PCA)。Pearson分析环境因素与细菌群落之间的相关性。利用Origin 2022软件绘制细菌群落稀疏曲线、花瓣图、门水平相对丰度柱状图。
2 结果与分析
2.1 不同施肥处理对土壤理化性质的影响
由表2 可知,不同施肥处理显著影响土壤理化性质(Plt;0.05)。与CK相比,各处理组土壤EC值、有机质含量提高,其中有机质含量最高的是B1、B2,提高18.83%、13.8%,A2、B2土壤的EC值最高。B1、B2处理土壤的速效钾含量提高,其他处理均降低。与CK相比,B2、B3、A2处理土壤pH降低,其他处理均有所提高,B1、A1土壤pH最高,分别提高2.37%、1.18%。与CK相比,除A1处理外,其他处理的碱解氮含量均有所提高,表现为B3>B1>B2>A2>A3>CK>A1,A1、A3土壤有效磷含量降低,其中以A3最低,为14.86 mg/kg。与CK相比,A3与CK土壤的全氮含量相等,为0.49 g/kg,B1的全氮含量降低20.41%。A3、B2显著增加全磷含量,其他各处理均降低。
相比CK,B2处理下EC、有机质、碱解氮、有效磷、速效钾、全氮含量显著提高27.37%、 "13.8%、9.57%、22.23%、23.10%、24.62%。B2处理降低pH,其次为A2处理。除速效钾、全磷含量、pH降低外,其他理化性质都有所提高。
2.2 不同施肥处理对土壤细菌多样性的影响
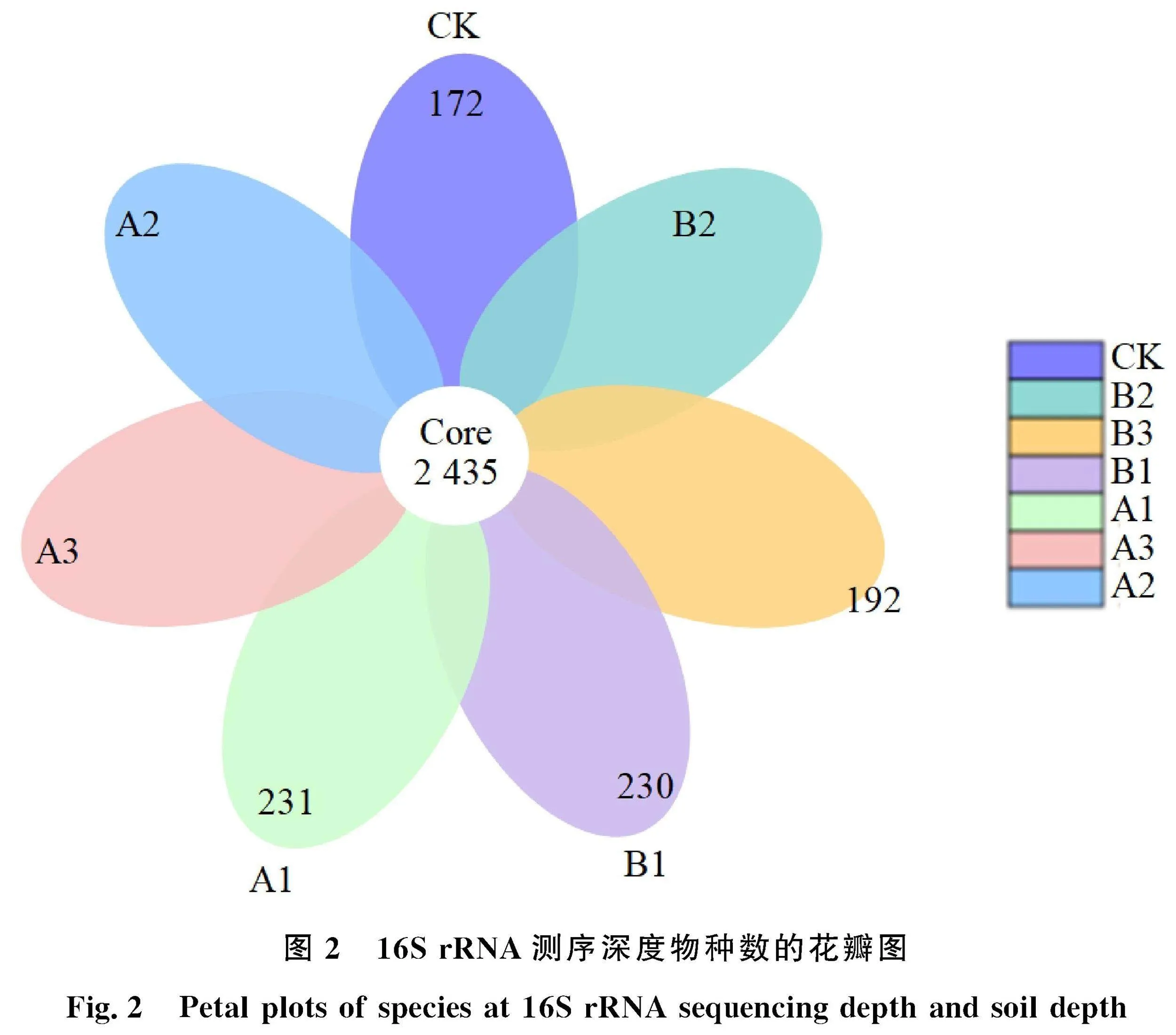
本研究使用分类操作进行序列优化。稀有曲线分析表明,每条曲线最终接近平坦,表明该测序的样本量充足,测序数据合理(图1),可进行下一步分析。聚类分析获得18 562个OTU。7个处理共同拥有2 434个细菌OTU,分别为172、230、169、192、231、303、220(图2)。各处理OTU数量始终高于CK,表明施用有机肥配施菌剂增加OTU数量。其中A2处理的OTU数量最多,为303个,B2处理的OTU数量最少。表明A2处理葡萄根际土壤的细菌类群最丰富。
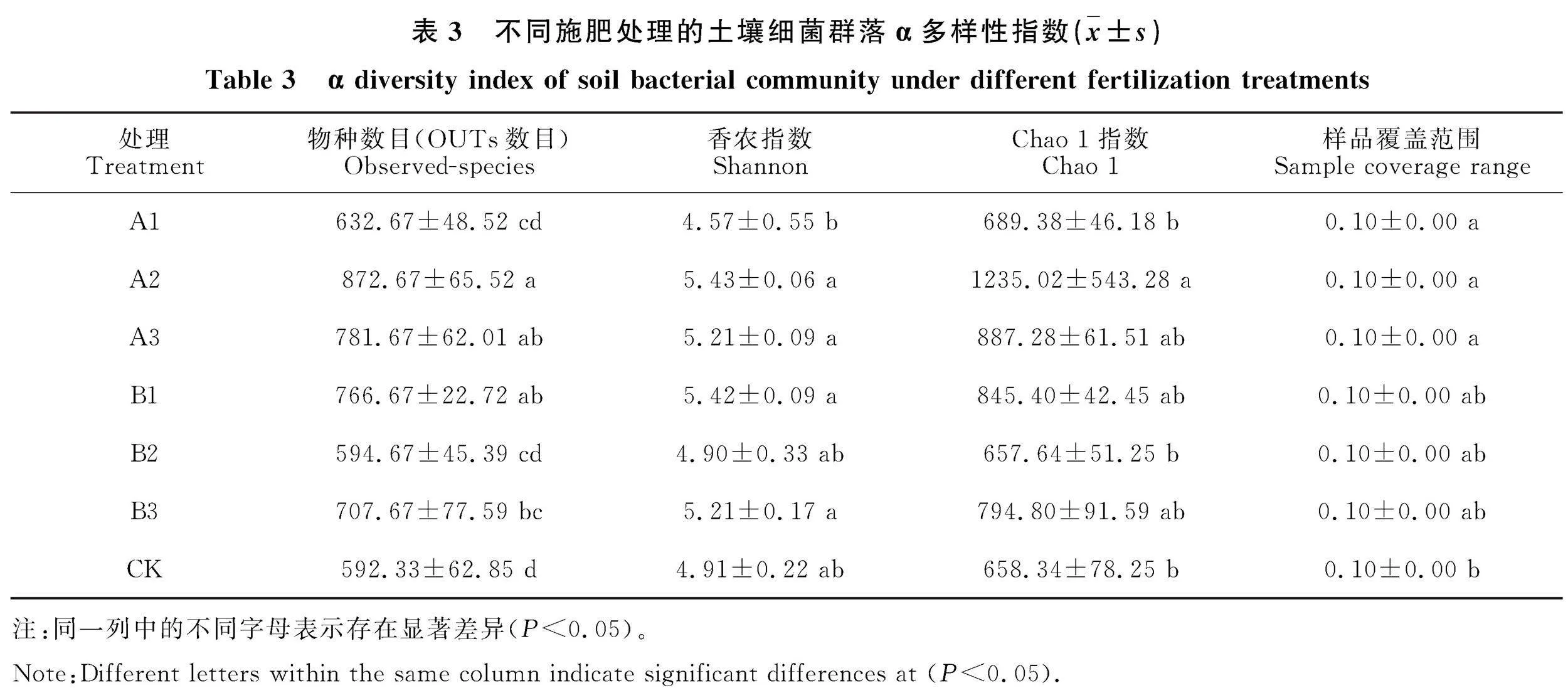
对不同处理土壤细菌群落进行α多样性指数计算,结果如表3所示。所有样本的Goods coverage估计值均大于0.998,表明这些数据较好地代表了样本中微生物的真实情况。对于细菌群落,与CK处理相比,各处理土层中的Chao 1指数均显著增加,其中A2处理显著增加87.60% "(Plt;0.05),该土壤中含有的物种数目(Observed-species)也最多,说明A2处理可以提高土壤细菌群落丰富性。Shannon指数反映物种的多样性,与CK相比,A2处理的Shannon指数最高,A1最低,其他处理均高于CK。说明A2处理可显著提高根际细菌群落多样性指数与丰富度。
2.3 不同施肥处理对土壤细菌群落结构和组成的影响
图3表明细菌在门水平上的相对丰度。放线菌门(Actinobacteria)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)是处理的优势细菌门,占总相对丰度的" "34.05%~42.64%。与CK相比,不同施肥处理不仅改变了主要细菌门的相对丰度,而且改变了主要细菌门的组成。在0~20 cm深度土层中,CK中变形菌门(Proteobacteria)是优势细菌门,与CK相比,A2、B2处理的变形菌门相对丰度最高,分别增加24.7%和24.0%,B3、A3的相对丰度最低。相反,与CK相比,B2、A1、A2降低厚壁菌门(Firmicutes)的相对丰度。拟杆菌门(Bacteroidota)的相对丰度中,施用腐熟枝条高于未腐熟枝条,表现为T3>B2>B1>CK>A2>A1>A3。除A2、A3外,其他各处理放线菌门(Actinobacteriota)的相对丰度均显著提高。结果表明:各处理中细菌群落相对丰度随不同施肥处理而变化,腐熟枝条和微生物菌剂的添加可以改变葡萄园中土壤优势细菌群落的相对丰度。
通过主坐标分析(PCA)法,分析根际土壤菌群结构的变化。根据图4得知,第一、二主坐标成分的总贡献率分别为35.96%、38.76%和 "36.23%。样本的处理不同,在PC轴上的分布也不同,施用未腐熟枝条处理组(A1、A2、A3)细菌群落与施用腐熟枝条处理组(B1、B2、B3)细菌群落明显分布在不同象限,A1和B1显著分离(图4-a),A2和B2显著分离(图4-b),A3和B3显著分离(图4-c),说明施用未腐熟枝条处理组与施用腐熟枝条处理组土壤的细菌群落数量差异明显。从各处理的细菌群落分布来看,CK细菌的群落其他处理有较大差异,B2处理细菌的群落聚集在一起,分布在第三坐标轴,含有较高的第一主成分,结果表明,施用腐熟枝条和蚯蚓粪+200倍菌剂处理能显著改变土壤中细菌的群落组成。
2.4 不同施肥处理土壤理化性质与细菌多样的相关性
由图5可知,第一排序轴和第二排序轴分别解释细菌群落变化的19.47%和16.96%,两个轴总共解释36.43%。优势细菌群落的相对丰度主要与土壤中AK、TP、AN、OM含量显著相关 "(P<0.05),其中AK、AN、OM含量与土壤中放线菌门、拟杆菌门的相对丰度正相关,与酸杆菌门、疣微菌门、绿弯菌门的相对丰度负相关。相反,TP与厚壁菌门、酸杆菌门、疣微菌门、绿弯菌门的相对丰度正相关。
土壤中AK、AN、TP、OM的积累会提高土壤细菌群落的丰富度。
2.5 不同施肥处理对根际微生物群落结构的影响
使用LEfSe分析不同处理根际土壤细菌群落中主要差异物种(P<0.05,LDA>3)。由图6可知,在门水平上,酸杆菌门(Acidobacteriota)、放线菌门(Actinobacteria)的相对丰度分别在A2、B3处理中显著增加;在纲水平上,Polyangia、邻里菌纲(Vicinamibacteria)、念珠菌纲(Saccharimonadia)相对丰度分别在CK、A3、B2处理中显著增加;在目水平上,嗜热厌氧杆菌目(Thermoanaerobaculales)、芽单胞菌目(Gemmatimonadales)、丙酸杆菌目(Saccharimonadales)、微球菌目(Micrococcales)的相对丰度分别在A1、A2、B2、B3处理中显著增加;在科水平上,嗜热厌氧杆菌科(Thermoanaerobaculaceae)、芽单胞菌科(Gemmatimonadaceae)的相对丰度分别在A1、A2处理中显著增加;在属水平上,嗜热厌氧菌属(Thermoanaerobaculales)、拟杆菌属(Bacteroidales)的相对丰度分别在A1、B1处理中显著增加。
2.6 土壤理化性质与土壤细菌群落Pearson相关性分析
通过Pearson相关性分析不同处理下环境因子与细菌群落的相关性,得到两者之间的相关性系数。如表4所示:pH与全磷与厚壁菌门活性呈正显著相关,EC值与全氮厚壁菌门呈负显著相关,速效钾与疣微菌门活性呈负显著相关,全氮与放线菌门、拟杆菌门呈正显著相关,各处理土壤速效钾、碱解氮、全氮、全磷、pH和EC值是影响土壤细菌微生物种丰富度及细菌优势菌群的土壤养分因子。
3 讨" 论
3.1 土壤理化性质对不同施肥处理的响应
研究表明,长时间施用无机肥会造成土壤pH下降,从而造成土壤酸化。用有机肥代替无机肥,能够提高深层土壤的养分,缓解由于单一施用无机肥而造成的土壤酸化趋势,使土壤pH处于持续稳定状态[15]。李磊等[16]研究发现,在以有机肥代替化肥的情况下,土壤pH与全盐含量较常规施肥有所降低,土壤有机质则显著提高。对盐碱土壤的改良和利用具有很好的效果。于丹丹等[17]研究发现施用园林废弃腐熟物+生物有机肥,土壤营养水平明显提升,特别是全氮和有机质含量,这与本研究中施用腐熟枝条和蚯蚓粪处理结果一致。另外,与对照相比,微生物菌剂的添加显著提高土壤有效磷、碱解氮、速效钾和有机质含量,与万水霞等[18]研究结果一致。
本试验结果表明,加入有机肥结合微生物菌剂能够改善酸化的土壤,土壤有机质含量和土壤碱解氮水平得以提高,为葡萄树体生长提供良好的生长环境,因此,在一定程度上可以减轻由于施用肥料而引起的土壤理化性质的变化,以及土壤营养元素的损失。
3.2 土壤细菌群落结构及多样性对不同施肥处理的响应
已有研究表明,施入无机肥料降低了细菌的多样性和丰度,而施用有机肥料增加了土壤微生物群落的生物多样性[19-20]。此外,优良的微生物菌剂可以用作外源功能微生物,从而改变土壤中原有的微生物群落的组成以及优势种群的数量[21-22]。通过高通量测序研究‘赤霞珠’葡萄根际的细菌群落组成和多样性,在本研究中发现,施用微生物菌剂对根际土壤菌群OTU数量增加有明显的促进作用,这与杨楠等[23]研究结果一致。同时,土壤菌群观测物种数明显增加,A1、B2处理Shannon指数降低,B2处理Chao 1也显著降低,其他处理均显著提高。另外,菌剂施用量也会影响细菌群落多样性,本试验中施用300倍微生物菌剂的细菌群落多样性低于施用200倍微生物菌剂的细菌群落多样性,这可能是由于过量施用微生物菌剂出现抑制的效果,这与李金花等[24]的研究结果一致。
研究发现,变形菌门、放线菌门、厚壁菌门在有机物质的矿化和养分的循环过程中起到了关键作用[25]。在本研究中,所有处理土壤的优势细菌门是变形菌门、放线菌门、拟杆菌门、厚壁菌门,与以往的研究结果一致[26-27]。在本研究中,变形菌门是优势菌群,它们偏好于富营养化的环境,拟杆菌门在本研究中也是优势种,这一点与之前的研究十分相似[28],也就是细菌在空间上分布主要由养分所驱动[29]。微生物菌剂由于其自身所含的有机质和养分含量较高,能促进植物根系的分泌物增多,施用微生物菌剂既能为土壤中的微生物提供更多的碳源,又能促进土壤中益生菌的增殖。杨芳等[30]施用10 mL/株的稀释光合细菌菌剂,定植60 d后,B1处理的细菌数明显高于对照,B2和B3处理的放线菌数也明显增加。这表明菌液中的光合细菌在土壤中一段时间后,可以适应土壤环境,并进行良好的生长繁殖,也有可能是菌液中的光合细菌对土壤中其他细菌的增加起到了促进作用。这一点与本研究是一致的。另外,本研究中施用不同腐熟程度的有机肥处理(腐熟和未腐熟)施用不同比例的菌剂(100、200和300倍)提高了放线菌门、拟杆菌门的占比,整体来看腐熟枝条组>未腐熟枝条组:B3>B2>B1,A3>A2>A1。
3.3 土壤细菌群落与环境因子的关系
土壤理化性质与细菌群落结构密切相关[31-33]。基于对土壤理化性质和土壤细菌群落(门水平)进行的RDA分析,细菌群落组成的影响因子排序是AK>AN>TP>OM>TN> "EC>pH>AP。丰度排名前三的菌门相对丰度均与AK含量呈正相关,其中放线菌门受AK含量影响最大。丰度值最高的变形菌门的相对丰度和AK、TN、EC、AP含量呈正相关,与pH呈负相关,其中受AK含量的影响最大。其次相对丰度值排名第二的放线菌门和第三的拟杆菌门的相对丰度和AK、AN、TP、OM含量呈正相关,与pH值呈负相关。在本研究中,AK、AN、TP、OM是土壤细菌群落结构改变的主要驱动因子,与田夏琼[34-35]的研究结果一致,而与韦月平等[36]、刘婷如等[37]、褚德朋等[38]的研究中,不同施肥处理会提高土壤pH影响细菌群落结构,这一结果与本研究不一致。本研究中,Pearson相关性分析结果表明,pH和全磷与厚壁菌门活性呈正显著相关,全氮与放线菌门、拟杆菌门呈正显著相关,而EC值和全氮与厚壁菌门呈负显著相关。
4 结" 论
施用一定比例的有机肥结合微生物菌剂有效改善土壤理化性状,其中B2(蚯蚓粪+腐熟枝条+200倍光合细菌菌剂)的效果最好,其次为A2(蚯蚓粪+未腐熟枝条+200倍光合细菌菌剂),使赤霞珠葡萄园根际土壤pH降低,提高了土壤有机质、EC、碱解氮、全氮含量。在生产实践中,适当的菌剂剂量既能保证作物的正常生长,又能降低生产成本,为科学使用微生物菌剂提供了理论依据。
在土壤优势细菌群落门水平下,B2(蚯蚓 "粪+腐熟枝条+200倍光合细菌菌剂)中放线菌门和变形菌门的相对丰度增加,厚壁菌门的相对丰度下降,另外发现拟杆菌门在本研究中也是优势门。
通过冗余分析,本试验发现速效钾、碱解氮、全磷、有机质含量是影响‘赤霞珠’葡萄园土壤微生物群落结构变化的主要环境因子。
综上所述,在本研究中在宁夏贺兰山东麓地区种植‘赤霞珠’葡萄,B2蚯蚓粪+腐熟枝条+200倍光合细菌菌剂更有利于改善根际土壤理化性质和土壤微生物环境,其次为A2(蚯蚓粪+未腐熟枝条+200倍光合细菌菌剂),是最佳的配施方案。
参考文献 Reference:
[1] WEN C,LIU S,LI Q,et al.Diversity analysis of vineyards soil bacterial community in different planting years at eastern foot of Helan Mountain,Ningxia[J].Rhizosphere,2023,25:100650.
[2]冉文婷.两种肥料对土壤特性和赤霞珠葡萄品质的影响[D].银川:宁夏大学,2016.
RAN W T.Two kinds of" fertilizer on soil characteristics and the influence of cabernet sauvignon grape quality [D].Yinchuan:Ningxia University,2016.
[3]施 明,司海丽,朱 英,等.钙镁硫肥对贺兰山东麓酿酒葡萄的影响[J].湖北农业科学,2013,52(20):4878-4881,4897.
SHI M,SI H L,ZHU Y,et al.The calcium magnesium sulphur of helan mountain foothill grape influence [J].Journal of Hubei Agricultural Science, 2013,52(20):4878-4881,4897.
[4]陈思婷,刘子凡,董志国,等.有机肥与微生物菌剂配施对椰园土壤微生态的影响[J].热带农业科学,2021,41(6):62-66.
CHEN S" T,LIU Z F,DONG ZH G,et al.Effects of combined application of organic" fertilizer and microbial agent on soil microecology of coconut garden [J].Scientia Tropica Agricultura,2021,41(6):62-66.
[5]LUO J,LIAO G,BANERJEE S,et al.Long-term organic fertilization promotes the resilience of soil multifunctionality driven by bacterial communities[J].Soil Biology and Biochemistry,2022:108922.
[6]DELGADO-BAQUERIZO M,OLIVERIO A M,BREWER T E,et al. A global atlas of the dominant bacteria found in soil[J].Science,2018,359(6373):320-325.
[7]ASERI G K,JAIN N,PANWAR J,et al.Bio fertilizers improve plant growth,fruit yield,nutrition,metabolism and rhizosphere enzyme activities of pomegranate(Punica granatum L.) in" indian thar desert[J].Scientia Horticulturae,2008,117(2):130-135.
[8]TAO C,LI R,XIONG W,et al.Bio-organic" fertilizers stimulate indigenous soil Pseudomonas populations to enhance plant disease suppression[J].Microbiome,2020,8(1):1-14.
[9]刘 璐,代红军,王振平.微生物肥料对“赤霞珠”葡萄生长及土壤质量的影响[J].北方园艺,2016(17):175-179.
LIU L,DAN H J,WANG ZH" P.Microbial" fertilizer on" “Cabernet sauvignon”" grapes and soil quality [J].Northern Horticulture,2016(17):175-179.[ZK)]
[10] WANG J C,ZHU R S,LIU X H,et al.Effects of microbial agents on bacterial community composition during swine manure composting[J].The Journal of Applied Ecology,2020,31(7):2449-2456.
[11]陈 倬,冯海萍,程彦弟,等.不同茬口对娃娃菜根际土壤养分和真菌群落的影响[J].中国土壤与肥料,2022(7):141-152.
CHEN ZH,FENG H P,CHENG Y D,et al.Different stubbles on doll edible orange roots in the soil nutrient and the impact of fungal community [J].Journal of Soil and" fertilizer in China,2022(7):141-152.
[12]鲍士旦.土壤农化分析[M].第三版.北京:中国农业出版社,2013:72-75.
BAO SH D.Soil Agricultural Chemistry Analysis[M].Third Version.Beijing:China Agriculture Press,2013:72-75.
[13]黄晨轩,岳巧娴,徐 静,等.复合微生态制剂对产蛋后期蛋鸡养分消化率、免疫功能和肠道菌群的影响[J].中国家禽,2018,40(6):24-28.
HUANG CH X,YUE Q X,XU J,et al The compound probiotics for egg laying hens late nutrient digestibility,immune function and the influence of intestinal flora [J].Chinese Poultry,2018,40(6):24-28.
[14]陈泽斌,李 冰,王定康,等.应用Illumina MiSeq高通量测序技术分析玉米内生细菌多样性[J].现代食品科技,2016,32(2):113-120.
CHEN Z B,LI" B,WANG D K,et al.Application of Illumina MiSeq high-throughput sequencing technology analysis of corn multiple sample endophytic bacteria [J].Journal of Modern Food Science and Technology,2016,32(2):113-120.
[15]刘杏兰,高 宗,刘存寿,等.有机—无机肥配施的增产效应及对土壤肥力影响的定位研究[J].土壤学报,1996, "33(2):138-147.
LIU X L,GAO Z,LIU C SH,et al.The organic - inorganic" fertilizer production increase effect and on a study of the impact of soil fertility [J].Journal of Soil,1996,33(2):138-147.
[16]李 磊,司海丽,朱志明,等.有机肥氮替代化肥氮对盐碱地玉米氮素利用率及土壤理化指标的影响[J].西北农业学报,2023,32(7):1068-1077.
LI L,SI H L,ZHU ZH M,et al.Effect of substitute of chemical" fertilizer N with organic manure N on N utilization efficiency in maize and soil physicochemical indexes in saline-alkali land [J].Acta Agriculturae Boreali-occidentalis Sinica,2023,32(7):1068-1077.
[17]于丹丹,贾黎明,李 宇,等.土壤改良剂对废弃砂石坑造林地土壤性质和银杏生理特性的影响[J].东北林业大学学报,2015(9):56-61.
YU D D,JIA L M,LI" Y,et al.Soil conditioner planting area of waste sand pit soil properties and the effects of ginkgo physiological characteristics [J].Journal of Northeast Forestry University,2015(9):56-61.
[18]万水霞,李 帆,王 静,等.微生物菌剂对青梗菜土壤理化性质及生长的影响[J].安徽农业科学,2022,50(24):160-162.
WAN SH X,LI F,WANG J,et al.Microbial agents for green stem vegetables soil physical and chemical properties and the influence of growth [J].Journal of Anhui Agricultural Science,2022,50(24):160-162.
[19]ZHOU J,GUAN D,ZHOU B,et al.Influence of 34-years of fertilization on bacterial communities in an intensively cultivated black soil in northeast China[J].Soil Biology and Biochemistry,2015,90:42-51.
[20]DING J,JIANG X,MA" M,et al.Effect of 35 years inorganic" fertilizer and manure amendment on structure of bacterial and archaeal communities in black soil of northeast China[J].Applied Soil Ecology,2016,105:187-195.
[21]王 辉,刘 丽,黄宇飞,等.黄柄曲霉ASD对辣椒疫病根际真菌菌群结构及土壤功能的影响[J].中国生物防治学报,2021,37(4):796-803.
WANG H,LIU L,HUANG Y F,et al.Yellow aspergillus handle ASD on capsicum rhizosphere fungi flora of disease structure and function of soil [J].Chinese Journal of Biological Control,2021,37(4):796-803.
[22]RIME D,NAZARET S,GOURBIRE F,et al.Comparison of sandy soils suppressive or conducive to ectoparasitic nematode damage on sugarcane[J].Phytopathology,2003,93(11):1437-1444.
[23]杨 楠,谭雪莲,郭天文,等.施加微生物菌剂对马铃薯根际土壤细菌多样性的影响[J].西北农业学报,2023, "32(5):781-790.
YANG N,TAN X L,GUO T W,et al.Effect of microbial agents on bacterial diversity in potato rhizosphere soil[J].Acta Agriculturae Boreali-occidentalis Sinica,2023, "32(5):781-790.
[24]李金花,高克祥,万 利,等.微生物菌剂对楸树幼苗生长及根际土细菌群落结构的影响[J].生态学报,2020," "40(21):7588-7601.
LI J H,GAO K X,WAN" L,et al.Microbial agents to the Chinese catalpa tree seedlings and the effects of rhizosphere soil bacterial community structure [J].Acta Ecologica Sinica,2020,40(21):7588-7601.
[25]DE CARVALHO T,JESUS E,BARLOW J,et al.Land use intensification in the humid tropics increased both alpha and beta diversity of soil bacteria[J].Ecology,2016,97(10):1-12.
[26]WANG J C,ZHU R S,LIU X H,et al.Effects of microbial agents on bacterial community composition during swine manure composting[J].The Journal of Applied Ecology,2020,31(7):2449-2456.
[27]DING J,JIANG X,MA M,et al.Effect of 35 years inorganic" fertilizer and manure amendment on structure of bacterial and archaeal communities in black soil of northeast China[J].Applied Soil Ecology,2016,105:187-195.
[28]曹云娥,尹 翠,吴泽帅,等.蚯蚓原位堆肥提升番茄连作土壤质量研究[J].植物营养与肥料学报,2022,28(2):247-259.
CAO Y E,YIN C,WU Z SH,et al.To improving the quality of tomato continuous cropping soil composting of earthworms in situ [J].Journal of Plant Nutrition and" fertilizer,2022,28(2):247-259.
[29]JANKOWSKI K,SCHINDLER D,HORNER-DEVINE C.Resource availability and spatial heterogeneity control bacterial community response to nutrient enrichment in lakes[J].Public Library of Science,2014,9:e86991.
[30]杨 芳,田俊岭,杨盼盼,等.高效光合细菌菌剂对番茄品质、土壤肥力及微生物特性的影响[J].华南农业大学学报,2014,35(1):49-54.
YANG F,TIAN J L,YANG P P,et al.High photosynthetic bacteria inoculants on tomato quality,the influence of the fertility of soil and microbial characteristics [J].Journal of South China Agricultural University,2014, "35(1):49-54.
[31]XUN W,HUANG T,ZHAO J,et al.Environmental conditions rather than microbial inoculum composition determine the bacterial composition,microbial biomass and enzymatic activity of reconstructed soil microbial communities[J].Soil Biology and Biochemistry,2015,90:10-18.
[32]FIERER N,SCHIMEL J P,HOLDEN P A.Variations in microbial community composition through two soil depth profiles[J].Soil Biology and Biochemistry,2003,35(1):167-176.
[33]WANG Y,LONG Y,LI Y,et al.Relationships of soil physicochemical properties to the distribution and the composition of microbial community under Populus euphratica’s crown[J].Acta Ecologica Sinica,2021,41:5669-5684.
[34]田夏琼,关统伟,王淑英,等.短期内有机肥增施对高原土壤养分和细菌群落的影响[J].西南农业学报,2022, "35(4):924-931.
TIAN X Q,GUAN T W,WANG SH Y,et al.In the short term,organic" fertilizer increased the influence of soil nutrient and bacteria on the plateau [J].Journal of Southwest Agricultural,2022,35(4):924-931.
[35]张凯煜,谷 洁,王小娟,等.生物有机肥对核桃园土壤细菌群落结构的影响[J].干旱地区农业研究,2019,37(6):178-183.
ZHANG K Y,GU J,WANG X J,et al.Biological organic" fertilizer on walnut orchard soil bacterial community structure [J].Journal of Arid Region Agricultural Research,2019,37(6):178-183.
[36]韦月平,丛培东,曲贵伟,等.生物有机肥稻田不同生长时期根际土壤细菌群落动态变化[J].江苏农业科学,2022,50(6):181-185.
WEI Y P,CONG P D,QU G W,et al.Different biological organic" fertilizer rice rhizosphere bacteria growth period dynamic changes [J].Journal of Jiangsu Agricultural Science,2022,50(6):181-185.
[37]刘婷如,郑晗玉,张 伟,等.有机肥不同用量对花生土壤田间微环境及产量的影响[J].南方农业,2018,12(24):5-7.
LIU T R,ZHENG H Y,ZHANG W,et al.Different dosage of organic" fertilizer on peanut soil field environment and yield [J].Journal of Southern Agriculture,2018, "12(24):5-7.
[38]褚德朋,陈芊如,邰振益,等.大豆与海藻有机肥对烤烟生长和土壤细菌群落的影响[J].中国烟草学报,2021, "27(6):43-51.
CHU D P,CHEN Q R,TAI ZH Y,et al.for example,soybeans with seaweed" fertilizer on flue-cured tobacco growth and the influence of the soil bacterial community [J].Journal of China Tobacco,2021,27(6):43-51.
Effect of Organic" fertilizer and Microbial Agent Formulation
on Inter-root Soil" Bacterial Community Diversity in
‘Cabernet Sauvignon’""" Grapes
Abstract To investigate the effects of organic" fertilizers and microbial inoculants on the rhizosphere soil properties and bacterial communities of" ‘Cabernet Sauvignon’ grapes, and to propose an efficient and practical model for the application of organic" fertilizers, a field experiment was conducted with seven-year-old ‘Cabernet Sauvignon’ grapes.The experiment included seven treatments:CK (traditional fertilization), A1 (vermicompost + undecayed branches + 100×photosynthetic bacterial inoculants), A2 (vermicompost + undecayed branches + 200×photosynthetic bacterial inoculants), A3 (vermicompost + undecayed branches + 300× photosynthetic bacterial inoculants), B1 (vermicompost + decayed branches + 100×photosynthetic bacterial inoculants), B2 (vermicompost + decayed branches + 200×photosynthetic bacterial inoculants), and B3 (vermicompost + decayed branches + 300×photosynthetic bacterial inoculants).Compared with CK treatment, B2 treatment significantly decreased soil pH and increased soil organic matter, alkaline dissolved nitrogen, available potassium and total nitrogen contents.A2 treatment significantly increased Chao1 for 87.60% and had the highest number of OTUs, indicating that A2 treatment significantly increased the richness of rhizosphere bacterial community.Compared with CK, B2 treatment altered the rhizosphere soil bacterial community, and significantly increased the relative abundance of Proteobacteria, Actinobacteria, Bacteroidota, and decreased the relative abundance of Firmicutes.Compared with A2 treatment, B2 treatment significantly increased the relative abundance of Bacteroidota.The correlation analysis showed that there was a significant positive correlation between available potassium, alkaline-dissolved nitrogen, total nitrogen, organic matter and the dominant bacterial communities in the rhizosphere soil.Therefore, the B2 treatment is the optimal fertilization, followed by the A2 treatment.
Key words Vermicompost; Microbial inoculants; Vineyard rhizosphere soil; Soil nutrients; Bacterial community

