桃CHX基因家族响应激素及非生物胁迫分析








摘 要 阳离子质子转运体(cation/H+ exchanger,CHX)基因家族在植物生长发育及逆境中发挥着重要功能。本研究对桃CHX基因家族进行鉴定,并分析其在非生物胁迫和激素中的表达模式。以拟南芥CHX成员为模型,在桃基因组数据库中进行BLASTP算法搜索初步比对出桃CHX家族成员,并利用在线工具Pfam和SMART进一步筛选。最终在桃中鉴定到26个CHX家族成员,分布在6条染色体上;系统进化分析将桃CHX家族基因划分为8个亚族,每个亚族的基因结构和Motif基本一致;共线性分析发现,种内中仅有1对线性关系;种间(桃与拟南芥)存在12对基因对。qRT-PCR表明,PpCHX基因家族成员在桃不同组织中的表达存在差异。此外, PpCHX02、 PpCHX03、 PpCHX05、 PpCHX06、 PpCHX13、 PpCHX14、 PpCHX15、 PpCHX16、 PpCHX18、 PpCHX20、 PpCHX22、 PpCHX25均显著受200 mmol·L-1 NaCl、干旱(15% PEG)与低温(4 ℃)的诱导; PpCHX02、 PpCHX03、 PpCHX06、 PpCHX13在赤霉素、水杨酸与脱落酸处理下均表现出高的表达水平。
关键词 桃;阳离子质子转运体;生物信息学;功能分析
植物生长发育过程中会吸收大量的矿物质,同时植物从土壤中获取必需的矿物质营养并在植物组织和细胞中运输,具有广泛的机制和反应。在过度施肥措施下或不同栽培区域会出现较高浓度的必需金属阳离子的聚集,造成胁迫作用。因此,研究如何调节植物组织和细胞中离子的浓度水平,以防止营养素缺乏和金属毒性[1],对现代产业化生产意义重大。
研究发现,有大量的阳离子转运蛋白定位在细胞质膜和细胞膜上[2-3]。阳离子/质子反转运蛋白(CPA)基因超家族的成员被认为负责植物、动物、真菌和细菌中的单价阳离子交换[4]。CPA超家族包括植物基因组中的Na+/H+逆转运蛋白(NHX)、K+/H+逆转运蛋白(KEA)和阳离子质子转运体(CHX)家族,在Pfam数据库中有1个保守的Na+/H+交换(Na+/H+ exchanger)结构域[5-6]。而CHX家族众多成员仅存在于高等植物中,其主要参与调控植物体内Na+/K+离子平衡和pH稳态[7]。目前,有学者认为CHX家族基因广泛参与植物对激素响应以及盐、干旱等非生物胁迫[8-9],且在拟南芥[3]、大豆[7]、葡萄[10]、水稻[11]和玉米[12]等多种植物中对其功能进行解析。研究发现在模式植物拟南芥中鉴定出28个CHX成员,在K+转运、pH平衡及花粉生长发育等方面发挥重要作用。 AtCHX17作为K+转换器在植物前体液泡腔内维持其体内K+平衡,且受低pH、盐胁迫及ABA胁迫诱导,在植物体内起K+摄取及维持细胞中离子平衡的功能[13-14]。 AtCHX16、 AtCHX17、 AtCHX18、 AtCHX19在花粉、花和根中高表达,对种子发育同样起重要作用。 AtCHX20在保卫细胞中高表达,调节气孔开合和保卫细胞内的pH浓度[15-17]。此外,杨琳等[18]在苹果中鉴定出33个CHX家族成员,超过60%的CHX基因成员在根中表达较高,暗示CHX家族对K+吸收方面起重要作用。
植物CHX基因家族参与调控转运细胞质子和离子,在生长发育和胁迫应答中扮演重要角色。而桃CHX基因家族尚未鉴定,功能尚未解析。本研究通过生物信息学和试验相结合的方法初步确定CHX家族在桃中的功能,为桃CHX基因功能的深入研究奠定重要基础,并为挖掘桃抗性基因提供理论支撑。
1 材料与方法
1.1 试验材料及处理
试验材料为种植于甘肃省农业科学院桃园的 "8 a生桃无性系砧木‘GF677’和培养于甘肃省农业科学院组培室中生长30 d的桃无性系砧木‘GF677’组培幼苗。在8 a生桃无性系砧木上分别取根、茎、叶后,将各组织迅速于液氮中冷冻,然后放置到-80 ℃超低温冰箱贮藏,后续用于基因组织特异性表达分析。选取生长大小一致、无病毒的健康组培苗,每处理5株,3个生物学重复。试验共设6种处理,分别用200 mmol·L-1 NaCl、15% PEG浇灌根系、4 ℃低温处理‘GF677’幼苗;激素处理中,用0.1 mmol·L-1脱落酸(ABA)、0.5 mmol·L-1 赤霉素(GA3)、 "5 mmol·L-1水杨酸(SA)喷施叶面,直至叶面滴水为止,各处理分别在0、12和48 h时取样,用于响应非生物胁迫以及激素分析。
1.2 PpCHX基因家族成员的鉴定及染色体 "定位
从拟南芥基因组数据库(http://www.arabidopsis.org/)下载得到已知的28个CHX基因家族的蛋白序列,然后在蔷薇科基因组数据库中(https://www.rosaceae.org/)[Prunus persica Whole Genome Assembly v2.0amp;Annotation" "v2.1(v2.0.a1)]进行BLASTP算法搜索,获得桃CHX候选基因,E值≤1×e-5。删除所有冗余序列后,将得到的候选基因进一步用Pfam (https://pfam.xfam.org/search)和SMART (http://smart.embl-heidelberg.de/)软件进行筛选,去除其中不含CHX特定结构域的基因,最终获得26个桃CHX家族成员。利用在线软件Expasy (https://web.expasy.org/protparam/) 对桃CHX的分子质量、氨基酸数目和等电点等理化性质进行分析;亚细胞定位预测采用WoLFPSORT (https://wolfpsort.hgc.jp/)和CELLO v.2.5 (http://cello.life.nctu.edu.tw/) 在线网站取交集。利用Expasy软件绘制桃CHX基因家族在染色体上的分布图。
1.3 PpCHX基因家族成员的系统进化分析
桃中鉴定的CHX和拟南芥中鉴定的28个CHX[3]的全长氨基酸序列用于系统发育分析。使用MEGA11软件构建邻接树。
1.4 PpCHX基因家族的基因结构和保守基序 "分析
通过MEME (http://meme-suite.org/tools/meme)预测PpCHX蛋白保守基序,将桃CHX基因家族成员的编码序列(coding sequence,CDS)与外显子-内含子结构通过TBtools软件可视化。
1.5 PpCHX基因家族成员的基因复制类型及共线性分析
利用MCScan X[19]软件分析桃CHX与拟南芥、水稻与玉米之间的片段重复事件和同源性。可视化图用Circos[20]软件绘制。
1.6 PpCHX基因家族的启动子顺式元件分析
利用在线网站PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[21]对桃CHX基因上游启动子区2 000 bp序列进行分析,并将结果用TBtools软件可视化。
1.7 PpCHX基因的qRT-PCR表达分析
CHX家族基因特异性引物序列在上海生工生物工程技术服务有限公司设计并合成(表1)。使用Prime Script RT试剂盒(TaKaRa),并按照说明反转录cDNA。以Action蛋白为内参基因进行实时荧光定量PCR。反应体系:TB GreenⅡ 10 μL,上下游2 μL混合引物,ddH2O 6 μL, "cDNA 2 μL,总体积20 μL。程序如下:95 ℃变性 "30 s,95 ℃变性10 s;60 ℃退火30 s,72℃延长 "30 s,共40个循环。
1.8 数据分析
用Microsoft Office 2021进行数据处理,基因的相对表达量采用2-ΔΔCt法计算;柱状图的绘制使用Excel 2016软件,热图采用tbtools可 "视化。
2 结果与分析
2.1 PpCHX的鉴定、染色体定位及化学性质 "分析
基于28个拟南芥CHX蛋白的氨基酸序列,在Phytozome在线网站进行BLASTP同源比对,对得到蛋白去除冗余序列后共有26个桃CHX蛋白序列。根据染色体的位置依次命名为 "PpCHX01~ "PpCHX26,桃CHX基因不均匀地分布在6条染色体上(图1-A),其中2和6号染色体上均包含8个PpCHX基因,数量为最多,而3号染色体PpCHX基因数量最少,仅1个,为 "PpCHX11(图1-B)。此外,多数基因位于染色体的近端或末端,高密度的PpCHX基因分布在第2号染色体的近端和末端,4号染色体的末端跟6号染色体的近端。蛋白质化学性质分析(表2),发现CHX蛋白的CDS长度介于2 289~ "2 577 bp,编码氨基酸数在762~858 aa,分子质量介于83 779.76~94 457.09 ku,且 PpCHX13是编码序列最长、氨基酸残基数目最多、分子质量最大的成员。等电点分布在5.54~9.26,其中酸性蛋白和碱性蛋白各13个。亚细胞定位预测发现,所有的PpCHX蛋白均定位在细胞质膜上。
2.2 PpCHX的系统进化树分析
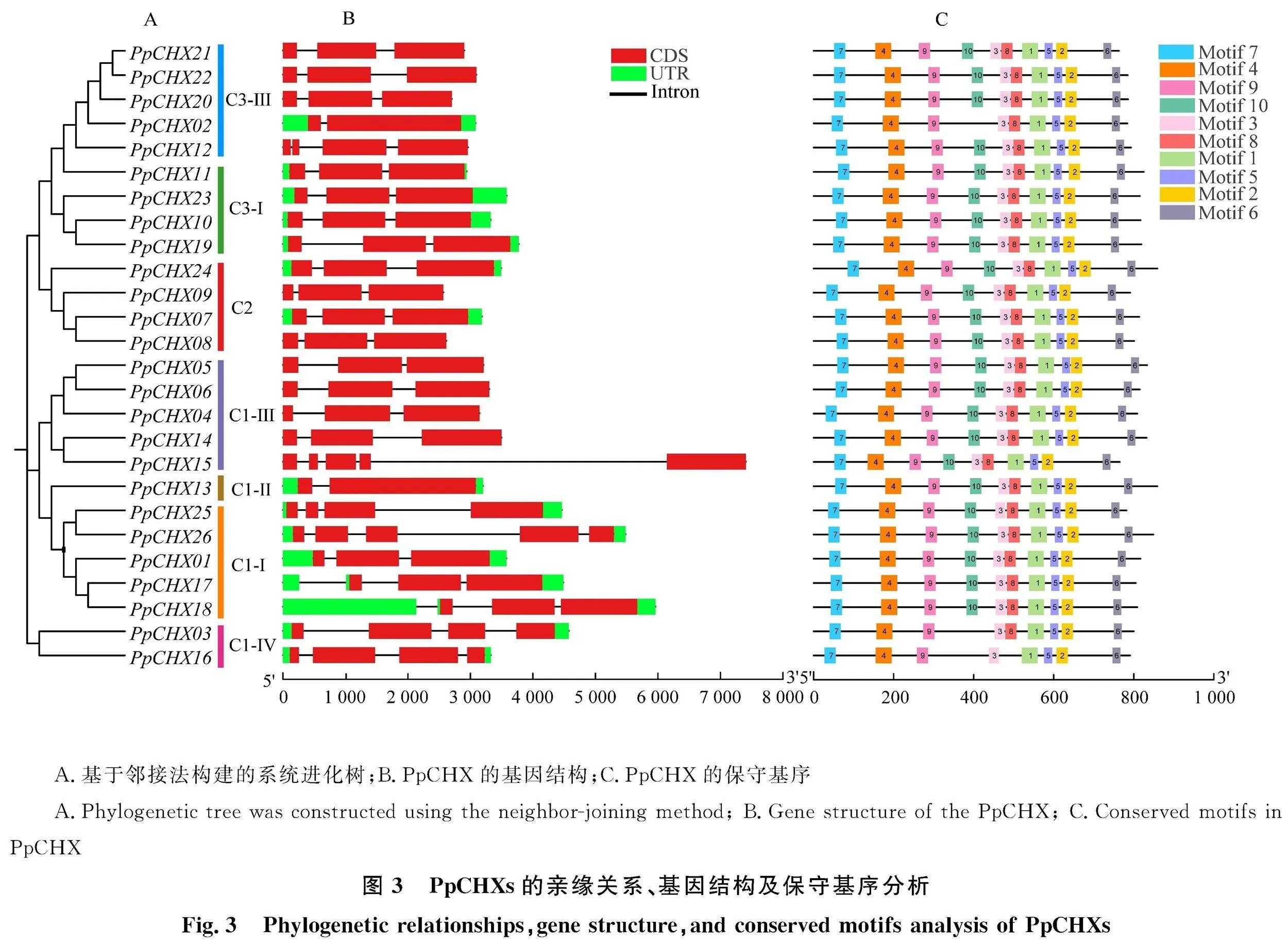
通过分析CHX蛋白间的进化关系,对鉴定得到的26个桃CHX家族成员和28个拟南芥CHX家族成员通过MEGA11软件进行多序列比对和构建系统进化树(图2)。根据亲缘关系的远近,将所有CHX蛋白分成3组(group Ⅰ- group Ⅲ),进一步细化可分成8个亚组(C1-Ⅰ、C1-Ⅱ、C1-Ⅲ、C1-Ⅳ、C2、C3-Ⅰ、C3-Ⅱ、C3-Ⅲ)。其中group Ⅰ中成员最多,有13个PpCHX和11个AtCHX基因,其次是group Ⅲ,包含9个PpCHX和15个AtCHX基因,group Ⅱ成员最少仅有7个,包括4个PpCHX和2个AtCHX。同亚族的成员可能具有相似的功能,根据拟南芥中相似基因的研究结果可推测出桃CHX基因的生物学功能。
2.3 PpCHX家族基因结构及保守基序
为深入了解PpCHX基因结构,利用TBtools软件对PpCHX基因结构进行可视化,发现PpCHX与AtCHX基因进化关系分类一致(图2,图3-A)。通过对内含子和外显子结构分析(图3-B),发现26个PpCHX基因均含有内含子和外显子,含有3个外显子的基因高达18个(69.23%),含2个外显子的基因包含2个 "(7.69%),含4个及以上外显子的基因有6个 "(23.08%)。其中除了2个基因含有1个外显子外,其余24个基因均含有2个及2个以上外显子。各组中内含子和外显子数目及分布方式相似,说明同一亚族不同基因之间基因亲缘关系较近。利用MEME在线工具分析26个PpCHX的基序分布,鉴定出10个保守基序(图3-C)。发现除 PpCHX02、 PpCHX03和 PpCHX16没有Motif 10外,其余23个成员都含有相同的Motif和排列顺序,这说明相似的保守基序含有相似的功能。
2.4 PpCHX家族基因共线性分析
对桃中的CHX家族基因进行共线性分析,发现仅有1对桃CHX家族基因( PpCHX10/ PpCHX19)存在线性关系(图4-A)。对桃和拟南芥2个物种的直系同源基因进行比对分析(图4-B),发现桃与拟南芥之间在基因组水平具有更多的同源基因,即存在12对共线性基因对。表明桃和拟南芥的CHX基因家族具有相对近的同源进化关系,同源基因可能具有相似的功能,因此全基因组共线性分析可为关键基因功能预测提供了 "线索。
2.5 PpCHX家族基因顺式作用元件分析
利用在线网站PlantCARE预测到26个桃CHX基因上游2 000 bp序列,并对PpCHX所有顺式作用元件进行分类和统计。分析发现,PpCHX启动子中含有大量光响应元件、激素应答元件和胁迫响应元件(图5-A)。而 PpCHX25为含有元件最多的成员,其次是 PpCHX13,最少的成员是 PpCHX03,仅含有3个元件,说明PpCHX不同成员之间对响应激素应答和非生物胁迫方面存在较大差异。其中,光响应(G-box、Box 4、I-box、Sp1、AE-box等)作为众多元件中最多的一类元件,占总元件的53%(图5-B),其次为茉莉酸甲酯响应元件(MeJA)。表明家族成员之间存在多种不同的作用元件,可预测它们在植物的生长发育过程中有多种功能。
2.6 不同组织中PpCHX家族基因的表达分析
qRT-PCR分析结果显示(图6),PpCHX家族基因的表达呈现出组织特异性。其中, PpCHX01、 PpCHX03、 PpCHX09、 PpCHX10、 PpCHX13、 PpCHX17、 PpCHX18、 PpCHX20、 PpCHX21、 PpCHX22在根中为高表达。有趣的是,这与图3-A的分组基本呈现一致,即越相似的序列其组织特异表达趋于一致。 PpCHX02、 PpCHX04、 PpCHX12、 PpCHX19、 PpCHX23、 PpCHX24则在茎中高表达; PpCHX05、 PpCHX06、 PpCHX07、 PpCHX08、 PpCHX11、 PpCHX14、 PpCHX15、 PpCHX16、 PpCHX26则在叶中的表达显著高于其他部位。
2.7 非生物胁迫下PpCHX家族基因表达谱
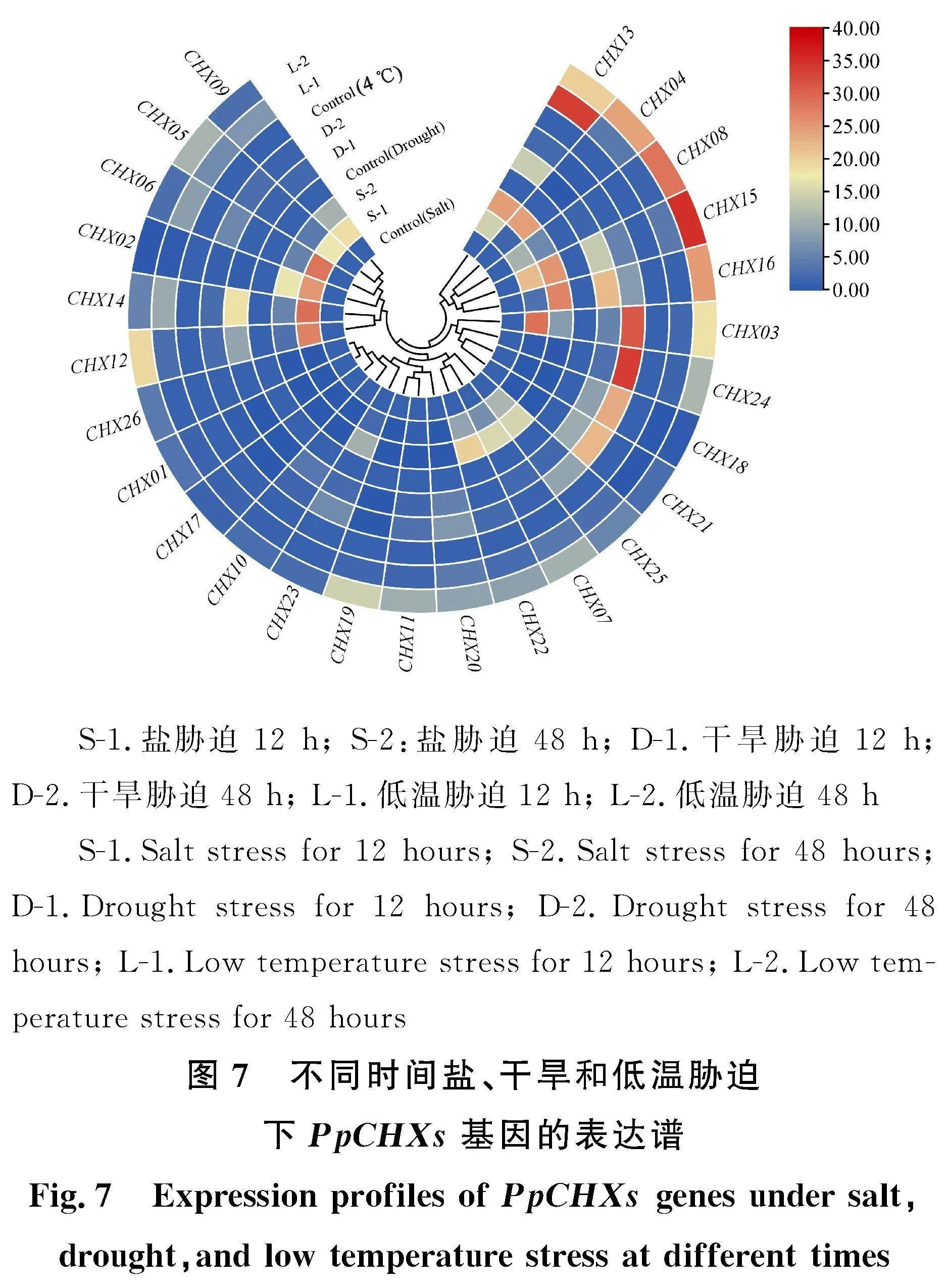
为明确PpCHX基因在非生物胁迫中的作用,利用qRT-PCR分析26个PpCHX家族基因分别在4" ℃、15% PEG以及200 mmol·L-1 NaCl处理下的表达模式(图7)。结果发现,NaCl胁迫下, PpCHX02、 PpCHX03、 PpCHX05、 PpCHX06、 PpCHX09、PpCHX12、 PpCHX14、 PpCHX15、 PpCHX16、PpCHX22和 PpCHX23基因均上调表达。其中,PpCHX16、 PpCHX22与 PpCHX23随时间点的推移呈逐渐升高的趋势,48 h时出现峰值,分别为0 h(对照)的27.06倍、20.03倍、10.42倍,说明可能在盐胁迫中起正调控作用。
15%PEG处理下,除 PpCHX02、 PpCHX04、 PpCHX17和 PpCHX19基因下调外,其余22个基因均为上调表达。其中, PpCHX03、 PpCHX18、 PpCHX21和 PpCHX24上调表达最显著,48 h时的表达量分别为0 h的31.28倍、23.35倍、22.40倍、33.89倍。
4" ℃处理下, PpCHX13上调表达最为显著,其处理12 h后表达量为0 h的33.49倍。而 PpCHX02、 PpCHX18和 PpCHX21为下调表达,表达量不到对照的20%,推测其可能在响应低温时起到负调控作用。
2.8 激素诱导下PpCHX家族基因表达谱
利用qRT-PCR分析26个PpCHX家族基因在不同激素下的表达模式(图8)。赤霉素(GA3)处理下,PpCHX04、PpCHX10、PpCHX17、PpCHX19、PpCHX23与 PpCHX26为下调表达,其余基因为上调表达。其中,PpCHX05、PpCHX08与 PpCHX24基因在12 h的表达量最高,分别为0 h的29.27倍、32.71倍与26.41倍。
水杨酸(SA)处理下,PpCHX04、PpCHX10、PpCHX12、PpCHX21与 PpCHX23为下调表达, "PpCHX11变化不显著,其余基因均为显著上调表达。而在上调表达基因中,除 PpCHX17与PpCHX25随时间点呈先升后降外,其余基因呈逐渐升高趋势。PpCHX07上调最显著,在12 h与48 h表达量相比于0 h分别提高21.13倍与31.49倍。
脱落酸(ABA)处理下,仅有3个基因为下调表达,其余均为上调表达。其中PpCHX02、PpCHX08与 PpCHX24表达量变化最多,在 "48 h的变化量相比于0 h分别提高41.71、40.76与 "32.85倍。尤其PpCHX02、PpCHX03、PpCHX06、PpCHX13在3种处理下均表现出高的表达水平,表明可通过不同途径以响应非生物胁迫。
3 讨" 论
阳离子质子转运体CHX家族基因的特征是参与植物的生长、发育和胁迫反应[22]。目前桃阳离子质子转运体家族的研究未见报道。本研究从桃全基因组中鉴定出26个CHX家族基因,其成员比已报道的拟南芥[3](28个)、苜蓿[23](47个)、大豆[7](40个)、苹果[12](33个)均少,但比葡萄[10](19个)、水稻[11](17个)多,表明不同物种的CHX成员数存在差异[24]。系统进化树分析表明,将CHX蛋白可分为8个亚类,每亚类中的PpCHX蛋白极有可能与该亚类中其他物种的CHX蛋白具有相似功能,即聚类关系越近,其功能相似性越大[25]。本研究发现 PpCHX13与 AtCHX15聚为一类,推测 PpCHX13与 AtCHX15之间可能具有类似功能。对桃CHX结构及保守基序分析发现,PpCHX的内含子-外显子、Motif结构相似性较大,且大多数外显子均在3个左右,内含子2个左右,这一结果与其他物种相似[7,10,23],说明该类家族基因在进化上具有保守性。对桃中的CHX家族基因进行重复基因分析,发现桃CHX基因家族仅有1对片段重复基因对,可见片段重复对桃中CHX基因的扩张起着或多或少的作用。并且通过对拟南芥和桃中CHX家族基因的共线性分析,发现桃中有14个CHX基因比较保守,12个桃CHX基因与拟南芥CHX基因存在多种共线性关系,表明不同物种以特异的方式进行了基因扩张,这种现象也普遍出现在其他植物基因家族研究中[26-27]。亚细胞定位分析表明PpCHX基因家族成员均定位于细胞质膜,与拟南芥CHX基因家族定位结果相符。
qRT-PCR表明,PpCHX基因家族成员存在组织特异性,说明其成员也许介导不同生物学过程以响应胁迫。本研究针对PpCHX上游2 000 bp序列中的顺势作用元件分析发现, PpCHX03启动子序列中含有低温响应元件。表达分析揭示,该基因在ABA、GA3与低温处理下显著上调表达。JA[28-29]和ABA[30-31]等激素可以通过提高植物的抗氧化酶活性,来清除自由基,增加渗透调节物质含量来减轻植物受到的胁迫损伤,这说明该基因可能通过调控ABA与GA3信号转导过程响应低温。预测发现 PpCHX13、 PpCHX15启动子区含有大量干旱响应元件。表达分析也出示,该基因在干旱下显著上调,且分别受GA3、SA调控,说明两者可分别介导GA3与SA过程响应干旱胁迫。此外,表达分析表明, PpCHX21受干旱与低温诱导, PpCHX15受盐胁迫诱导,其启动子区也含有防御与胁迫相关元件,进一步证实其在逆境中发挥着关键作用。另有研究证实,拟南芥 AtCHX17[32]在成熟根区表皮和皮质细胞中优先表达,该基因受盐胁迫、缺钾、ABA和外界酸性pH的强烈诱导。聚类分析发现拟南芥 AtCHX17与桃 PpCHX01、 PpCHX17、 PpCHX18、 PpCHX25和 PpCHX26聚为一类,推测这些基因可能具有与 AtCHX17相似的功能。Jia等[33]在大豆中研究发现, GmCHX20a和 GmCHX1可能通过协调作用来解决由于盐度升高而导致的渗透胁迫和离子胁迫,从而发挥来协同作用。本试验中 PpCHX16、 PpCHX22与 PpCHX23在盐(200 mmol·L-1 NaCl)胁迫下表达水平显著升高,说明可能在盐胁迫中起正调控作用。同时发现PEG处理下, PpCHX03、 PpCHX18、 PpCHX21和 PpCHX24显著上调表达最显著。 "4 ℃处理下, PpCHX13上调表达最为显著,推测它们分别在干旱与低温中扮演着重要作用,后期可对其进一步进行功能分析。
本研究基于桃基因组数据库共鉴定出26个PpCHXs基因家族成员,可分为8个亚组,不均匀分布于6条不同染色体上。qRT-PCR结果表明,该基因家族成员参与水杨酸、脱落酸和赤霉素等外源激素的调控以及响应高盐、干旱和低温胁迫,且在不同组织、不同激素、逆境胁迫下,该家族成员表达模式存在差异。
参考文献 Reference:
[1] KONG M,LUO M,LI J,et al.Genome-wide identification,characterization,and expression analysis of the monovalent cation-proton antiporter superfamily in maize,and functional analysis of its role in salt tolerance[J].Genomics,2021,113(4):1940-1951.
[2]ZHANG H,FENG H,ZHANG J W,et al.Emerging crosstalk between two signaling pathways coordinates K+ and Na+ homeostasis in the halophyte Hordeum brevisubulatum[J].Journal of Experimental Botany,2020,71(14):4345-4358.
[3]SZE H,PADMANABAN S,CELLIER F,et al.Expression patterns of a novel AtCHX gene family highlight potential roles in osmotic adjustment and K+ homeostasis in pollen development[J].Plant Physiology,2004,136(1):2532-2547.
[4]WU L,WU M,LIU H L,et al.Identification and characterisation of monovalent cation/proton antiporters (CPAs) in Phyllostachys edulis and the functional analysis of PheNHX2 in Arabidopsis thaliana[J].Plant Physiology and Biochemistry,2021,164:205-221.
[5]SZE H,CHANROJ S.Plant endomembrane dynamics:studies of K+/H+ antiporters provide insights on the effects of pH and ion homeostasis[J].Plant Physiology,2018,177(3):875-895.
[6]ISAVENKON S V,DABRAVOLSKI S A,PAN T,et al.Phylogenetic diversity and physiological roles of plant monovalent cation/H+ antiporters[J].Frontiers in Plant Science,2020,11:573564.
[7]才晓溪,沈 阳,周伍红,等.大豆CHX基因家族全基因组鉴定与生物信息学分析[J].基因组学与应用生物学,2018,37(12):5360-5369.
CAI" X X,SHEN Y,ZHOU W H,et al.Genome-wide identification and bioinformatics analysis of soybean CHX gene family[J].Genomics and Applied Biology,2018,37(12):5360-5369.
[8]NESTRERENKO E O,KRASNOPEROVA O E,ISAYENKOV S V.Potassium transport systems and their role in stress response,plant growth,and development[J].Cytology and Genetics,2021,55:63-79.
[9]JOSHI S,KAUR K,KHARE T,et al.Genome-wide identification,characterization and transcriptional profiling of NHX-type (Na+/H+) antiporters under salinity stress in soybean[J].Biotech,2021,11:1-17.[ZK)]
[10] 杜宜洋,连红娟,李晓梅,等.葡萄CHX基因家族全基因组鉴定及生物信息学分析[J].分子植物育种,2020, 18(24):8009-8021.
DU Y Y,LIAN H J,LI X M,et al.Genome-wide identification and bioinformatics analysis of grapevine CHX gene family[J].Molecular Plant Breeding,2020,18(24):8009-8021.
[11]CHEN Y,MA J,MILLER A J,et al.OsCHX14 is involved in the K+ homeostasis in rice (Oryza sativa) flowers[J].Plant and Cell Physiology,2016,57(7):1530-1543.
[12]贾博为,金 军,庄 齐,等.玉米CHX基因家族全基因组鉴定与表达分析[J].黑龙江八一农垦大学学报,2022, 34(4):23-30,64.
JIA B W,JIN J,ZHUANG" Q,et al.Genome-wide identification and expression" analysis of" maize CHX" family[J].Journal of Heilongjiang Bayi Agricultural University,2022,34(4):23-30,64.
[13]JIA Q,ZHENG C,SUN S,et al.The role of plant cation/proton antiporter gene family in salt tolerance[J].Biologia Plantarum,2018,62(4),617-629.
[14]SONG C P,GUO Y,QIU Q,et al.A probable Na+ (K+)/H+ exchanger on the chloroplast envelope functions in pH homeostasis and chloroplast development in Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences,2004,101(27):10211-10216.
[15]QU Y,GUAN R,BOSE J,et al.Soybean CHX‐type ion transport protein GmSALT3 confers leaf Na+ exclusion via a root derived mechanism,and Cl?傆b exclusion via a shoot derived process[J].Plant,Cell amp; Environment,2021,44(3):856-869.
[16]CHANROJ S,PADMANABAN S,CZERNY D D,et al.K+ Transporter "AtCHX17 with its hydrophilic C tail localizes to membranes of the secretory/endocytic system:role in reproduction and seed set[J].Molecular Plant,2013,6(4):1226-1246.
[17]周苗苗,汤锐恒,台玉莹,等.大豆钾营养及其分子调控机制研究进展[J].中国油料作物学报,2023,45(3):444-453.
ZHOU M M,TANG R H,TAI Y Y,et al.Research progress on potassium nutrient and molecular regulatory mechanism of soybean[J].Chinese Journal of Oil Crop Sciences,2023,45(3):444-453.
[18]杨 琳,董 玲,李明军,等.苹果K+转运蛋白基因家族鉴定及表达分析[J].园艺学报,2016,43(6):1021-1032.
YANG L,DONG L,LI M J,et al.ldentification and expression analysis of potassium transporter gene family in apple[J].Acta Horticulturae Sinica,2016,43(6):1021-1032.
[19]WANG Y P,TANG H B,DEBARRY J D,et al.MCScanX:a toolkit for detection and evolutionary analysis of gene synteny and collinearity[J].Nucleic Acids Research,2012,40(7):e49.
[20]KRZYWINSKI M,SCHEIN J,BIROL I,et al.Circos:an information aesthetic for comparative genomics[J].Genome Research,2009,19(9):1639-1645.
[21]LESCOT M,DHAIS P,THIJS G,et al.PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J].Nucleic Acids Research,2002,30(1):325-327.
[22]JIA B,SUN M,DUANMU H,et al. "GsCHX19.3,a member of cation/H+ exchanger superfamily from wild soybean contributes to high salinity and carbonate alkaline tolerance[J].Scientific Reports,2017,7(1):9423.
[23]吴 彤,刘云苗,金 军,等.蒺藜苜蓿cation/H+ exchanger基因家族鉴定及表达特征分析[J].草业学报,2022, 31(1):181-194.
WU T,LIU Y M,JIN J,et al.Identification and expression characteristics of a cation/H+ exchanger gene family in Medicago truncatula[J].Acta Prataculturae Sinica,2022,31(1):181-194.
[24]李秋月,张亚飞,彭 洁,等.柑橘U-box基因家族的鉴定及表达分析[J].中国农业科学,2019,52(11):1942-1960.
LI Q Y,ZHANG Y F,PENG J,et al.Genome wide identification and expression analysis of the U-box gene family in citrus[J].Scientia Agricultura Sinica,2019,52(11):1942-1960.
[25]袁高鹏,韩晓蕾,卞书迅,等.苹果LIM基因家族生物信息学及表达分析[J].中国农业科学,2019,52(23):4322-4332.
YUAN G P,HAN X L,BIAN SH" X,et al.Bioinformatics and expression analysis of the LIM gene family in apple[J]. Scientia Agricultura Sinica,2019,52(23):4322-4332.
[26]任家玄,李艳梅,马维峰,等.苹果14-3-3基因家族的鉴定与MdGRF13的功能分析[J].果树学报,2023,40(3):405-421.
REN J X,LI Y M,MA W F,et al.ldentification of 14-3-3 gene family and functional analysis of MdGRF13 gene in apple[J].Journal of Fruit Science,2023,40(3):405-421.
[27]LIU Z,JEFFREY A C,LI Y M,et al.Genome-wide identification and analysis of the Q-type C2H2 gene family in potato (Solanum tuberosum L.)[J].International Journal of Biological Macromolecules,2020,153:327-340.
[28]卫昭君,牛冰洁,王永新,等.茉莉酸甲酯对盐胁迫下偏关首蓿种子萌发和幼苗生长的影响[J].草地学报,2020, 28(4):998-1005.
WEI ZH J,NIU B J,WANG Y X,et al.Effect of" methyl jasmonate on seed germination and seedling growth of medicago sativa "‘Pianguan’ under Salt Stress[J].Acta Agrestia Sinica,2020,28(4):998-1005.
[29]樊晓培,邢津溥,魏铁锁,等.外源MeJA对低温胁迫下冬小麦冷响应基因表达的影响[J].麦类作物学报,2020, 40(3):292-299.
FAN X P,XING J P,WEI T S,et al.Effect of exogenous MeJA on the expression of cold response genes in winter wheat under low temperature stress[J].Journal of Triticeae Crops,2020,40(3):292-299.
[30]YANG X,JIA Z,PU Q,et al.ABA mediates plant development and abiotic stress via alternative splicing[J].International Journal of Molecular Sciences,2022,23(7):3796.
[31]WU H,LI H Y,ZHANG W H,et al.Transcriptional regulation and functional analysis of" Nicotiana tabacum under salt and ABA stress[J].Biochemical and Biophysical Research Communications,2021,570:110-116.
[32]CELLIER F,CONJRO G,RICAUD L,et al.Characterization of "AtCHX17,a member of the cation/H+ exchangers,CHX family,from arabidopsis thaliana suggests a role in K+ homeostasis[J].The Plant Journal,2004, 39(6):834-846.
[33]JIA Q,LI M W,ZHENG C,et al.The soybean plasma membrane-localized cation/H+ exchanger GmCHX20a plays a negative role under salt stress[J].Physiologia Plantarum,2021,171(4):714-727.
Analysis of Response Hormones and Abiotic Stress in Peach CHX Gene Family
Abstract Cation/H+ exchanger (CHX) gene family plays an important role in plant development and stress response mechanisms.In this study,the peach CHX" gene family was identified and their expression patterns in responde to abiotic stress and hormonal stimuli were analyzed.Using Arabidopsis CHX members as a reference model,the peach CHX family members were searched by BLASTP algorithm in peach genome database,and further screened by Pfam and SMART online tools.The investigation yielded 26 CHX family members in peach,distributed across 6 chromosomes.Phylogenetic analysis categorized peach CHX genes into eight subfamilies,and the gene structure of each subfamily was basically same as that of motif.Collinearity analysis showed that there was only one pair of linear relationships in the species,and 12 gene pairs between species (peach and Arabidopsis).qRT-PCR showed that the expression of" PpCHX" gene family members in different peach tissues exhibited difference.In addition,the expressions of PpCHX02, PpCHX03, PpCHX05, PpCHX06, PpCHX13, "PpCHX14, PpCHX15, PpCHX16, PpCHX18, PpCHX20,PpCHX22 and PpCHX25 were significantly induced by 200 mmol·L-1 NaCl,drought (15% PEG) and low temperature (4 ℃) stresses.PpCHX02, PpCHX03, PpCHX06 and "PpCHX13 showed high expression levels under gibberellin (GA3),salicylic acid (SA) and abscisic acid (ABA) treatment.
Key words Peach; Cation proton antiporter; Bioinformatics; Functional analysis

