农华麻鸭肝脏组织多胺代谢与增殖相关基因表达的研究
摘" 要" 旨在研究农华麻鸭肝脏组织多胺代谢与增殖相关基因表达的发育规律。选取0、30、60、90、120日龄的农华麻鸭各8只,采用高效液相色谱测定鸭肝脏组织中多胺含量,利用qRT-PCR分析鸭肝脏组织多胺代谢及增殖相关基因的相对表达量。结果表明,鸭肝脏生长发育过程中,亚精胺和精胺始终维持较高水平,精胺含量随日龄增长先升后降,在60日龄达到峰值为1 377.43 mg/kg;腐胺和亚精胺在0日龄含量最高,分别为131.60 mg/kg和694.64 mg/kg,后继随日龄增长腐胺和亚精胺含量逐渐降低。多胺代谢和增殖相关基因表达及相关性分析表明,多胺代谢与增殖相关基因呈一定规律性表达,SSAT、SPMS、ODC、APAO、 GATA4、 CCND1、HGF和PCNA的相对表达量随日龄增长先升后降。精胺与VEGF、HGF、PCNA、 GATA4基因表达量显著相关;亚精胺与VEGF、CCND1、HGF显著相关;腐胺与VEGF、HGF显著相关。HGF和VEGF与SMOX、SPDS、ODC显著相关;GATA4和CCND1与SSAT、SPMS、ODC显著相关;PCNA与SSAT、SPMS、GATA4、 CCND1基因表达量显著相关。多胺代谢相关基因可通过介导多胺合成和分解代谢途径维持肝脏多胺池稳态,进而调控肝脏生长发育。
关键词" 鸭;肝脏;多胺;相关性;基因表达
doi:10.7606/j.issn.1004-1389.2024.08.002
https://doi.org/10.7606/j.issn.1004-1389.2024.08.002
收稿日期:2022-06-20" 修回日期:2022-10-06
基金项目:国家自然科学基金(31872358,32172727)。
第一作者:王" 鑫,男,硕士研究生,研究方向为动物遗传育种与繁殖。E-mail:xinwang@stu. sicau.edu.cn
通信作者:康" 波,男,教授,博士生导师,研究方向为动物生理与环境生理。E-mail :bokang@sicau.edu.cn
多胺是具有生物活性的低分子脂肪族含氮化合物,主要包括腐胺、亚精胺和精胺,广泛分布于动植物体内[1-3]。多胺合成途径起始于鸟氨酸,鸟氨酸在鸟氨酸脱羧酶(Ornithine decarboxylase,ODC)的作用下生成腐胺,ODC也是多胺合成代谢的第一个限速酶[4]。腐胺进一步由亚精胺合成酶(Spermidine synthase,SPDS)和精胺合成酶(Spermine synthase,SPMS)催化,依次生成亚精胺和精胺。多胺的分解代谢途径主要由亚精胺/精胺乙酰转移酶(N1-Spermidine/spermine acetyltransferase,SSAT)和乙酰多胺氧化酶(Acetylpolyamineoxidase,APAO)催化完成,精胺经SSAT作用转化为N1乙酰亚精胺/精胺,然后经过APAO氧化降解为亚精胺,亚精胺可通过相似的方式转化为腐胺。此外,精胺也可以在精胺氧化酶(Spermineoxidase,SMOX)的作用下不通过乙酰化中间产物直接被氧化为亚精胺[5-6]。表明生物体内存在一套完整的多胺调控机制,在多胺合成和分解代谢相关酶的调控下相互转换,以维持体内多胺池稳态[7-8]。新近研究证实,多胺可通过参与细胞周期调控以及激活真核翻译起始因子来启动和加速细胞增殖,并且多胺还参与调控细胞凋亡、组织再生和器官发育等生物学过程[9-11]。
张军等[12]运用GomPertz模型分析1~7周龄樱桃谷鸭内脏器官生长发育规律,发现樱桃谷鸭肝脏生长速度从第4周开始由慢变快,到6周龄达到顶峰。万雨[13]对江南白鹅肝脏生长进行曲线拟合,发现江南白鹅肝脏生长速度在4~7周龄内快速增加,在42日龄达到生长拐点,提示鸭肝脏生长速度可能在30~60日龄内快速增加,在42日龄达到拐点。肝细胞生长因子(Hepatocyte growth factor,HGF)、细胞增殖核抗原(Proliferating cell nuclear antigen,PCNA)、锌指转录因子(GATA binging protein 4,GATA4)、细胞周期蛋白(Cyclin D1,CCND1)和血管内皮生长因子(Vascular endothelial growth factor,VEGF)等调节因子与肝脏增殖密切相关[14-15]。HGF是一种促肝生长因子,能诱导肝细胞DNA合成和有丝分裂,启动肝脏增殖。GATA4属于GATA家族,该家族广泛存在于真核生物中,是DNA聚合酶δ的辅助因子,在G1晚期开始表达,S期表达量最高,GATA4主要表达在肝脏,可通过反式激活Hhex启动子等参与调控肝脏发育[16-17]。VEGF是一种多潜能细胞因子,具有促进血管内皮增生、促进肝窦内皮细胞增生和抑制其凋亡的作用,在肝脏部分切除后能促进肝脏增生[15,18]。CCND1是细胞周期主要的正态调控因子之一,可以调节细胞G1期启动进入S期,因此,CCND1的高表达会引起细胞增殖加快[15]。此外,CCND1在肝脏再生过程中能激活相关的细胞分裂基因,进而促进肝脏增殖。由于多胺在肝脏快速增殖中含量发生显著变化,但关于鸭肝脏生长发育过程中,多胺含量和代谢基因与肝脏增殖相关基因的关系尚不清楚。
因此,本研究检测不同日龄农华麻鸭肝脏组织多胺含量、多胺代谢和增殖相关基因表达量,探究鸭肝脏多胺代谢与增殖相关基因表达的规律及相关关系,以期为多胺调控鸭肝脏发育的相关研究提供理论数据。
1" 材料与方法
1.1" 试验材料
随机选取相同环境下饲养(四川农业大学家禽育种场)的无血源关系的0、30、60、90和120日龄农华麻鸭各6只(雌雄各半),颈部放血处死,迅速采集肝脏组织,液氮速冻,置于-80 ℃冰箱保存,备用。
1.2" 组织总RNA提取及反转录
使用Trizol(TaKaRa,大连)法提取鸭肝脏总RNA,15 g/L琼脂糖凝胶电泳检测总RNA质量。参照TaKaRa反转录试剂盒(TaKaRa,大连)操作说明,将肝脏总RNA反转录为cDNA。
1.3" 高效液相色谱检测肝脏组织多胺含量
取80 mg鸭肝脏组织浸泡于0.5 mL的5%高氯酸,加入10 μL的1,6-己二胺研磨充分,取上清;上清液中加入适量2.5" mol/L" NaOH和10 μL的苯甲酰氯,漩涡振荡均匀,置于40 ℃水浴锅衍生1 h。随后用6" mol/L" HCl将pH调至中性(pH=7.0);分别用15 mL超纯水和15 mL 15%甲醇活化C18固相萃取柱,再用萃取柱过滤衍生液,接着用0.5 mL甲醇洗脱样品;0.22 μm针头过滤器过滤洗脱液后4 ℃避光保存。流速为0.5 mL/min,紫外检测器检测波长229 nm,柱温" 25 ℃,流动相组成为水∶甲醇=38∶62(V∶V)作为高效液相色谱检测条件。
1.4" qRT-PCR检测多胺代谢及增殖相关基因表达量
参考GenBank目的基因序列,用Primer Premier 5.0软件设计ODC、SPDS、SPMS、SSAT、APAO、SMOX、HGF、VEGF、PCNA、 GATA4和CCND1基因引物(表1),并委托擎科生物科技有限公司合成。利用qRT-PCR分析不同日龄鸭肝脏组织中多胺代谢及增殖相关基因相对表达量,每个样品设3个重复。PCR反应体系(10 μL)为:SYBR Green 5.0 μL,上、下游引物各0.2 μL,cDNA 0.5 μL,去RNase水4.1 μL。" q-PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃~65 ℃退火30 s,72 ℃延伸30 s,39个循环。
1.5" 统计分析
利用Excel 2021计算不同日龄鸭肝脏组织中目的基因的相对表达量,运用SPSS 26.0统计软件ANOVA 过程进行方差分析,并用Duncan氏方法进行多重比较,数值以“平均值±标准差”表示,Plt;0.05 表示差异显著。用Origin软件对基因表达量进行相关性分析和绘图。
2" 结果与分析
2.1" 不同日龄鸭的肝脏组织多胺含量
农华麻鸭肝脏组织的腐胺和亚精胺含量随着日龄的增长呈逐渐下降趋势(图1),0日龄腐胺和亚精胺含量达到最大值,分别为131.60 mg/kg和694.64 mg/kg;120日龄腐胺和亚精胺含量达到最低值,分别为24.59 mg/kg和154.11"" mg/kg;精胺含量随着日龄增长呈先上升后下降的趋势,60日龄达到最大值为1 377.43 mg/kg。
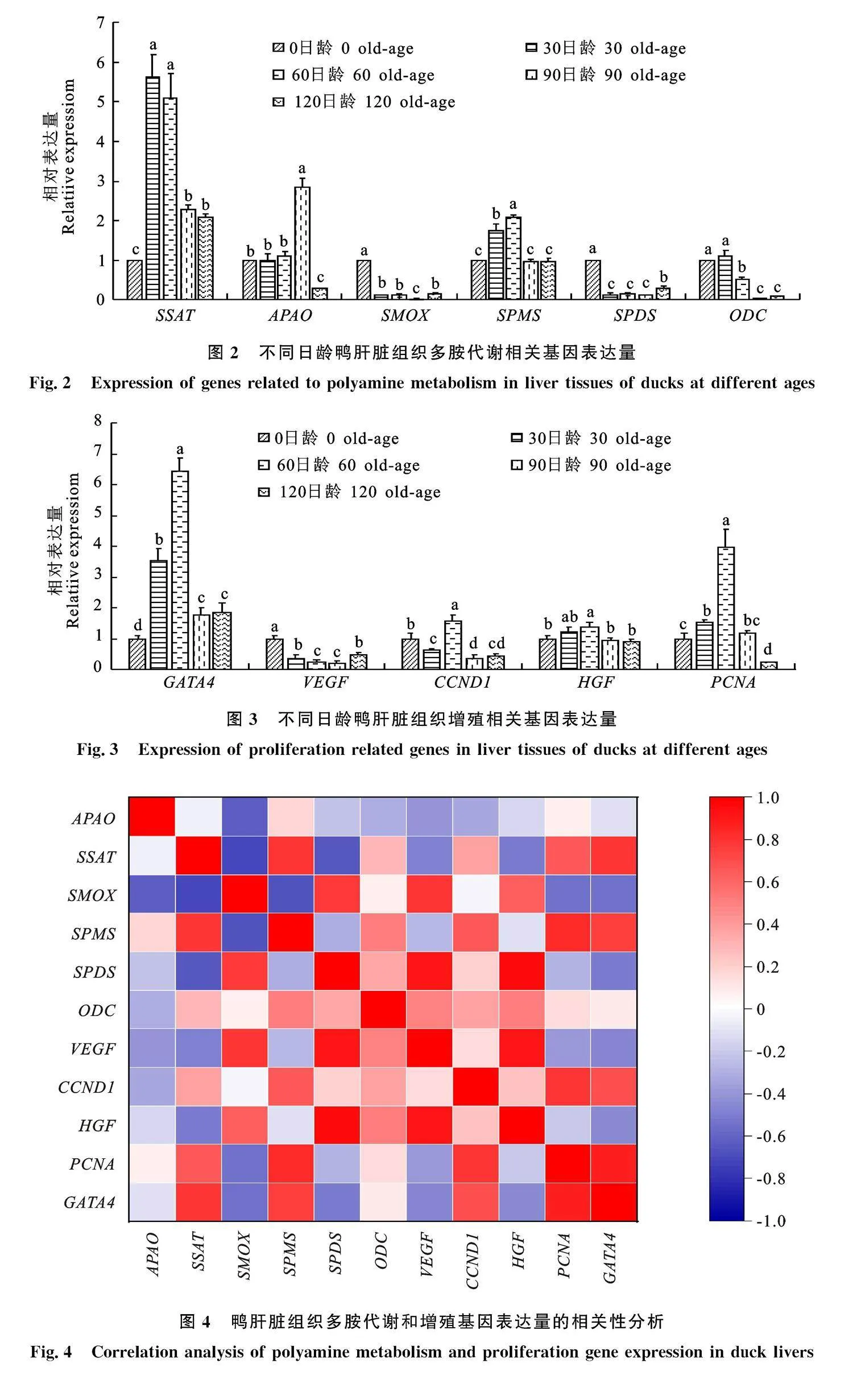
2.2" 不同日龄鸭肝脏组织多胺代谢相关基因表达的变化规律
鸭肝脏组织中多胺代谢相关基因在不同时间段的表达规律不同(图2),SSAT、SPMS、ODC和APAO的相对表达量随着日龄的增长整体呈先上升后降的趋势。SMOX和SPDS的相对表达量均在0日龄最高,随后基因表达量开始下降,120日龄又显著上升。
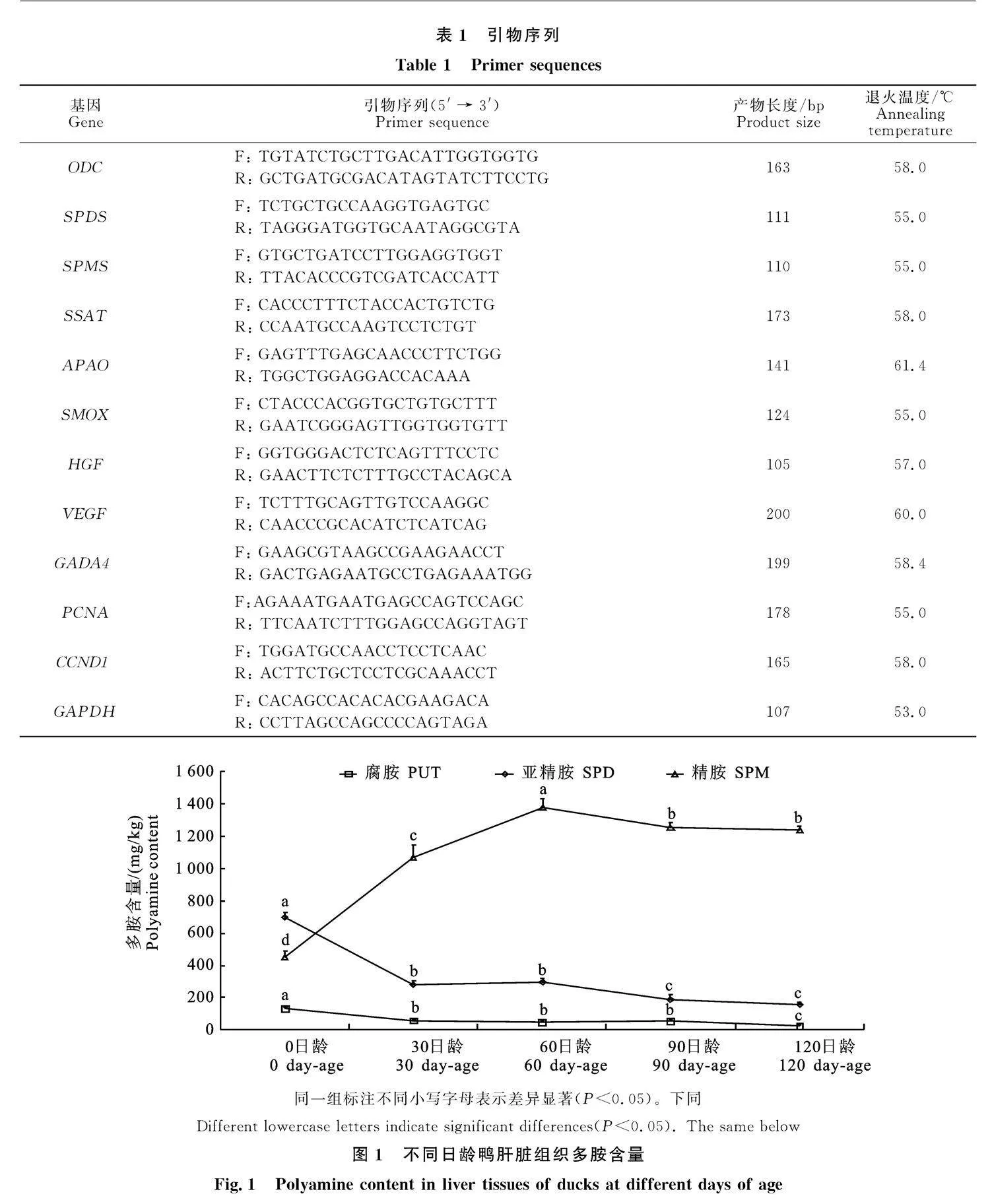
2.3" 不同日龄鸭肝脏增殖相关基因表达量的变化规律
鸭肝脏增殖相关基因在鸭肝脏生长发育不同时期存在差异表达(图3)。 GATA4、 CCND1、HGF和PCNA的mRNA表达量随日龄增长呈先上升后下降的趋势,均在60日龄表达量最高。VEGF的相对表达量在0日龄最高,随着日龄增长基因表达量开始下降,120日龄有显著上升。
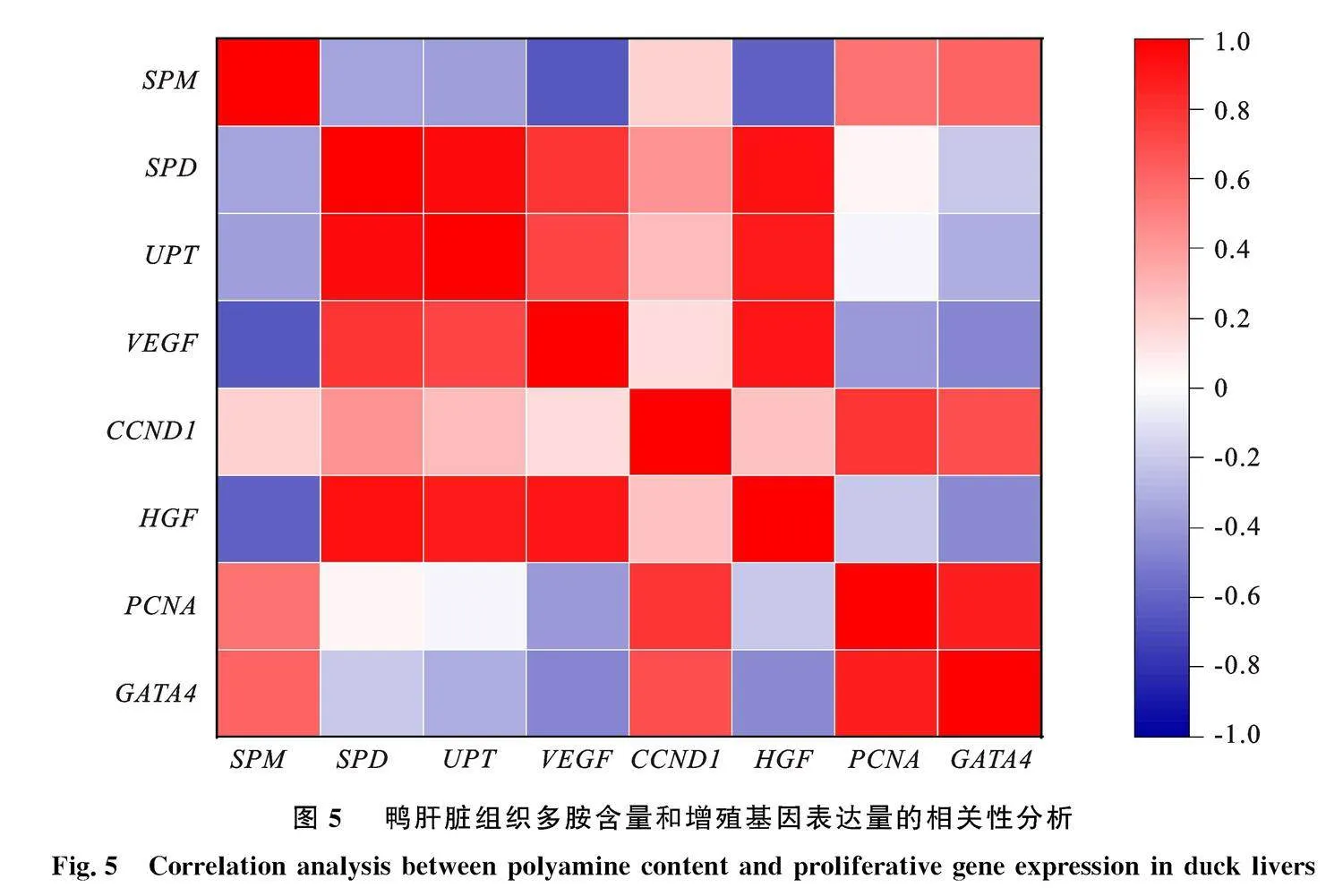
2.4" 不同日龄鸭肝脏多胺代谢与增殖基因表达的相关性分析
图4是农华麻鸭肝脏增殖相关基因与多胺代谢相关基因的相关关系。肝脏增殖基因VEGF与SMOX、SPDS、ODC呈极显著正相关。 CCND1与SSAT、ODC、SPMS呈显著正相关。HGF与SMOX、SPDS、ODC、VEGF呈极显著正相关。 GATA4与 CCND1、SSAT、SPMS呈显著正相关。PCNA与SSAT、SPMS、 GATA4、 CCND1呈极显著正相关。
2.5" 不同日龄鸭肝脏组织多胺含量与增殖基因的相关性分析
图5是农华麻鸭肝脏增殖相关基因与多胺含量的相关关系。精胺与VEGF和HGF基因表达量呈极显著负相关;精胺与PCNA和 GATA4呈极显著正相关(Plt;0.01)。亚精胺与VEGF、 CCND1和HGF基因表达量呈显著正相关。腐胺与VEGF和HGF呈极显著正相关。
3" 讨 论
3.1" 鸭肝脏多胺含量变化的规律
动物机体的多胺可分为内源性多胺和外源性多胺,内源性多胺主要由细胞自主合成。细胞内多胺水平主要取决于多胺合成途径与分解代谢途径的相互作用,并受到多胺转运蛋白的调控。多胺的匮乏会使细胞大量停滞在G1期[19],而超生理剂量的多胺会使小鼠卵巢颗粒细胞发生氧化应激[20]。表明,多胺含量的稳定对维持机体正常生命活动至关重要。研究表明,多胺可通过调控细胞增殖周期和增殖相关基因的表达促进器官的生长发育。外源性多胺能显著改善肝脏部分切除大鼠的缺血再灌注损伤,促进肝脏组织再生[21-22];腐胺可消除α生育酚对肝脏切除大鼠的不良作用,抑制α生育酚诱导的类视黄醇水平降低,进而恢复肝脏增殖潜力[23]。综上所述,多胺可作为肝脏损伤的保护因子,促进肝细胞增殖,在肝脏再生过程中发挥重要作用。Alhonen等[24]研究发现S期细胞数量与亚精胺浓度之间显著相关,并且肝脏再生需要亚精胺和精胺达到临界浓度。Nishimura等[25]测定3、10和26周龄雌性大鼠肝脏多胺水平,发现10周龄大鼠肝脏亚精胺含量较3周龄下降了50%以上,而腐胺和精胺的变化不显著,并且肝脏组织中腐胺含量显著低于精胺和亚精胺。Furukawa等[26]研究发现,3周龄的鸡肝脏组织中腐胺无明显变化,亚精胺含量显著下降,精胺含量明显上升。本研究发现,在农华麻鸭肝脏快速生长发育阶段,精胺含量显著上升,亚精胺含量显著下降,但精胺和亚精胺浓度维持较高的范围,与Alhonen等[24]和Nishimura等[25]研究结果一致。但是本研究中发现随着日龄的增长精胺含量显著上升,与Nishimura等[25]研究结果不相同,推测是不同物种在合成和分解多胺过程中存在物种差异。Krausova等[27]检测了38只鸡肝脏中多胺含量,发现仅有13%的鸡肝脏中腐胺水平高于检测限(2.1 mg/kg),亚精胺与精胺含量显著相关,并且肝脏中多胺含量差异极大。这与本研究的结果相同,提示在鸭生长发育过程中,肝脏组织中亚精胺含量会随年龄增长逐渐降低,腐胺含量显著低于亚精胺与精胺含量,并且精胺与亚精胺含量具有显著相关关系。综上,在农华麻鸭肝脏组织生长过程中,机体会通过多胺的相互转化维持多胺池稳态,进而促进肝脏组织的生长发育。
3.2" 鸭肝脏多胺代谢基因表达量的规律
多胺合成和分解代谢相关基因可以调控机体内腐胺、亚精胺和精胺的相互转化,维持机体多胺池稳定。Niu等[28]发现,过表达ODC会使鹅颗粒细胞中腐胺含量显著上升,亚精胺和精胺含量无显著变化,并且多胺代谢相关基因SPDS、SSAT和SMOX含量显著上调,SPMS无显著变化。外源性精胺灌胃可通过介导多胺代谢关键基因ODC、SPDS、SPMS和SSAT基因表达影响雌鹅十二指肠组织中亚精胺和精胺含量,而对腐胺含量无显著影响[29]。此外,本研究发现在农华麻鸭胸肌、腿肌、大脑和小脑等不同组织部位,多胺代谢基因的表达趋势并不相同,这可能是基因在不同组织的表达特异性导致的。在多胺分解代谢途径中,亚精胺可通过SSAT转化为精胺,精胺在APAO催化下转化为腐胺。SSAT在30日龄表达量最高,且与60日龄差异不显著,SMOX和APAO在30日龄和60日龄变化不显著,并且在30、60日龄内精胺含量显著上升且高于其他日龄。表明在肝脏快速增殖时期,SSAT基因表达量上调,致使肝脏中多胺含量上升,进而调控肝脏生长发育。在多胺合成途径中,腐胺可通过SPDS作用转化为亚精胺,亚精胺进一步在SPMS的作用下转化为精胺。SPDS在30日龄和60日龄表达量差异不显著,SPMS的表达量显著上调,表明在肝脏快速生长发育时期,SPMS基因表达量上调,致使肝脏中多胺含量上升,进而调控肝脏生长发育。综上所述,多胺代谢基因通过维持肝脏多胺动态平衡以调控肝脏生长发育。
3.3" 鸭肝脏多胺含量和代谢基因与肝脏增殖基因的相关性分析
肝脏发育基因在肝脏增殖中起重要调控作用。HGF、VEGF、 GATA4、 GATA4与 CCND1是常见的肝脏增殖评价指标。Massimino等[14]通过胚胎发育第12天到孵化后第4天的基因表达分析,发现参与肝脏发育的基因HGF、GATA和 PROX1表达峰值主要出现在胚胎第12天和胚胎第20天之间。Schorr等[30]发现鸭肝细胞可以在加入HGF的培养基中稳定增殖,并且这种增殖可以被HGF精确调控。此外,在肝脏部分切除的大鼠中,剩余肝脏的HGF水平会迅速升高[31],进而促进肝脏再生。细胞周期蛋白是调节细胞周期活动的重要蛋白质,它对整个正常细胞周期的维持起决定性作用,促进 CCND1的表达能促进细胞增殖,修复损伤组织。 GATA4/5/6亚家族主要表达在肝脏和心脏等中胚层和内胚层来源的器官[17],研究发现,农华麻鸭 GATA4与出生后的肝脏和心脏发育关系更为密切,而且 GATA4在鸭肝脏的表达量随着年龄的增加而逐渐升高[32]。VEGF通过增加微血管通透性、促进内皮细胞生长和促进内皮细胞通过细胞外基质迁移在伤口愈合中起关键作用。在肝脏切除的大鼠中,用转染VEGF的间充质干细胞治疗可以通过诱导祖细胞直接分化为肝细胞[33]。本研究发现精胺与VEGF、HGF、 GATA4基因表达量显著相关,亚精胺与VEGF、 CCND1和HGF基因表达量显著相关,腐胺与VEGF和HGF基因表达量显著相关,表明多胺含量可以调控肝脏增殖基因的表达。并且肝脏增殖基因与多胺代谢基因也密切相关。HGF和VEGF与SMOX、SPDS和ODC基因表达量显著相关,PCNA和" GATA4与 CCND1、SSAT和SPMS基因表达量显著相关; CCND1与SSAT、ODC和SPMS基因表达量显著相关。表明多胺代谢相关基因可通过调控机体多胺转化维持肝脏多胺池维态,进而调控肝脏生长发育。此外,肝脏增殖基因之间显著相关,表明肝脏增殖基因之间存在协同作用,共同调控肝脏生长发育。综上所述,肝脏中多胺代谢基因可通过介导多胺代谢途径维持多胺池稳定,进而调控肝脏生长发育。并且肝脏增殖相关基因之间还存在协同作用,共同促进肝脏生长发育。
4" 结" 论
农华麻鸭肝脏组织中腐胺和亚精胺含量随日龄增长逐渐降低,精胺含量在60日龄达到最高。多胺代谢和肝脏增殖相关基因呈一定规律性变化,并且多胺含量和多胺代谢基因与增殖基因之间具有显著相关关系,表明多胺代谢相关基因可通过介导多胺代谢途径维持多胺池稳态,进而调控肝脏生长发育。
参考文献" Reference:
[1]" JANNE J,ALHONEN L,PIETILA M,et al.Genetic approaches to the cellular functions of polyamines in mammals[J].European Journal of Biochemistry,2010,271(5):877-894.
[2]" JIANG D M,MO G L,JIANG Y L,et al.Exogenous spermidine affects polyamine metabolism in the mouse hypothalamus[J].Open Life Sciences,2021,16(1):39-45.
[3]" 李" 佳,陈" 庆,吕晓康,等.外源多胺和乙烯对小麦籽粒品质的影响[J].西北农业学报,2017,26(8):1156-1164.
LI J,CHEN Q,L" X K,et al.Effects of polyamine and ethylene on grain quality of wheat[J].Acta Agriculturae Boreali-occidentalis Sinica,2017,26(8):1156-1164.
[4]" SODA K.Overview of polyamines as nutrients for human healthy long life and effect of increased polyamine intake on DNA methylation[J].Cells,2022,11(1):164.
[5]" 刘宝宝,张士璀.多胺氧化酶在多胺代谢中的作用[J].鲁东大学学报(自然科学版),2014,30(4):336-341.
LIU B B,ZHAGN SH C.Roles of polyamine oxidases in polyamine catabolism[J].Journal of Ludong University(Natural Science Edition),2014,30(4):336-341.
[6]" 杜" 菲,易治鑫,于海莹,等.精胺对雌鹅十二指肠多胺代谢关键基因表达及多胺含量的影响[J].农业生物技术学报2019,27(8):1445-1451.
DU F,YI ZH X,YU H Y,et al.Effect of spermine on expression of key genes related to polyamine metabolism and polyamine contents in the duodenum of female geese[J].Journal of Agricultural Biotechnology,2019,27(8):1445-1451.
[7]" SANCHEZ J F,MEDINA M,VILLALOBOS R L,et al.Polyamines in mammalian pathophysiology[J].Cellular and Molecular Life Sciences,2018,76(20):3987-4008.
[8]" IGARASHI K,KASHIWAGI K.Functional roles of polyamines and their metabolite acrolein in eukaryotic cells[J].Amino Acids,2021,53(10):1473-1492.
[9]" MASSARO C,THOMAS J,PHANSTIEL I O.Investigation of polyamine metabolism and homeostasis in pancreatic cancers[J].Medical Science,2017,5(4):32.
[10]" GEVREKCI A.The roles of polyamines in microorganisms[J].World Journal of Microbiology amp; Biotechnology,2017,33(11):204.
[11]" JAGU E,POMEL S,PETHE S,et al.Polyamine-based analogs and conjugates as antikinetoplastid agents[J].European Journal of Medicinal Chemistry,2017,139:982-1015.
[12]" 张" 军,郑" 云,龚道清,等.樱桃谷鸭部分内脏器官早期生长发育规律研究[J].中国家禽,2005,27(23):16-18.
ZHANG" J,ZHENG Y,GONG D Q,et al.Study on growth and development rules of visceral origin in Cherry Valley duck[J].China Poultry,2005,27(23):16-18.
[13]" 万" 雨.江南白鹅早期生长发育规律的分析研究[D].江苏扬州:扬州大学,2021.
WAN" Y.Study of the early growth and development on Jianguan White Geese[D].Yangzhou Jiangsu:Yangzhou University,2021.
[14]" MASSIMINO W,DAVAIL S,SECCULA A,et al.Ontogeny of hepatic metabolism in mule ducks highlights different gene expression profiles between carbohydrate and lipid metabolic pathways[J].BMC Genomics,2020,27(1):742.
[15]" 杜秋国,高建虎,徐志广,等.缺血/再灌注损伤时细胞周期调控的研究进展[J].医学综述,2012,18(16):2537-2539.
DU Q G,GAO J H,XU ZH G,et al.Research progress of the cell cycle regulation in ischemia-reperfudion injry[J].Medical Recapitulate,2012,18(16):2537-2539
[16]" PATIENT R,MCGHEE J.The GATA family (vertebrates and invertebrates)[J].Current Opinion in Genetics amp; Development,2002,12(4):416-422.
[17]" HAWORTH K,KOTECHA S,MOHUN T,et al." GATA4 and"" GATA5 are essential for heart and liver development in Xenopus embryos[J].BMC Developmental Biology,2008,8:74.
[18]" YAMAMOTO C,YAGI S,HORI T,et al.Significance of portal venous VEGF during liver regeneration after hepatectomy[J].Journal of Surgical Research,2010,159(2):37-43.
[19]" IGARASHI K,KASHIWAGI K.The functional role of polyamines in eukaryotic cells[J].International Journal of Biochemistry amp; Cell Biology,2019,107:104-115
[20]" JIANG D M,JIANG Y L,LONG S Y,et al.Spermidine at supraphysiological doses induces oxidative stress and granulosa cell apoptosis in mouse ovaries[J].Theriogenology, 2021,168:25-32.
[21]" DOI J,FUJIMOTO Y,TERATANI T,et al.Bolus administration of polyamines boosts effects on hepatic ischemia-reperfusion injury and regeneration in rats[J].European Surgical Research,2019,60(1/2):63-73.
[22]" OKUMURA S,TERATANI T,FUJIMOTO Y,et al." Oral administration of polyamines ameliorates liver ischemia/reperfusion injury and promotes liver regeneration in rats[J].LIVER Transplantation,2016," 22(9):1231-1244.
[23]" SANCHEZ S L,MEDICINE E C.Putrescine treatment reverses α-tocopherol-induced desynchronization of polyamine and retinoid metabolism during rat liver regeneration[J].Journal of Translational Medicine,2016,14(1):307.
[24]" ALHONEN L,RASANEN T,SINERVIRTA R,et al.Polyamines are required for the initiation of rat liver regeneration[J].Biochemical Journal,2002,362(Pt 1):149-153.
[25]" NISHIMURA K,SHIINA R,KASHIWAGI K,et al.Decrease in polyamines with aging and their ingestion from food and drink[J].Journal of Biochemistry,2006, 139(1):81-90.
[26]" FURUKAWA K,HE W L,BAILEY" C A,et al.Polyamine synthesis from arginine and proline in tissues of developing chickens[J].Amino Acids,2021,53(11):1739-1748.
[27]" KRAUSOVA P,KAL A P,KIRZEK M,et al.Content of biologically active polyamines in livers of cattle,pigs and chickens after animal slaughter[J].Meat Science,2006, 73(4):640-644.
[28]" NIU C Y,ZHANG S J,MO G L,et al.Effects of ODC on polyamine metabolism,hormone levels,cell proliferation and apoptosis in goose ovarian granulosa cells[J].Journal of Poultry Science,2021,100(8):101226.
[29]" 易治鑫,蒋易龙,李林祥,等.精胺对雌鹅空肠、回肠多胺代谢关键基因表达及多胺含量的影响[J].农业生物技术学报,2019,30(8):1571-1579.
YI ZH X,JIANG Y L,LI L X,et al.Efect of spermine on expression of polyamine metabolism-related key genes and polyamine contents in jejunum and ilnum of female geese(Anser cygnoides) [J].Journal of Agricultural Biotechnology,2019,30(8):1571-1579.
[30]" SCHORR O,BOREL C,TREPO C,et al.Effects of liver growth factors on hepadnavirus replication in chronically infected duck hepatocytes[J].Journal of Hepatology,2006,44(5):842-847.
[31]" FAJARDO A,MATO P M,FRAMPTON A,et al.Gene of the month:HGF[J].Journal of Clinical Pathology,2016,69(7)575-579.
[32]" 欧阳清渊,王郁石,胡深强,等." GATA4/5/6基因克隆及其在出生后鸭心脏和肝脏中的发育性表达模式[J].畜牧兽医学报.2019,50(9):1775-1786.
OUYANG Q Y,WANG Y SH,HU SH Q,et al.Cloning of"" GATA4/5/6 genes and their expression in DUCK hearts and livers during postnatal development[J].Acta Veterinaria et Zootechnica Sinica,2019,50(9):1775-1786.
[33]" ADAS G,KOC B,ADAS M,et al.Effects of mesenchymal stem cells and VEGF on liver regeneration following major resection[J].Langenbecks Archives of Surgery,2016, 401(5):725-740.
Study on Polyamine Metabolism and Gene Expression Related to Liver Proliferation in Nonghua Duck
WANG Xin,WANG" Zhiting,WANG" Zelong,GUO" Yongni,SUN Qin and KAGN Bo
(College of Animal Science and Technology,Sichuan Agricultural University,Chengdu" 611130,China)
Abstract" The purpose of this experiment is to study the developmental regularity of polyamine metabolism and proliferation related gene expression in the liver of Nonghua duck. Eight Nonghua ducks aged 0,30,60,90 and 120 days were selected to determine the content of polyamines in duck liver by HPLC,and the relative expression of polyamine metabolism and proliferation related genes in duck liver were analyzed by qRT PCR. The results showed that during the growth and development of duck liver,spermidine and spermine remained at a high level all the time,and the spermine content increased first and then decreased with the increase of age,reaching a peak of 1" 377.43 mg/kg at 60 days of age; The contents of putrescine and spermidine were the highest at 0 day-old,which were 131.60 mg/kg and 694.64 mg/kg,respectively. Later,the contents of putrescine and spermidine decreased gradually with the increase of day age. The expression and correlation analysis of polyamine metabolism and proliferation related genes showed that polyamine metabolism and proliferation related genes were regularly expressed. The relative expression of SSAT,SPMS,ODC,APAO, GATA4, CCND1,HGF and PCNA increased first and then decreased with increase of days of age.Spermine was significantly correlated with the expression of VEGF,HGF,PCNA and" GATA4; spermidine was significantly correlated with" the expression of VEGF, CCND1 and HGF;" putrescine was significantly correlated with" the expression of VEGF and HGF.HGF and VEGF were significantly correlated with" the expression of" SMOX,SPDS and ODC;" GATA4 and" CCND1 were significantly correlated with" the expression of" SSAT,SPMS and ODC; PCNA was significantly correlated with" the expression of" SSAT,SPMS, GATA4 and" CCND1. The polyamine metabolism related genes can maintain the homeostasis of liver polyamine pool by mediating polyamine synthesis and catabolism,and then regulate liver growth and development. This study provideda theoretical reference for the study on the mechanism of polyamines regulating the growth and development of duck liver.
Key words" Duck; Liver; Polyamines; Correlation; Gene expression
Received ""2022-06-20""" Returned" 2022-10-06
Foundation item" The National Natural Science Foundation of China(No.31872358,No.32172727).
First author" WANG Xin,male,master student. Research area: animal genetics,breeding and reproduction. E-mail:xinwang@stu. sicau.edu.cn
Corresponding"" author" KAGN Bo,male,professor,doctoral supervisor. Research area: animal physiology and environmental physiology. E-mail:bokang@sicau.edu.cn
(责任编辑:顾玉兰" Responsible editor:GU Yulan)

