ASAP1与P53在卵巢高级别浆液性癌中的表达及意义

【摘要】 目的:探讨二磷酸腺苷核糖化因子鸟苷酸激酶1(ASAP1)与P53在卵巢高级别浆液性癌(HGSOC)中的表达及临床病理意义。方法:收集2020年5月—2024年5月江西省妇幼保健院的108例卵巢浆液性肿瘤组织蜡块标本,根据病理类型分为四组,其中40例HGSOC为A组、28例卵巢低级别浆液性癌为B组、20例卵巢交界性浆液性肿瘤为C组、20例卵巢浆液性囊腺瘤为D组,运用免疫组化Elivision两步法检测所有组别中ASAP1和P53的表达,比较不同组别中ASAP1及P53的表达差异;并重点分析A组中ASAP1、P53表达与临床FIGO分期、淋巴结转移等临床病理特征的关系。结果:(1)A组ASAP1及P53阳性率均明显高于B组、C组及D组,差异均有统计学意义(Plt;0.05),B组中ASAP1阳性率明显高于C组及D组,差异均有统计学意义(Plt;0.05);(2)A组中淋巴结转移者ASAP1阳性率明显高于淋巴结无转移者,差异有统计学意义(Plt;0.05),FIGO Ⅲ、Ⅳ期者ASAP1阳性率明显高于FIGOⅠ、Ⅱ者,差异有统计学意义(Plt;0.05);(3)A组中ASAP1与P53表达呈正相关(Plt;0.01)。结论:ASAP1与P53在HGSOC的发生发展中起协同作用,ASAP1表达与HGSOC的临床FIGO分期、淋巴结转移有关,提示ASAP1可能是预测HGSOC生物学行为及预后的潜在指标。
【关键词】 卵巢高级别浆液性癌 二磷酸腺苷核糖化因子鸟苷酸激酶1 P53
Expression and Significance of ASAP1 and P53 in High-grade Serous Ovarian Carcinoma/ZOU Liang, JIE Youkun, GUO Qi. //Medical Innovation of China, 2024, 21(36): -161
[Abstract] Objective: To investigate the expression and clinicopathological significance of adenosine diphosphate ribosylation factor guanylate kinase 1 (ASAP1) and P53 in high-grade serous ovarian carcinoma (HGSOC). Method: A total of 108 cases of ovarian serous tumor tissue wax samples from May 2020 to May 2024 in Jiangxi Maternal and Child Health Hospital were collected and divided into four groups according to pathological types, including 40 cases of HGSOC as group A, 28 cases of low-grade ovarian serous cancer as group B, 20 cases of borderline ovarian serous tumor as group C, and 20 cases of ovarian serous cystadenoma as group D. The expression of ASAP1 and P53 in all groups was detected by immunohistochemical Elivision two-step method, and the expression differences of ASAP1 and P53 in different groups were compared. The relationship between the expression of ASAP1, P53 in group A and clinical FIGO stage, lymph node metastasis and other clinicopathological features was analyzed. Result: (1) The positive rates of ASAP1 and P53 in group A were significantly higher than those in group B, group C, and group D, the differences were statistically significant (Plt;0.05), the positive rate of ASAP1 in group B was significantly higher than that in group C and group D, the differences were statistically significant (Plt;0.05). (2) The positive rate of ASAP1 in patients with lymph node metastasis in group A was significantly higher than that in patients without lymph node metastasis, the difference was statistically significant (Plt;0.05). The positive rate of ASAP1 in patients with FIGO stage Ⅲ, Ⅳ was significantly higher than that in patients with FIGO stage Ⅰ, Ⅱ, the difference was statistically significant (Plt;0.05). (3) There is a positive correlation between ASAP1 and P53 expression in group A (Plt;0.01). Conclusion: ASAP1 and P53 play a synergistic role in the occurrence and development of HGSOC, the expression of ASAP1 is related to FIGO staging and lymph node metastasis of HGSOC, suggesting that ASAP1 may be a potential indicator for predicting the biological behavior and prognosis of HGSOC.
[Key words] High-grade serous ovarian carcinoma Adenosine diphosphate ribosylation factor guanylate kinase1 P53
First-author's address: Department of Pathology, Jiangxi Maternal and Child Health Hospital, Nanchang 330038, China
doi:10.3969/j.issn.1674-4985.2024.36.037
卵巢癌是常见妇科恶性肿瘤,死亡率居妇科恶性肿瘤第一位[1],卵巢高级别浆液性癌(high-grade serous ovarian carcinoma,HGSOC)是最主要的组织学类型[2],因缺乏早期筛查指标,临床症状不明显,多数患者就诊时已到晚期,出现淋巴结及远处转移,因此HGSOC早期有效诊治是改善预后的重要前提和基础,但目前尚缺乏有效的早期诊断手段。HGSOC中存在复杂、多样的驱动基因改变,所以针对HGSOC关键驱动基因是研究的重点,P53突变可能是HGSOC主要驱动因素之一[3]。HGSOC是多基因变异导致的肿瘤,只有P53突变不足以导致癌变,还需其他因子协同作用,二磷酸腺苷核糖化因子鸟苷酸激酶1(adenosine diphosphate ribosylation factor guanylate kinase 1,ASAP1)是一种三磷酸鸟苷酶活化蛋白,主要功能调节细胞运动和细胞骨架的重构,与肿瘤的转移密切相关[4-5]。刘亚南等[6]认为,ASAP1高表达致上皮生长因子受体增多,与卵巢癌的进展有关,但目前国内外尚无ASAP1在HGSOC中的研究报道,本研究通过免疫组化法检测ASAP1及P53在HGSOC蜡块组织中的表达,分析两者与HGSOC临床参数的关系,初步探讨ASAP1与P53在HGSOC进展以及预后判断中的作用。
1 材料与方法
1.1 标本来源和分组
收集2020年5月—2024年5月江西省妇幼保健院住院患者手术切除的108例卵巢浆液性肿瘤组织蜡块标本,根据病理类型分为四组,包括40例HGSOC(A组)、28例卵巢低级别浆液性癌(B组)、20例卵巢交界性浆液性肿瘤(C组)、20例卵巢浆液性囊腺瘤(D组)。纳入标准:A组为HGSOC,B组为卵巢低级别浆液性癌,C组为卵巢交界性浆液性肿瘤,D组为卵巢浆液性囊腺瘤,病理类型均由江西省妇幼保健院两位妇科病理学专家确诊;术前未接受任何治疗;A组早期行卵巢癌全面分期手术,晚期行卵巢癌细胞减灭术。排除标准:临床资料不完整。本研究经江西省妇幼保健院医学伦理委员会批准。
1.2 方法
标本均经4%的中性甲醛固定,常规石蜡包埋,选择具有代表性的组织蜡块进行4 μm连续切片3张,分别用于HE染色、ASAP1及P53免疫组化染色,免疫组化采用Elivision两步法,所用抗体ASAP1购自美国Abcam公司,P53购自福州迈新公司,每组抗体均设立阳性和阴性对照,免疫组化染色使用LEICA全自动免疫组化染色仪。
1.3 结果判读标准
ASAP1结果判读参照文献[4]。(1)阳性细胞数评分:ASAP1阳性为细胞浆棕色着色,选择每张切片中任意5个视野中的100个肿瘤细胞,阳性细胞数占比≤5%为0分,阳性占比gt;5%且≤25%为1分,gt;25%且≤50%为2分,gt;50%且≤75%为3分,gt;75%为4分。(2)细胞染色强度评分:染色强度分为4级:细胞浆没有任何着色为0分,较浅棕色为1分,中等程度棕色为2分,深棕色为3分。两者乘积作为最终的免疫组化分数,4~9分为阳性。
P53结果判读参照文献[7]。P53阳性为棕黄色细胞核染色,检测结果可出现三种表达模式,(1)错义突变:P53弥漫一致强阳性细胞核着色(gt;75%肿瘤细胞);(2)无义突变:P53完全阴性表达或少于5%阳性细胞核着色;(3)野生型:P53强弱不等阳性细胞核着色。其中错义突变与无义突变纳入阳性,野生型纳入阴性。
1.4 统计学处理
本研究采用SPSS 27.0统计学软件,计数资料的表示方式为率(%),进行字2检验或Fisher确切概率法进行比较分析,相关性分析采用Spearman等级相关分析,以Plt;0.05为差异有统计学意义。
2 结果
2.1 基线资料
A组年龄39~66岁,平均(51.5±6.44)岁;B组年龄29~69岁,平均(51.0±11.08)岁;C组年龄40~67岁,平均(51.7±7.57)岁;D组年龄40~67岁,平均(51.2±7.61)岁;四组的年龄基线资料相比较,差异无统计学意义(Pgt;0.05),具有可比性。A组gt;50岁24例,≤50岁16例;肿瘤单侧21例,双侧19例;肿瘤最大直径:gt;5 cm 27例,≤5 cm 13例;淋巴结转移22例,淋巴结无转移18例;FIGOⅠ、Ⅱ期15例,FIGO Ⅲ、Ⅳ期25例。
2.2 ASAP1及P53蛋白表达情况
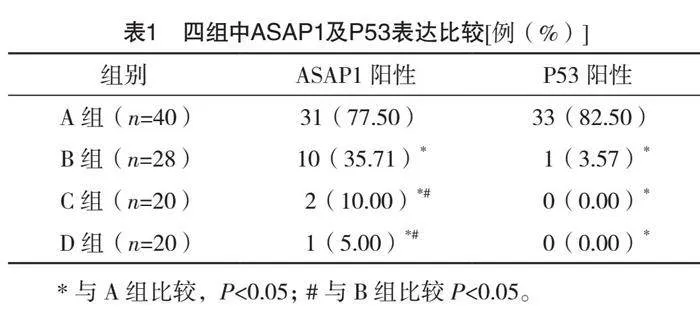
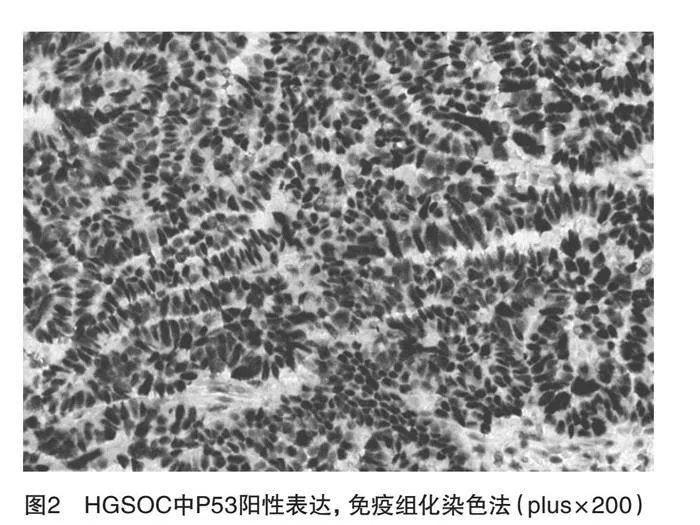
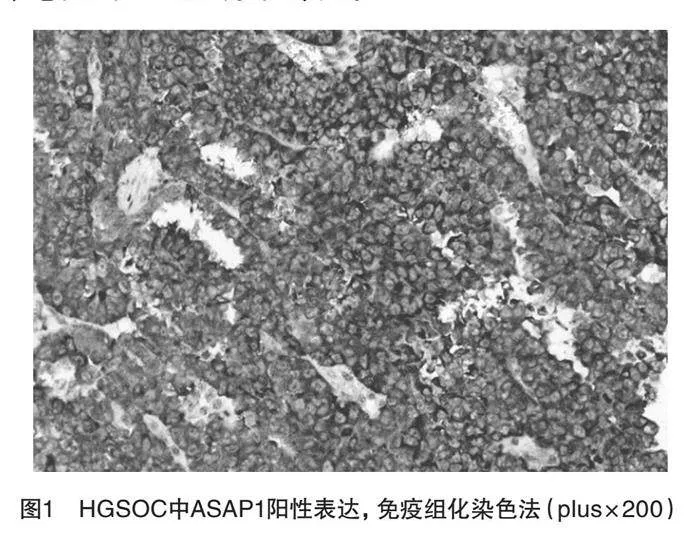
A组40例中ASAP1阳性者31例(77.50%),见图1;P53阳性者33例(82.50%),见图2,B组28例中ASAP1阳性者10例(35.71%),P53阳性者1例(3.57%),C组20例中ASAP1阳性者2例
(10.00%),P53阳性者0例(0),D组20例中ASAP1阳性者1例(5.00%),P53阳性者0例(0)。A组ASAP1及P53阳性率均明显高于B组、C组、D组,差异均有统计学意义(Plt;0.05),B组中ASAP1阳性率明显高于C组、D组,差异均有统计学意义(Plt;0.05)。见表1。
2.3 HGSOC中ASAP1、P53蛋白表达与临床病理参数的关系
HGSOC中淋巴结转移者ASAP1阳性率明显高于淋巴结无转移者,差异有统计学意义(Plt;0.05),FIGO Ⅲ、Ⅳ期者ASAP1阳性率明显高于FIGO Ⅰ、Ⅱ期者,差异有统计学意义(Plt;0.05),而不同年龄、肿瘤部位、肿瘤最大直径者中ASAP1阳性率比较,差异均无统计学意义(Pgt;0.05)。 HGSOC中不同年龄、肿瘤部位、肿瘤最大直径、FIGO分期、淋巴结是否转移者中P53阳性率比较,差异均无统计学意义(Pgt;0.05)。见表2。
2.4 HGSOC中ASAP1及P53蛋白表达相关性
31例ASAP1阳性的HGSOC病例中,P53阳性者29例,而9例ASAP1阴性的HGSOC病例中,P53阴性者5例,Spearman相关性分析发现,两者呈正相关(rs=0.855,Plt;0.01)。
3 讨论
卵巢癌是目前死亡率最高的妇科恶性肿瘤,5年生存率仅为39%[8],HGSOC是最常见的病理类型,发现时多为晚期,大多数患者生存期不足2年,并且易产生耐药,预后差[3],因此HGSOC的早诊断和靶向治疗的研究显得尤为重要。由于驱动基因改变是肿瘤的主要致病因素,以驱动基因为靶点杀伤肿瘤细胞更易获得成功,肿瘤基因组图谱数据显示,HGSOC中存在复杂、多样的驱动基因改变,包括基因突变、缺失、扩增等,HGSOC驱动基因的分子功能、促癌机制、诊断、靶向治疗是近年来研究的热点[3,9]。
P53突变(即正常P53功能的丧失)在所有类型肿瘤中的发生率为50%,P53突变不仅影响细胞周期进程,细胞生长和存活,还促进癌细胞的侵袭,P53突变在HGSOC中比率高达96%,可能是HGSOC主要驱动因素之一[3]。突变的P53蛋白具有抗原性,可成为免疫治疗的靶点,但不同突变类型P53蛋白表达水平不同,不同突变的免疫原性也不同,成为免疫治疗的难点[10],而且只有P53突变不足以导致癌变,还需要其他因子协同作用,因此急需探索新的分子生物诊断指标和治疗靶点。
我们前期通过癌症基因组图谱(the cancer genome atlas,TCGA)数据库检索发现:ASAP1在人类多种恶性肿瘤中有不同程度的扩增,在卵巢癌中有31.8%的扩增。ASAP1是ADP-核糖基化因子GTP 酶活化蛋白,其基因位于8q24,含有PH、SH3、Ank重复的结构域,主要调节细胞的运动和细胞骨架的重构,ASAP1过表达促进细胞黏附和迁移,表达缺失则抑制细胞伪足形成和迁移[11]。一些信号通路已被证实参与了ASAP1介导的肿瘤侵袭,Zhang等[12]研究发现ASAP1在非小细胞肺癌中通过调控PTEN/AKT信号通路促进癌细胞的增殖、侵袭和转移。Jiang等[13]研究证实敲除ASAP1可通过抑制mTOR信号通路诱导甲状腺乳头状癌的自噬。近几年研究表明ASAP1在肺癌、乳腺癌、胃癌等多种恶性肿瘤中高表达,并与肿瘤侵袭转移密切相关,可作为肿瘤的标记物和治疗靶点[12,14-17]。Zhang等[18]研究表明ASAP1的过表达能够促进卵巢癌细胞存活和增殖,并能够抑制化疗药物紫杉醇诱导的癌细胞凋亡,通过促进癌细胞的上皮-间质转化(epithelial-mesenchymal transition,EMT)过程,促进癌细胞迁移和侵袭。Hou等[19]研究认为,ASAP1高表达在卵巢癌的进展和转移中起重要作用,可用作预测卵巢癌患者预后的肿瘤标志物,HGSOC作为卵巢癌中的高度恶性肿瘤之一,目前尚未见ASAP1在HGSOC中的独立研究报道。
卵巢浆液性癌包含了HGSOC和低级别浆液性癌,它们具有各自的组织学形态、分子基因改变和临床生物学行为,低级别浆液性癌由良性浆液性囊腺瘤和交界性浆液性肿瘤发展而来,预后较好,而HGSOC除了极少数由伴P53突变的低级别浆液性癌转化而来,大多来源于输卵管伞端的浆液性上皮内癌,恶性程度高,进展较快,发现时多为临床Ⅲ~Ⅳ期,预后较差。本研究结果显示,HGSOC中ASAP1阳性率明显高于卵巢低级别浆液性癌、交界性浆液性肿瘤及浆液性囊腺瘤,而卵巢低级别浆液性癌中ASAP1阳性率明显高于卵巢交界性浆液性肿瘤和卵巢浆液性囊腺瘤,表明ASAP1的表达与卵巢浆液性肿瘤恶性程度密切相关,ASAP1过表达在HGSOC的发生发展起着重要作用。HGSOC中P53表达显著高于其余三组,而其余三组所有病例中仅低级别浆液性癌组中1例显示P53阳性,提示P53是HGSOC发生发展的主要驱动基因之一,而且这1例同时表达ASAP1,提示可能会向HGSOC转化,我们会对这例患者进行长期随访观察。
最新研究表明P53突变可通过激活ARF6-ASAP1途径上调ASAP1水平,促进恶性肿瘤的侵袭和转移,而正常P53可抑制癌细胞和正常上皮细胞中的ASAP1mRNA[20-21]。值得关注的是,我们的研究表明ASAP1和P53在HGSOC均呈高表达,且表达呈正相关,提示两者在HGSOC的侵袭和转移中发挥着重要的协同作用。
本研究还证实HGSOC中ASAP1表达与临床FIOG分期及淋巴结转移密切相关,提示ASAP1过表达可能增强HGSOC侵袭转移的能力,而P53表达与临床FIOG分期及淋巴结转移无明显相关性,提示ASAP1对预测HGSOC的侵袭转移及预后评估的价值可能优于P53,综上所述,ASAP1对于评估HGSOC的恶性程度、预测淋巴结转移及临床分期有重要意义,联合ASAP1与P53检测对HGSOC早期诊断筛查及预后评估有重要的参考价值,后续的研究中我们将收集更多的HGSOC病例并进行持续随访,探讨ASAP1及P53表达与患者临床表现、对化疗的敏感性及预后的关系,为更好地进行HGSOC诊断、预测和靶向药物提供新的研究方向。
参考文献
[1]谢佐莲,陈瓅,林亮,等.晚期卵巢癌行肿瘤细胞减灭术的预后情况及影响因素分析[J].中国医学创新,2022,19(31):151-154.
[2]甘文婷,张智弘,王聪.卵巢高级别浆液性癌驱动基因相关的临床病理研究进展[J].临床与实验病理学杂志,2024,40(3):303-307.
[3]姜凤丽,吴天一,吴凡.高级别浆液性卵巢癌关键驱动基因的研究进展[J].医学综述,2021,27(13):2583-2588.
[4]潘菊花,刘炳辉,陈灵斌,等.ADP核糖基化因子的GTP酶激活蛋白1、肌动蛋白束蛋白1在胃癌组织中的表达及与患者预后的关系[J].中国卫生检验杂志,2023,33(8):967-971.
[5] GASILINA A,VITALI T,LUO R,et al.The ArfGAP ASAP1 controls actin stress fiber organization via its N-BAR domain[J].iScience,2019,22:166-180.
[6]刘亚南,高爱华,朱维培.上皮性卵巢癌组织中ASAP1蛋白的表达及其临床意义[J].江苏大学学报(医学版),2015,25(6):495-497.
[7]陈冬莲,李红红,叶倩倩.不同临床病理特征卵巢浆液性肿瘤患者E-cadherin、BRCA1及P53的表达变化研究[J].中国医学创新,2024,21(18):157-160.
[8] ZENG H,CHEN W,ZHENG R,et al.Changing cancer survival in China during 2003-15:a pooled analysis of 17 population-based cancer registries[J/OL].Lancet Glob Health,2018,6(5):e555-567[2024-09-27].https://pubmed.ncbi.nlm.nih.gov/29653628/.DOI:10.1016/S2214-109X(18)30127-X.
[9] MOORE K,COLOMBO N,SCAMBIA G,et al.Maintenance Olaparib in patients with newly diagnosed advanced ovarian cancer[J].New England Journal of Medicine,2018,379(26):2495-2505.
[10] MALEKZADEH P,PASETTO A,ROBBINS P F,et al.Neoantigen screening identifies broad TP53 mutant immunogenicity in patients with epithelial cancers[J].Journal of Clinical Investigation,2019,129(3):1109-1114.
[11] SCHREIBER C,SARASWATI S,HARKINS S,et al.Loss of ASAP1 in mice impairs adipogenic and osteogenic differentiation of mesenchymal progenitor cells through dysregulation of FAK/Src and AKT signaling[J/OL].PLoS Genet,2019,15(6):e1008216(2019-06-27)[2024-09-27].https://pubmed.ncbi.nlm.nih.gov/31246957/.DOI:10.1371/journal.pgen.1008216.
[12] ZHANG L,SHI S B,ZHU Y,et al.Long non-coding RNA ASAP1-IT1 promotes cell proliferation,invasion and metastasis through the PTEN/AKT signaling axis in non-small cell lung cancer[J].Eur Rev Med Pharmacol Sci,2018,22:142-149.
[13] JIANG N N,YANG Y,ZHAO G N,et al.Knockout of ASAP1 induces autophagy in papillary thyroid carcinoma by inhibiting the mTOR signaling pathway[J].Pathology Research and Practice,2020,216(6):152950.
[14] LUO Q, ZHANG S Y, ZHANG D H,et al.Expression of ASAP1 and FAK in gastric cancer and its clinicopathological significance[J].Oncology Letters,2020,20:974-980.
[15] JICHAO H,RONAN P,LAMBERT V,et al.Integrative analysis of genomic amplification-dependent expression and loss-of-function screen identifies ASAP1 as a driver gene in triple-negative breast cancer progressione[J].Oncogene,2020,39:4118-4131.
[16]樊玉霞,姜娜娜,卢秀波.二磷酸腺苷核糖化因子鸟苷酸激酶1对甲状腺乳头状癌细胞自噬的调节作用[J].中华实验外科杂志,2020,37(12):2286-2288.
[17]张婷,刘文俊.ASAP1蛋白在乳腺癌中的表达及临床意义[J].医学综述,2015,21(11):2057-2059.
[18] ZHANG T,ZHAO G N,YANG C H,et al.Lentiviral vector mediated-ASAP1 expression promotes epithelial to mesenchymal transition in ovarian cancer cells[J].Oncol Lett,2018,15(4):4432-4438.
[19] HOU T,YANG C L,TONG C J.Overexpression of ASAP1 is associated with poor prognosis in epithelial ovarian cancer[J].International Journal of Clinicalamp;Experimental Pathology,2014,7(1):280-287.
[20] HASHIMOTO S,FURUKAWA S,HASHIMOTO A,et al.PNAS Plus:ARF6 and AMAP1 are major targets of KRAS and TP53 mutations to promote invasion,PD-L1 dynamics,and immune evasion of pancreatic cancer[J].PNAS,2019,116(35):17450-17459.
[21] HANDA H,HASHIMOTO A,HASHIMOTO S,et al.
Epithelial-specific histone modification of the miR-96/182 locus targeting AMAP1 mRNA predisposes P53 to suppress cell invasion in epithelial cells[J].Cell Communication and Signaling,2018,16(1):94-101.
(收稿日期:2024-11-01) (本文编辑:田婧)

