基于GC-MS分析不同资源姜黄挥发油成分及含量差异








摘要:为比较不同资源姜黄挥发油成分的异同,采用水蒸气蒸馏法提取24批姜黄样品挥发油,采用气相色谱-质谱联用技术(GC-MS)分离鉴定各色谱峰的化学成分;采用聚类分析(HCA)、主成分分析(PCA)和正交偏最小二乘法-判别分析(OPLS-DA)对24批挥发油成分进行组学分析和差异代谢物筛选。结果表明,24批姜黄挥发油提取得率为0.30%~1.10%,从中共检测出63种成分,主要为姜黄酮类成分,相对含量在50%以上,其次为萜烯类物质,含量低且组成复杂。建立姜黄挥发油GC-MS指纹图谱,相似度在0.911~0.997之间,从中确认7个共有峰。HCA和PCA将其中21个样品分为A组和B组,OPLS-DA筛选出19个差异代谢物,聚类热图分析显示A组的特征性成分为姜黄酮类物质芳姜黄酮、α-姜黄酮和β-姜黄酮,B组为姜烯、β-红没药烯和β-倍半水芹烯等16种萜烯类成分。结果表明,不同产地来源的姜黄挥发油存在一定的质量差异,姜黄酮的含量与姜黄切面的颜色直接相关,含量越高,姜黄颜色越深。该研究通过对比24批不同来源的姜黄挥发油成分及其差异物质,为今后姜黄种质资源鉴定和质量评价提供了科学依据,筛选出6种挥发油和姜黄酮类成分含量均较高的优异种质,可用于指导姜黄新品种选育。
关键词:姜黄;挥发油;GC-MS;组学分析;姜黄酮
中图分类号:TS201.1""""" 文献标志码:A"""" 文章编号:1000-9973(2024)09-0167-10
Analysis of Differences of Volatile Oil Components and Content of Turmeric from
Different Resources Based on GC-MS
LIU Meng-ting1,2, WANG Qing-long1, YANG Qing1, WANG Zhu-nian1,3, YAN Xiao-xia1,
TANG Huan1, YUAN Lang-xing1, WANG Mao-yuan1*, FENG Shi-xiu4*
(1.Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/
Identification and Evaluation Center for Tropical Agricultural Wild Plant Gene Resources, Ministry
of Agriculture/Key Laboratory of Biology and Cultivation of Chinese Medicinal Materials, Ministry
of Agriculture and Rural Affairs/Hainan Engineering Research Center for Tropical Medicinal Plants,
Haikou 571101, China; 2.College of Plant Science and Technology, Huazhong Agricultural
University, Wuhan 430070, China; 3.Sanya Institute of Chinese Academy of Tropical
Agricultural Sciences, Sanya 572000, China; 4.Shenzhen Fairylake Botanical
Garden, Chinese Academy of Sciences, Shenzhen 518004, China)
Abstract: To compare the similarities and differences of volatile oil components of turmeric from different resources, the volatile oils of 24 batches of turmeric samples are extracted by steam distillation method, and the chemical components of each chromatographic peak are separated and identified by gas chromatography-mass spectrometry (GC-MS). Hierarchical cluster analysis (HCA), principal component analysis (PCA) and orthogonal partial least square-discriminant analysis (OPLS-DA) are used to analyze the components of 24 batches of volatile oils and screen the differential metabolites. The results show that the extraction rate of volatile oils of 24 batches of turmeric is 0.30%~1.10%, and 63 components are detected, mainly are turmerones, with the relative content more than 50%, followed by terpenes, with low content and complex composition. The GC-MS fingerprint of volatile oils of turmeric is established with similarity of 0.911~0.997, and seven common peaks are identified. HCA and PCA divide 21 samples into groups A and B, and 19 differential metabolites are screened by OPLS-DA. Cluster heat map analysis shows that the characteristic components of group A are turmerones such as aromatic curcumone, α-curcumone and β-curcumone, and the characteristic components of group B are 16 terpenes such as gingerene, β-bisabolene and β-sesquiphellandrene. The results show that the quality of volatile oils of turmeric from different places of origin is different. The content of turmeric is directly related to the color of turmeric section. The higher the content, the darker the color of turmeric. This study has provided scientific basis for the identification and quality evaluation of turmeric germplasm resources in the future by comparing 24 batches of volatile oil components of turmeric from different sources and their differential substances, and six excellent germplasm with high content of volatile oils and turmerones are selected, which could be used to guide the breeding of new varieties of turmeric.
Key words: turmeric; volatile oil; GC-MS; metabolomics analysis; turmerone
收稿日期:2024-02-12
基金项目:海南省重大科技计划项目(ZDKJ2021001);南锋专项(NFZX2021);中国热带农业科学院热带作物品种资源研究所科技成果转移转化项目(PZS2023001)
作者简介:刘梦婷(1997—),女,硕士,研究方向:药用植物的育种与栽培。
*通信作者:王茂媛(1981—),女,研究员,硕士,研究方向:药用植物资源开发及应用;
冯世秀(1983—),男,副研究员,博士,研究方向:天然产物化学。
姜黄(Curcuma longa L.)是姜科姜黄属多年生草本植物,主产于中国、印度、泰国及其他东南亚国家,在中国主产于四川、广西、广东、云南、福建、台湾等地[1-3]。姜黄是我国大宗中药材之一,具有破血行气、通经止痛等功效[4],在东南亚国家主要作为香料和染料。挥发油类和姜黄素类是其主要活性成分,现代药理学研究表明,姜黄具有抗肿瘤、抗炎、抗氧化、抑菌、护肝、降血脂等作用[5-8]。姜黄种质资源丰富,药效成分种类和含量差异显著。为了提高姜黄临床用药的有效性和安全性,有必要对不同资源姜黄的药效成分进行比较。
挥发油是姜黄的重要功效物质,现有的文献大多对姜黄挥发油含量和组成的比较开展研究[9-11],但对不同种质资源姜黄挥发油的研究较少。在数据处理方面,前人的文献多采用气相色谱-质谱联用(GC-MS)的指纹图谱进行相似度评价,缺乏不同姜黄挥发油之间的化学差异性与差异物质的分析与鉴定。代谢组学分析手段不仅可以通过散点图获得样品之间的聚类分组情况,而且可以通过载荷图、多元统计分析手段筛选鉴定样品之间的差异成分。近年来,基于GC-MS技术的代谢组学方法已成功应用于温郁金、宽叶羌活等多种中药材的挥发性成分分析[12-13]。本试验拟采用基于 GC-MS 的代谢组学技术,全面综合评价不同资源姜黄挥发油之间的差异并寻找差异代谢物,为姜黄的资源鉴定和质量评价提供了参考。
1 材料与方法
1.1 试验材料
试验所用样品24批姜黄种质资源采集自四川、广西、云南、广东、海南、西藏等地及东南亚国家,保存于海南省儋州市农业农村部(儋州)热带药用植物种质资源圃,于2022年3月统一种植管理,2022年12月天气晴好时采收,洗净切片,烘干打粉。经中国热带农业科学院王祝年研究员鉴定为姜科(Zingiberaceae)姜黄属(Curcuma L.)植物姜黄(Curcuma longa L.),样品信息见表1。
1.2 仪器与试剂
Agilent HP6890-5975C气相色谱-质谱联用仪、Agilent 1100 HPLC 美国安捷伦公司;TM-500型数字控温电热套 海宁市华兴仪器厂;AUW220D型电子天平 日本岛津公司;SL-200型高速多功能粉碎机 浙江松青五金厂。
正己烷、C7~C40正构烷烃混合标准溶液、无水硫酸钠(分析纯)、芳姜黄酮标准品(芳姜黄酮98%,生产批号:221229):成都植标化纯生物技术有限公司。
1.3 试验方法
1.3.1 挥发油的提取
取适量药材粉碎,过80目筛,称取10.00 g置于500 mL圆底烧瓶中,加入300 mL水振荡摇匀,加入数粒玻璃防爆珠;连接挥发油提取器与回流冷凝管,置于电加热套中缓慢加热至沸腾,并保持微沸6 h,至测定器中挥发油含量不再增加时停止加热,读取挥发油含量并收集,加入少量无水硫酸钠脱水,得到的淡黄色透明液体,置于离心管中于4 ℃保存备用。每个样品重复提取3次,挥发油提取得率(%)取平均值。
1.3.2 样品处理
用移液枪吸取适量经干燥的挥发油样品,溶于1.5 mL正己烷溶液中,用0.22 μm滤膜过滤,得到供试品溶液。
1.3.3 气相色谱-质谱联用分析
气相色谱条件:HP-5MS弹性石英毛细管柱(60 m×0.25 mm×0.25 μm);初始温度80 ℃,以5 ℃/min升温至310 ℃;运行时间46 min;气化室温度250 ℃;载气为高纯He(99.999%);柱前压19.24 psi,载气流量1.0 mL/min,分流比100∶1,溶剂延迟时间6 min。
质谱条件:离子源为EI源;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 718 V;接口温度280 ℃;质量扫描范围29~500 amu。
1.4 数据处理
用GC-MS进行分析处理,对总离子流图中各峰经质谱计算机数据系统检索及核对NIST 20和Wiley 275标准质谱图,确定了挥发性化学成分,用峰面积归一化法测定了各化学成分的相对质量分数。利用中药色谱指纹图谱相似度评价系统软件计算相似度;通过SPSS 26.0统计软件系统聚类,然后导入SIMCA 14.1软件进行HCA、PCA、OPLS-DA分析。
2 结果与分析
2.1 姜黄挥发油提取得率
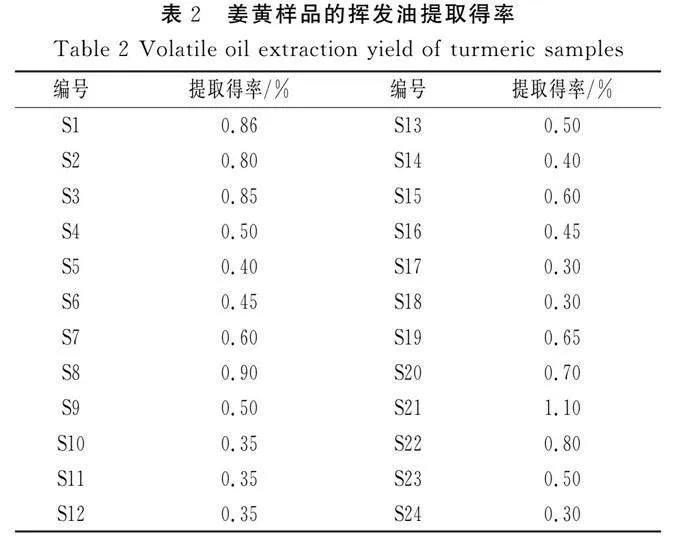
采用水蒸气蒸馏法提取姜黄挥发油,所得油体呈淡黄色透明状,气味浓郁。各产地姜黄样品挥发油含量见表2。
由表2可知,挥发油提取得率在0.30%~1.10%,不同样品之间差异较大,S21挥发油提取得率最高,S24挥发油提取得率最低,最高提取得率是最低提取得率的近4倍。
2.2 姜黄挥发油成分分析
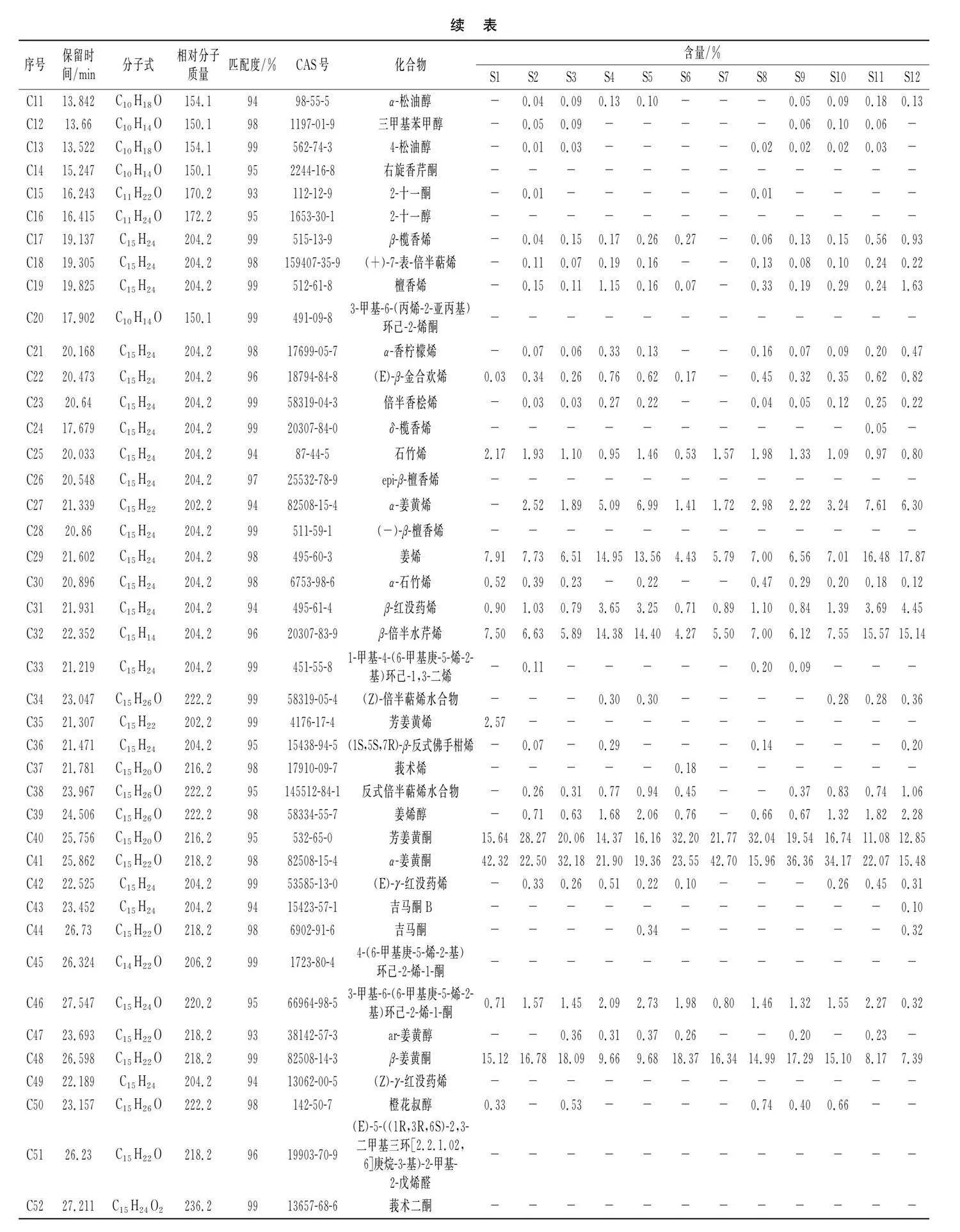
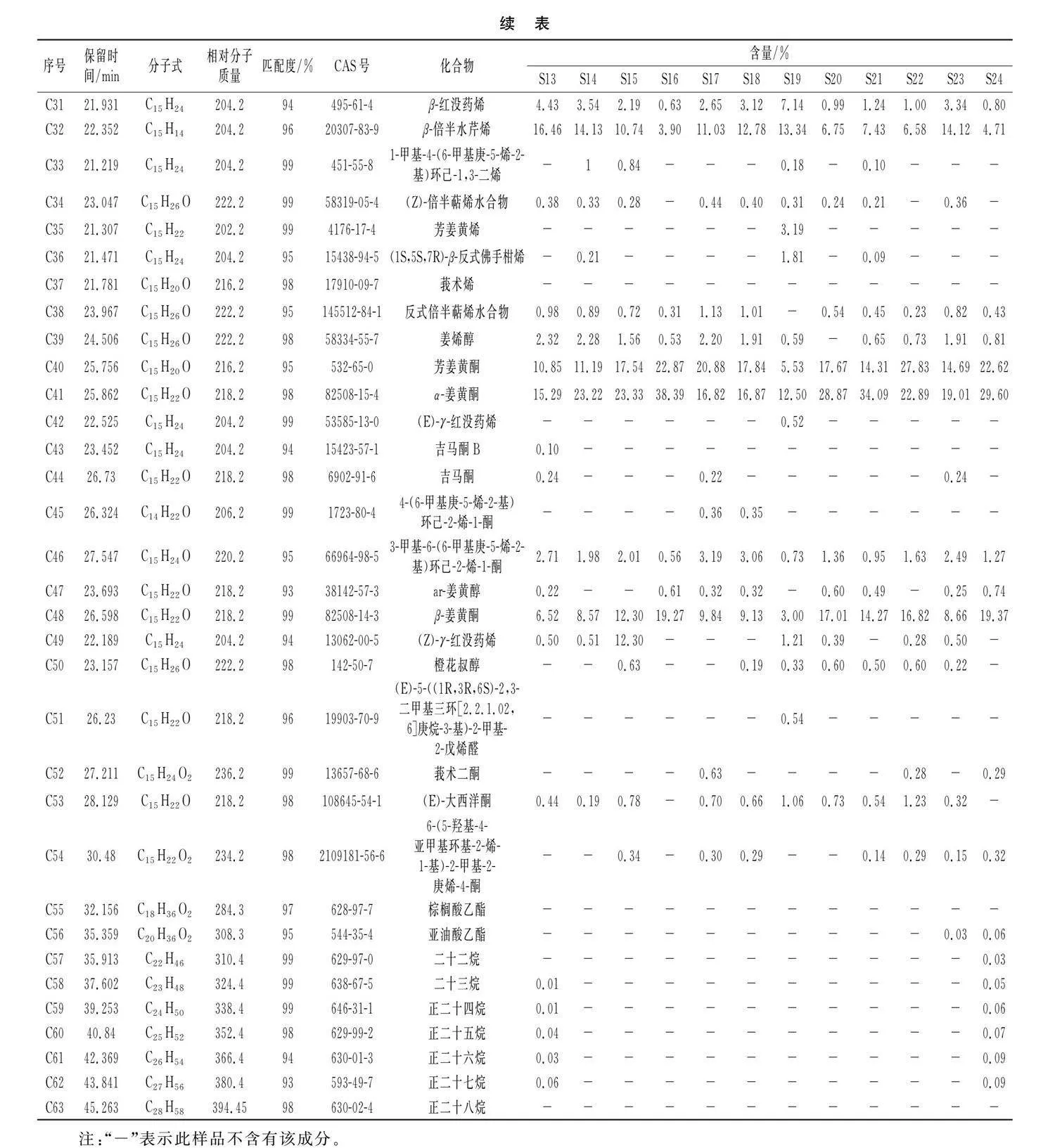
由表3可知,经GC-MS分析结果,从24批姜黄样品挥发油中鉴别出63种化学成分(匹配度均大于90%),相对分子质量在136~394之间(见表3),主要以姜黄酮类和萜烯类成分为主。由表3可知,24批样品挥发油中相对含量均较高的化合物有7种,其平均含量由大到小为α-姜黄酮(25.39%)gt;芳姜黄酮(18.52%)gt;β-姜黄酮(12.99%)gt;姜烯(10.26%)gt;β-倍半水芹烯(9.66%)gt;β-红没药烯(2.24%)gt;3-甲基-6-(6-甲基庚-5-烯-2-基)环己-2-烯-1-酮(1.67%)。一些化学成分仅在个别姜黄样品挥发油中检测出微量,例如芳姜黄烯在S1(2.57%)和S19(3.19%)中检测出;莪术烯仅在S6(0.18%)中检测出;吉马酮在S5(0.34%)、S12(0.32%)、S13(0.24%)、S17(0.22%)和S23(0.24%)中检测出,这些成分的差异可能与姜黄种质资源产地来源相关。
2.3 GC-MS指纹图谱的建立及相似度评价
将姜黄样品挥发油色谱数据建立数据表,导入中药色谱指纹图谱相似度评价系统(2012版),建立24批姜黄挥发油叠加GC-MS指纹图谱,结果见图1。以姜黄S2为参考图谱计算相似度,结果见表4。24批姜黄样品的相似度在0.911~0.997之间,有12个样品的相似度大于0.95,5个样品S1、S12、S14、S19和S24的相似度小于0.93,分别为0.925(S1),0.911(S12),0.927(S14),0.926(S19),0.919(S24),表明不同产地来源的姜黄样品挥发性物质存在差异。设定时间窗宽度为0.1 min,采用中位数法进行多点校正和Mark峰匹配,建立指纹图谱共有模式,标定共有峰,结果见图2。共标定7个共有峰,分别为1号峰姜烯、2号峰β-红没药烯、3号峰β-倍半水芹烯、4号峰芳姜黄酮、5号峰α-姜黄酮、6号峰β-姜黄酮、7号峰3-甲基-6-(6-甲基庚-5-烯-2-基)环己-2-烯-1-酮。
2.4 HCA
采用SPSS 26.0统计软件进行聚类分析,运用中位数聚类法的平方欧氏距离,采用组间连接法,得到聚类结果(见图3)。当类距为16时,24批姜黄样品挥发油可聚类为3类:S19为Ⅰ类,S12和S24为Ⅱ类,其余21批样品为Ⅲ类。
由HCA图结合挥发油成分的组成和含量(见表2)分析可知,24批样品中S19挥发油中檀香烯的含量高达10.60%,远高于其他产地,因此系统聚类将其单独聚为一类;S12和S24挥发油中含有烷烃类成分,因此系统聚类将其聚为一类。而其余21批样品挥发油化合物种类和含量相似,因此系统聚类将其归为一类。当类距为14时,Ⅲ类样品又可以分为 A和B两小类,其中样品S1、S2、S3、S6、S7、S8、S9、S10、S16、S20、S21、S22聚为A类,分析发现这12批样品姜黄酮类成分含量均高于其他资源。S4、S5、S11、S13、S14、S15、S17、S18、S23归为B类,分析发现这9批样品萜烯类成分含量均较高,并以S4、S11、S13、S23样品中含量最高。以上结果表明聚类分析可在一定程度上区分不同产地来源的姜黄样品,推测产地会造成姜黄挥发油成分存在差异。
2.5 PCA
将24批样品的GC-MS数据导入SIMCA 14.1软件,以鉴定的63种化合物的相对含量为变量,对24批姜黄挥发油进行主成分分析(PCA)。以特征值大于1为提取标准,得到两个主成分(PC1和PC2),PC1为第一主成分,方差贡献率为55.81%,PC2为第二主成分,方差贡献率为16.12%,PC1和PC2的累计贡献率达71.93%,可以有效地表征数据原始信息。以PC1和PC2为坐标系进行投影,得到24批姜黄样品的PCA得分散点图,见图4中A。由图4中A可知,24批姜黄样品可以分为两组,其中S4、S5、S11、S12、S13、S14、S15、S17、S18、S23聚集在PC1轴的右侧,其余样品聚集在PC1轴的左侧。S19样品相对于总体姜黄样品呈明显的分离趋势。
2.6 OPLS-DA
由HCA图(见图3)可知,当类距为14时,Ⅱ类和Ⅲ类样品均可以区分开。PCA图(见图4中A)不能将Ⅱ类和Ⅲ类样品区分开,但可将Ⅲ类样品分为A组(S1、S2、S3、S6、S7、S8、S9、S10、S16、S20、S21、S22)和B组(S4、S5、S11、S13、S14、S15、S17、S18、S23),与聚类分析结果相同。因此,为了进一步寻找不同样品的差异代谢物,在PCA的基础上建立Ⅲ类样品A组和B组的OPLS-DA模型,提供更准确的结果并提高模型的预测能力和精度。OPLS-DA得分图(见图4中B)的R2X=0.388,R2Y=0.957,Q2=0.837,表明该模型的稳定性良好,可用于两组差异性挥发性成分的筛选。
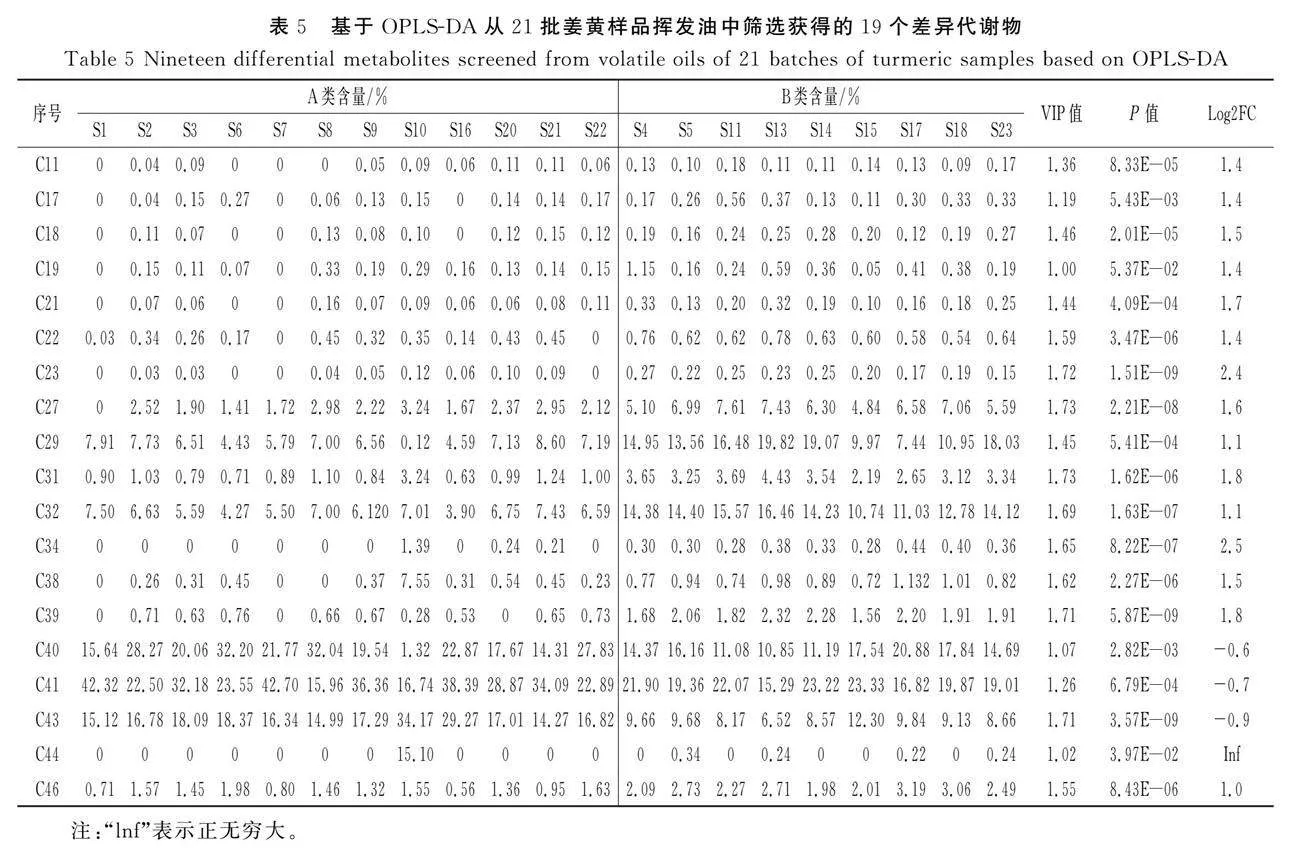
通过对OPLS-DA模型进行统计和变量重要性投影(variable importance in the projection,VIP)分析。VIP值越高,则相应成分对组间质量差异的影响越大,根据VIPgt;1且Plt;0.05筛选差异代谢物,共得到19种差异代谢物,其中来源于A组的差异代谢物包括芳姜黄酮(C40)、α-姜黄酮(C41)和β-姜黄酮(C48),3个差异成分的Log2FC分别为-0.6,-0.7,-0.9,因其总姜黄酮的含量已达到50%以上,也认定为差异代谢物。来源于B组的差异代谢物包括α-松油醇(C11)、β-榄香烯(C17)、(+)-7-表-倍半萜烯(C18)、檀香烯(C19)、α-香柠檬烯(C21)、(E)-β-金合欢烯(C22)、倍半香桧烯(C23)、α-姜黄烯(C27)、姜烯(C29)、β-红没药烯(C31)、β-倍半水芹烯(C32)、(Z)-倍半萜烯水合物(C34)、反式倍半萜烯水合物(C38)、姜烯醇(C39)、吉马酮(C44)、3-甲基-6-(6-甲基庚-5-烯-2-基)环己-2-烯-1-酮(C46),差异物质的Log2FC均大于1,说明这些成分造成了21批姜黄挥发油的质量差异,是A组和B组样品的主要标志性成分(见表4)。
根据筛选出来的19个差异代谢物在21批不同资源姜黄样品中的百分含量进行代谢物和种质两个维度的聚类热图分析,见图4中C,热图中横坐标代表不同资源姜黄种质,纵坐标代表差异代谢物。由图4中C可知,A组样品中芳姜黄酮(C40)、α-姜黄酮(C41)和β-姜黄酮(C48)的含量明显高于B组,而B组样品中姜烯(C29)、β-红没药烯(C31)和β-倍半水芹烯(C32)等萜类物质的含量高于A组。结果表明,19种差异代谢物可以很好地将A组和B组区分开,也是其挥发油的特征性成分,能够体现姜黄资源的品质。
3 讨论与结论
姜黄为传统药食两用中药材,挥发油、姜黄素等主要成分具有广泛的药理活性,具有较高的研究价值和广阔的应用前景[14]。气相色谱-质谱联用技术(GC-MS)已广泛应用于检测中药材的挥发性成分,具有分辨能力高、灵敏度高和分析过程简便快捷的特点,因此是中药材挥发性成分品质鉴定最常用且最有利的工具之一[15],与化学计量学方法结合广泛应用于中药材品种鉴别和品质鉴定[16-18]。
本研究收集了24批集中种植采收的不同产地来源的姜黄样品,采用水蒸气蒸馏法提取挥发油,其中挥发油提取得率在0.30%~1.10%之间。根据《中国药典》2020版规定,中药姜黄挥发油提取得率≥7%,因此姜黄挥发油含量高的广东阳江S1、海南儋州S2、海南儋州S3、广西防城港S8、西藏墨脱S21、泰国S22可作为挥发油提取的优选资源,剩余产地的姜黄中挥发油含量低,从含量角度评价,不符合《中国药典》的标准,不具备开发潜力。由于不同种质姜黄资源产地来源不同,其成分和含量存在显著差异,但根据分析并未发现产地与挥发性成分之间的地域相关性,而表现为个体之间的差异。本研究进一步筛选出广东阳江S1、海南儋州S2、海南儋州S3、云南保山S6、广西百色S7、广西防城港S8、广西防城港S9、四川犍为S10、广西南宁S16、西藏墨脱S20、西藏墨脱S21、泰国S22、广西桂林S24产地来源姜黄中姜黄酮类化合物含量高的优良种质(总姜黄酮含量gt;60%)。
对24批姜黄样品挥发油成分进行GC-MS分析,共鉴定出63种化学成分,主要以单萜类和倍半萜类为主。通过指纹图谱相似度评价,24批样品中的共有成分为7种,均为姜黄中平均相对含量较高的化合物,主要有α-姜黄酮、芳姜黄酮、β-姜黄酮、姜烯、β-倍半水芹烯,这一结果与先前研究得出的α-姜黄酮、姜烯、β-姜黄酮为姜黄块根和根茎挥发油主要成分的结果一致[19]。借助HCA和PCA发现,福建诏安S12、广东茂名S19和广西桂林S24样品相较于其他样品的化学成分差异明显,其余样品按照产地的来源可以分为两组。通过OPLS-DA和热图分析其余21批样品的差异代谢物,最终筛选出姜黄酮类和萜烯类成分分别是两组的特征性成分。本研究也注意观察了不同资源姜黄根茎的横切面,可以分为橙红色、橙色和橙黄色3种。结合剖面颜色发现,芳香酮类化合物含量高的根茎断面颜色深,呈现橙色至橙红色;反之烯烃类物质含量高的颜色稍浅,呈现橙黄色。结果也进一步表明,姜黄的颜色与挥发油中所含有的姜黄酮类成分含量的高低有直接关系。
现代药理研究表明,姜黄挥发油具有抗菌[20]、抗肿瘤[21]、抗炎[22]、抗氧化、抗病毒、降血脂、镇痛等多种药理作用[23]。芳姜黄酮(ar-turmerone)作为姜黄挥发油的主要成分,属于倍半萜类成分,同样具有抗细菌、抗真菌、抗血小板、抗氧化、预防老年痴呆、抗代谢综合征、诱导肿瘤细胞凋亡等药理作用。本研究筛选出了挥发油含量和姜黄酮含量均较高的姜黄,为后期姜黄资源的开发奠定了基础。
综上所述,本研究利用GC-MS技术结合代谢组学分析比较了不同种质资源姜黄的挥发油含量、化学成分、相似度和差异性代谢物,发现不同资源姜黄挥发油的化学物质主要为姜黄酮类成分,含量差异较大,其次为萜烯类物质,组成和含量均差异明显。研究明确了姜黄酮类和萜烯类是不同资源姜黄的差异性成分,并揭示了姜黄酮的含量与姜黄根茎的颜色直接相关。本研究将为今后姜黄种质资源鉴定和质量评价提供科学依据,最终筛选出6种挥发油和总姜黄酮含量均较高的姜黄种质资源,可为后续品质选育提供优异种质,指导培育新品种。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1981:62-64.
[2]蔡永敏,郭文静,郝鹏飞.姜黄原植物的考证[J].中草药,2016,47(1):183-186.
[3]梁恒,邓家彬,童珊珊,等.我国姜黄属植物的系统关系研究进展[J].分子植物育种,2019,17(11):3695-3702.
[4]国家药典委员会.中华人民共和国药典:2020年版.一部[M].北京:中国医药科技出版社,2020:276.
[5]SINGH V, JAIN M, MISRA A, et al. Curcuma oil ameliorates hyperlipidaemia and associated deleterious effects in golden Syrian hamsters[J].The British Journal of Nutrition,2013,110(3):437-446.
[6]付兴会,林连美.中药姜黄主要有效成分药理学研究进展[J].湖北中医药大学学报,2015,17(4):109-110.
[7]李丹丹.姜黄挥发油生物活性及其萜类合成酶基因表达调控[D].泉州:华侨大学,2020.
[8]JIN F Q, CHEN X Q, YAN H, et al. Bisdemethoxycurcumin attenuates cisplatin-induced renal injury through anti-apoptosis, anti-oxidant and anti-inflammatory[J].European Journal of Pharmacology,2020,874:173026.
[9]羊青,晏小霞,王茂媛,等.不同产地姜黄挥发油的化学成分及其抗氧化活性[J].中成药,2016,38(5):1188-1191.
[10]潘春林,范恒.姜黄挥发油成分气相指纹图谱研究[J].湖北中医药大学学报,2018,20(4):52-55.
[11]强悦越,韦航,方灵,等.福建姜黄挥发油化学成分的HS-SPME-GC-MS分析[J].中国食品添加剂,2020,31(1):147-153.
[12]唐国琳,雷雨恬,夏静,等.野生与栽培宽叶羌活不同部位挥发油成分的GC-MS分析[J].中药材,2019,42(12):2838-2842.
[13]汤璐璐,孙贝贝,李小宁,等.基于GC-MS技术比较分析温郁金源一株三药中挥发油成分[J].中药材,2021,44(7):1675-1679.
[14]郭芳,顾哲,贾训利,等.药用植物姜黄的研究进展[J].安徽农业科学,2022,50(16):14-19.
[15]宇家仪,郝依萌,马璟.GC-MS技术的应用研究进展[J].中国医药工业杂志,2022,53(12):1689-1698.
[16]杨雨,张莉,刘东,等.基于GC-MS分析不同基原车前草挥发油成分的异同[J].天然产物研究与开发,2023,35(7):1172-1182.
[17]章莎莎,邢婕,李震宇,等.基于GC-MS代谢组学技术对不同品种柴胡挥发油的研究[J].中国实验方剂学杂志,2014,20(12):84-87.
[18]邓静,吴婷芬,钟楚楚,等.基于GC-MS和化学计量学的岭南红脚艾与传统艾叶挥发油成分的比较研究[J].中国中药杂志,2023(23):6334-6346.
[19]QIANG Y Y, SI R R, TAN S, et al. Spatial variation of volatile organic compounds and antioxidant activity of turmeric (Curcuma longa L.) essential oils harvested from four provinces of China[J].Current Research in Food Science,2021,4(10):882-890.
[20]公衍玲,王宏波,金宏.郁金挥发油提取工艺及其抑菌活性研究[J].医药导报,2009,28(2):170-172.
[21]赵明明,卢彩会,牟德华.姜黄挥发油诱导肺癌细胞凋亡及机理研究[J].食品研究与开发,2019,40(23):98-104.
[22]TODEN S, THEISS A L, WANG X, et al. Essential turmeric oils enhance anti-inflammatory efficacy of curcumin in dextran sulfate sodium-induced colitis[J].Scientific Reports,2017,7(1):814.
[23]JYOTIRMAYEE B, GYANRANJAN M. A review on selected pharmacological activities of Curcuma longa L.[J].International Journal of Food Properties,2022,25(1):1377-1398.

