赤小豆多糖提取工艺、改性及其特性研究






摘要:该研究以赤小豆为原料,采用超声辅酶法和水提醇沉工艺提取赤小豆胞内多糖,优化提取工艺,并通过超声波对其进行改性。研究改性前后赤小豆胞内多糖的抗氧化特性以及对果蔬的冷藏保鲜作用,以拓展其应用领域。研究结果表明,赤小豆多糖提取的最佳工艺条件为超声时间50 min、水提温度70 ℃、水提时间200 min、复合酶处理温度47 ℃,在此条件下,多糖提取率可达4.33%。赤小豆多糖体外抗氧化试验结果表明,改性赤小豆多糖对·OH、DPPH·、ABTS+·的清除率分别为88.35%、83.67%、58.82%,比改性前分别提高了18.1%、17.4%、14.87%。多糖改性前后对草莓的冷藏保鲜试验结果显示,其保鲜能力排序为3%改性赤小豆多糖组>1%改性赤小豆多糖组>3%赤小豆多糖组>1%赤小豆多糖组。因此,该研究采用的提取工艺对赤小豆多糖的提取率较高,改性后的多糖对自由基的清除率明显高于改性前。改性前后的赤小豆多糖对草莓均具有保鲜效果,而改性后赤小豆多糖的保鲜效果优于改性前。
关键词:多糖;赤小豆;提取工艺;抗氧化活性;果蔬保鲜
中图分类号:TS201.1 """""文献标志码:A """"文章编号:1000-9973(2024)09-0015-08
Study on Extraction Technology, Modification and Characteristics of
Polysaccharides from Vigna umbellata
PEI Xiao-qian1, ZHANG Yun-zhe1, LI Zi-kun2, XU Hui3, LI Dong-xiao4, ZHANG Wei1,5,6*
(1.College of Food Science and Technology, Hebei Agricultural University, Baoding 071001, China;
2.Hebei Agricultural University, Baoding 071001, China; 3.Department of Science and
Engineering, Hebei Agricultural University, Cangzhou 061100, China; 4.College of
Agronomy, Hebei Agricultural University, Baoding 071001, China; 5.College of
Life Sciences, Hebei Agricultural University, Baoding 071001, China;
6.Hebei Key Laboratory of Analysis and Control for Zoonotic
Pathogenic Microorganism, Baoding 071001, China)
Abstract: In this study, with Vigna umbellata as the raw material, intracellular polysaccharides are extracted from Vigna umbellata by ultrasonic-assisted enzymatic method and water extraction and ethanol precipitation technology. The extraction technology is optimized, and the polysaccharides are modified" through ultrasonic wave. In order to expand the application fields, the antioxidant properties of" intracellular polysaccharides
from Vigna umbellata and their refrigerated preservation effects on fruits and vegetables before and after modification are studied. The results show that the optimal technology conditions for the extraction of polysaccharides from Vigna umbellata are ultrasonic time of" 50 min, water extraction temperature of 70 ℃, water extraction time of 200 min and compound enzyme treatment temperature of 47 ℃. Under such conditions, the extraction rate of polysaccharides is 4.33%. The results of antioxidation test in vitro show that the scavenging rates of modified Vigna umbellata polysaccharides on ·OH, DPPH·, ABTS+ · are 88.35%, 83.67%, 58.82% respectively, which are 18.1%, 17.4%, 14.87% higher than those before modification respectively. The results of cold storage preservation test of polysaccharides on strawberries before and after modification show that the order of their preservation ability is 3% modified Vigna umbellata polysaccharides groupgt;1% modified Vigna umbellata polysaccharides groupgt;3%" Vigna umbellata polysaccharides groupgt;1% Vigna umbellata polysaccharides group. Therefore, the extraction rate of Vigna umbellata polysaccharides is relatively high by using the extraction technology in this study, and the free radical scavenging rates of modified polysaccharides are significantly higher than those before modification. The Vigna umbellata polysaccharides before and after modification both have preservation effect on strawberries, and the preservation effect of modified Vigna umbellata polysaccharides is better than that before modification.
Key words: polysaccharides; Vigna umbellata; extraction technology; antioxidant activity; preservation of fruits and vegetables
收稿日期:2024-03-05
基金项目:国家自然科学基金项目(32172288,31371772);河北省自然科学基金重点项目(C2019204342);河北省杂粮杂豆产业技术创新团队质量提升与品牌培育专项(HBCT2023050204);中央引导地方科技发展资金项目(216Z5501G,226Z5503G,236Z5502G);河北省外专百人计划(360-0803-JSN-3YGS);河北农业大学食品加工学科群经费资助(2021-06);河北省重点研究开发计划项目(18275501D);河北省教育厅科研项目(QN2022073);河北省自然科学基金项目(C2019204284)
作者简介:裴肖茜(1999—),女,硕士研究生,研究方向:杂粮杂豆精细化。
*通信作者:张伟(1963—),男,教授,研究方向:食品安全。
赤小豆,也被称为红小豆,原产于中国,是杂粮中经济价值最高的作物[1]。赤小豆具有抗菌、抗氧化、降血糖等药理作用[2],含有丰富的蛋白质和碳水化合物,以及少量的矿物质和多种膳食纤维[3],被列为药食同源作物[4]。天然多糖由一系列具有不同理化性质和生理功能的组分组成,具有多种生理功效,除具有传统的抗氧化活性外,还具有抗肿瘤、调节免疫力、防腐保鲜等功能,其优异的功能特性已应用于食品和医药领域[5],具有广阔的应用前景[6]。
目前天然多糖的提取率普遍较低,且天然多糖结构组成复杂未知,因此对多糖提取工艺进行研究,对其进一步应用尤为关键。酶辅助提取法是一种常见的多糖提取方法,利用酶加速细胞壁或细胞膜结构的破坏,使多糖更好地溶出细胞,提高多糖提取率[7],如Tang等[8]采用酶辅助法提取黄芪粗多糖的产率明显高于其他提取方法[9]。超声辅助提取法是通过在超声过程中提高系统温度和压力,加速细胞破碎,加速细胞内多糖溶解,提高多糖提取效率,耗时短,提取率高。目前多糖提取应用较广泛的是采用超声法和酶法辅助提取多糖,王庆等[10]采用热水浸提法、超声辅助提取法和酶法3种方法提取天麻多糖,结果表明,酶法和超声辅助提取法的多糖提取率较高,且抗氧化性强于热水提取法。
由于天然多糖的生物活性相对较差,常采用多糖改性的方法来增强其生物活性[11]。采用超声波改性多糖,通过多糖颗粒附近的压力梯度,利用其剪切力破坏其结构[12],与其他降解方法相比,超声处理具有绿色、快速、节能和环保的优势[13],如Xu等[14]采用超声波改性的灵芝天然多糖表现出更均匀的颗粒结构,抗氧化活性显著提高。
目前研究人员已经从植物中提取得到了多种天然多糖,具有良好的抗氧化性,发展潜力较大。目前关于赤小豆多糖提取和特性研究的文献未见报道,为充分开发赤小豆多糖这一资源,本研究拟采用超声复合酶法结合水提醇沉法提取赤小豆多糖,并利用超声波对其进行改性。进一步研究赤小豆多糖改性前后的体外抗氧化活性以及对草莓的保鲜能力,以评估其功能特性和作用,旨在找到一种绿色高效的赤小豆多糖提取和改性工艺,以期获得功能特性更佳的赤小豆多糖,并拓展其应用领域,为未来赤小豆多糖的应用提供了参考依据。
1 材料与方法
1.1 材料与试剂
赤小豆、草莓:市售;丙酮、石油醚、蒽酮、无水乙醇、氯仿、D-葡萄糖、浓硫酸、盐酸、三氯乙酸、硫代巴比妥酸、VC、淀粉酶(gt;350 U/mg)、纤维素酶(gt;600 U/mg) (均为分析纯):上海麦克林生化科技有限公司;2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT,分析纯);羟自由基、DPPH自由基、ABTS自由基清除能力检测试剂盒:北京索莱宝科技有限公司。
1.2 仪器与设备
WH-861旋涡混合器 太仓市科教器材厂;H2500R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;SPX-250B-Z酶标仪 美国伯腾仪器有限公司;DK-8D三孔电热恒温水槽 上海一恒科学仪器有限公司;KQ2200超声波清洗机 昆山市超声仪器有限公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;ESJ30-5A电子天平 沈阳神宇龙腾天平有限公司。
1.3 方法
1.3.1 赤小豆多糖的提取
将赤小豆研磨、过筛(100目),依次浸泡在丙酮、石油醚和乙醇中,烘干得到赤小豆粉。取适量赤小豆粉按比例(赤小豆粉∶蒸馏水为1∶20)配制成赤小豆匀浆,放入100 W超声波清洗机中超声30 min,向赤小豆匀浆中加入复合酶(淀粉酶∶纤维素酶为1∶1),在40 ℃水浴条件下处理1 h后,放入85 ℃水浴锅中3 h,过滤浓缩后采用Sevage法去除蛋白质。经多次离心后,将无水乙醇加入到最终得到的上清液中,得到乙醇浓度为80%的溶液,将沉淀物溶解冻干后即为赤小豆多糖。
1.3.2 蒽酮-硫酸法测定多糖含量
配制蒽酮硫酸试剂,测定葡萄糖含量,结合酶联免疫检测器,得到标准曲线,测定赤小豆多糖中的总糖含量。
1.3.3 单因素试验
采用预试验确定部分因素条件:超声时间30,40,50,60,70,80 min,水提温度40,50,60,70,80,90 ℃,水提时间140,160,180,200,220,240 min,复合酶处理温度20,30,40,50,60,70 ℃。
1.3.4 响应面试验
以4个因素作为自变量,以多糖提取率为响应值,四因素三水平响应面试验因素及水平为超声时间40,50,60 min,水提温度60,70,80 ℃,水提时间180,200,220 min,复合酶处理温度30,40,50 ℃。
1.3.5 超声改性赤小豆多糖
将赤小豆多糖配制成0.1 g/mL的多糖溶液,在冰水浴条件下放入300 W超声波清洗机中超声20 min,占空比为50%(超声5 s,暂停5 s)。
1.3.6 ·OH清除能力测定
利用Fenton反应原理[15],结合酶联免疫检测器,计算赤小豆多糖对羟基自由基的清除能力。
1.3.7 DPPH·清除能力测定
结合酶联免疫检测器,计算多糖对DPPH自由基的清除能力。
1.3.8 ABTS+·清除能力测定
结合酶联免疫检测器,在抗氧化剂作用下,ABTS+被还原成ABTS,通过在734 nm处的吸光度值测定赤小豆多糖的抗氧化能力。
1.3.9 草莓样品处理
将新鲜草莓分成6组,每组200 g左右,分别用质量浓度为1%和3%的赤小豆多糖水溶液、1%和3%的改性赤小豆多糖水溶液浸泡1 min,然后取出沥干10 min,剩余2组分别作为对照组,用蒸馏水作相同处理,其余1组为不处理的空白对照组,放入4 ℃冰箱中贮存7 d,每隔1~2 d观察草莓的腐烂程度。
1.3.10 草莓腐败率测定
将7组样品每隔1~2 d观察测定一次草莓的腐败率,计算公式如下:
腐败率(%)=∑(X1×S1)X×S×100%。(1)
式中:X1为腐烂级别;S1为该腐烂级别果数;X为腐烂最高级别;S为总果数。
草莓腐烂级别:0级:无腐烂;1级:0~1/4面积腐烂;2级:1/4~1/2面积腐烂;3级:1/2~3/4面积腐烂;4级:3/4~1面积腐烂。
1.3.11 草莓失重率测定
采用差重法测定草莓的失重率,多糖处理7 d,每隔1~2 d称量一次样品的质量。草莓失重率计算公式如下:
失重率(%)=M1-M2M1×100%。 (2)
式中:M1为贮藏前质量(g);M2为贮藏后质量(g)。
1.3.12 草莓VC测定
将VC溶于HCl中,在蒸馏水中等量稀释,在324 nm处用比色法检测吸光度,测定吸光度值,绘制标准曲线[16]。得到线性回归方程:Y=0.057 2X+0.251,R2=0.998 4gt;0.99。
1.3.13 草莓MDA含量测定
将草莓用三氯乙酸研磨均匀后称取提取液的体积,加入5 mL 0.5%硫代巴比妥酸溶液摇匀,水浴10 min后离心,收集上清液,在532,600,450 nm处测量其吸光度值[17]。草莓中MDA含量计算公式[18]如下:
MDA含量=[6.452×(D532 nm-D600 nm)-0.559×D450 nm]×VVs×m。
(3)
式中:V为提取液总体积(mL);Vs为测定用提取液体积(mL);m为草莓鲜重(g)。
1.4 数据处理
试验结果均取3次结果的平均值,响应面数据采用Design-Expert 8.0.6软件处理,采用Origin 2019软件作图。
2 结果与分析
2.1 总糖含量测定结果
采用蒽酮硫酸法得到的D-葡萄糖标准曲线见图1。标准曲线的R2gt;0.99,说明结果真实可信。根据标准曲线计算得到赤小豆多糖的总糖含量为70.32%。
2.2 单因素试验结果
由图2~图5可知,赤小豆多糖提取率先升高后降低。由图2可知,随着超声时间的延长,细胞壁逐渐被破碎,胞内多糖进一步溶解。但在超声50 min后,多糖的主链和支链发生断裂,多糖结构改变,多糖提取率呈现逐渐下降的趋势[19]。
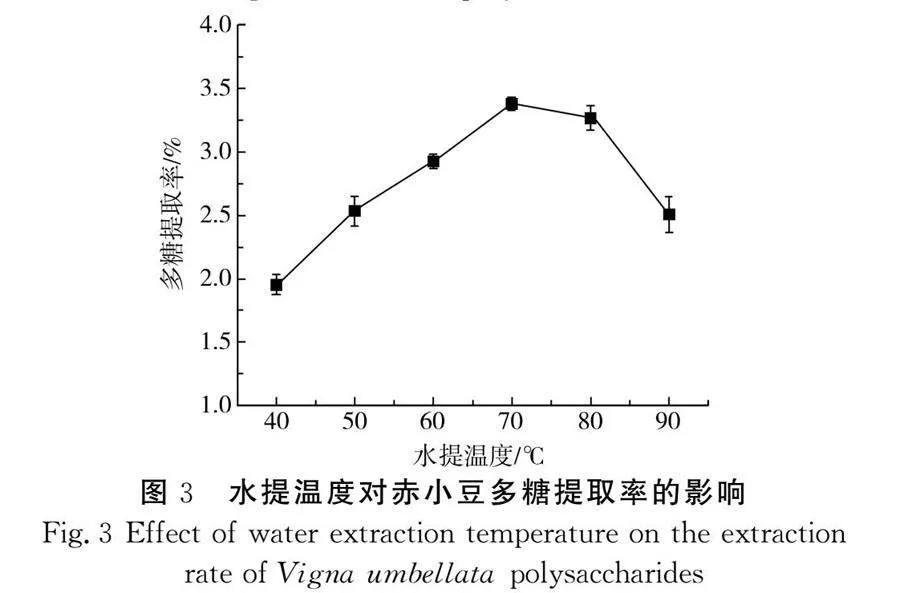
由图3可知,随着水提温度的升高,多糖的溶解度逐渐增大,多糖的提取率逐渐提高。但在温度超过70 ℃后,淀粉发生了糊化,糊化后的淀粉与水的接触面积逐步减小,导致多糖的溶解速率降低,多糖提取率逐渐降低[20]。
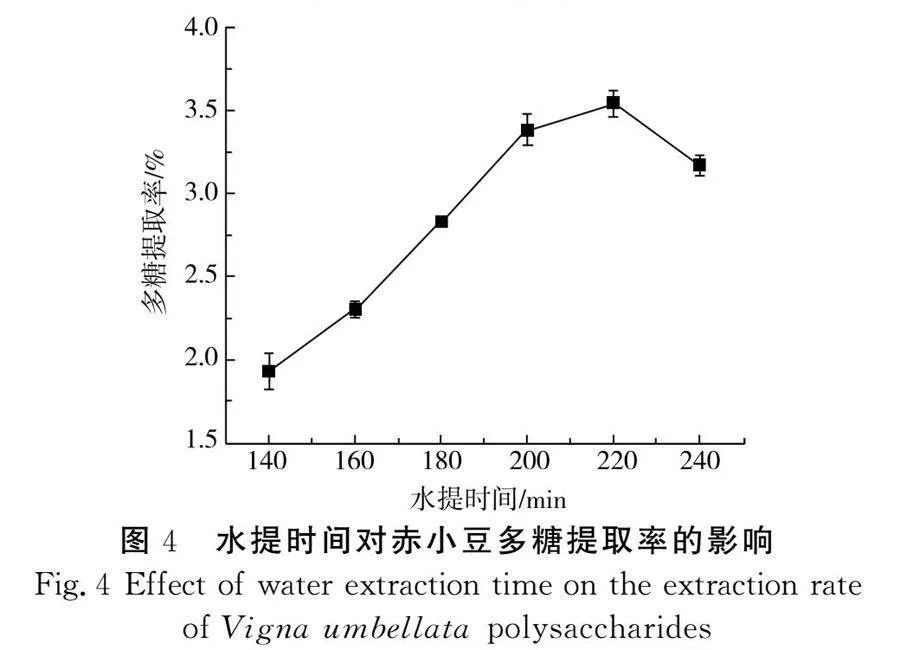
由图4可知,随着水提时间的延长,细胞膜吸水破裂,胞内多糖溶出率增加。但超过220 min后,多糖在高温条件下发生了不同程度的降解,导致多糖提取率出现拐点[21]。
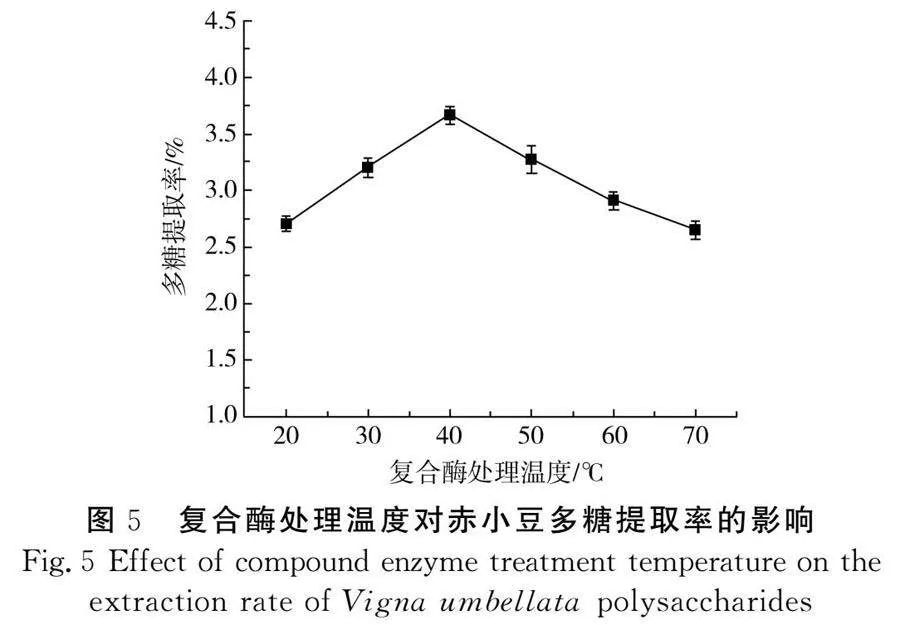
由图5可知,随着复合酶处理温度的升高,逐渐达到复合酶的最适温度,复合酶将植物细胞壁的淀粉和纤维素水解,使多糖提取率升高。但当温度高于40 ℃时,复合酶逐渐出现失活降解,多糖提取率呈下降趋势。
2.3 响应面试验结果
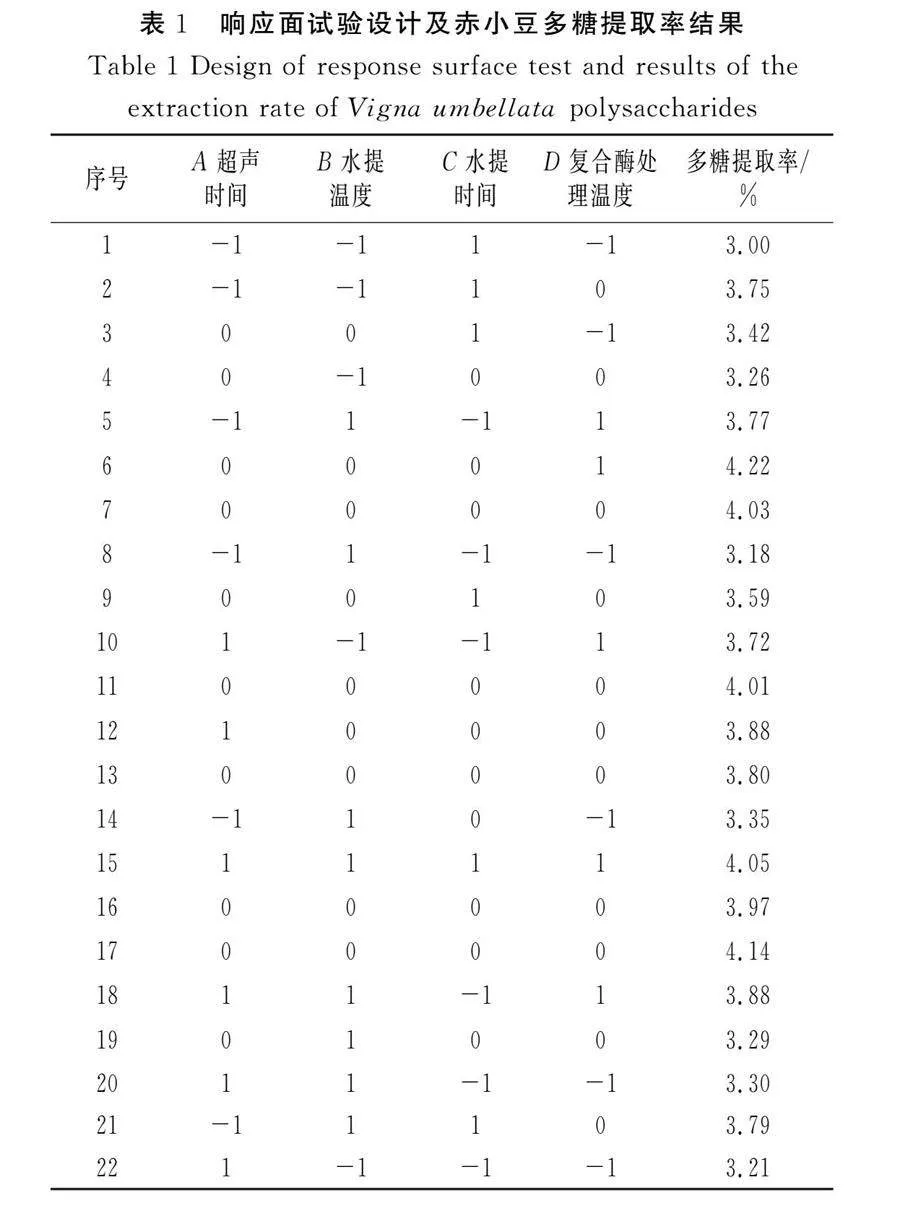
利用Design-Expert 8.0.6软件和Box-Behnken软件共设计29组试验,结果见表1,并对其进行显著性分析和方差分析,见表2。
利用软件对试验结果进行分析,得到赤小豆多糖提取过程的实际影响因素二次多项回归模型方程:多糖提取率=3.99+0.15A+0.12B+0.033C+0.57D-0.015AB+0.036AC-0.14AD+0.022BC-0.060BD-0.038CD-0.23A2-0.74B2-0.068C2-0.40D2。
在此回归模型方程中,二次项的系数均为负数,所以方程有一个最大值。
由表2可知,此回归模型极显著,失拟项的P=0.546 1,不显著,说明模型与检验数据拟合较好。该模型的决定系数R2=0.948 7,与实际试验拟合度为94.87%。该试验设计模型可对赤小豆多糖提取工艺的优化进行理论预测。
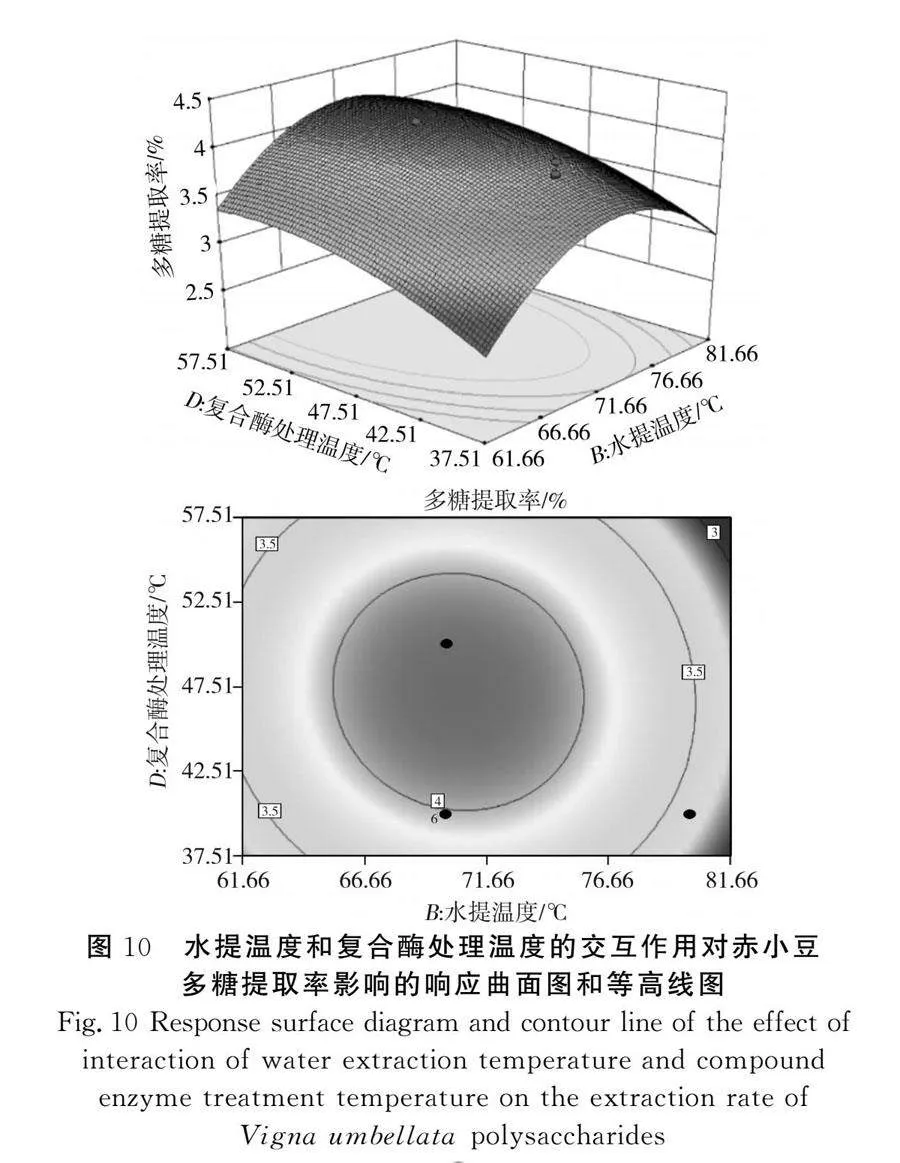
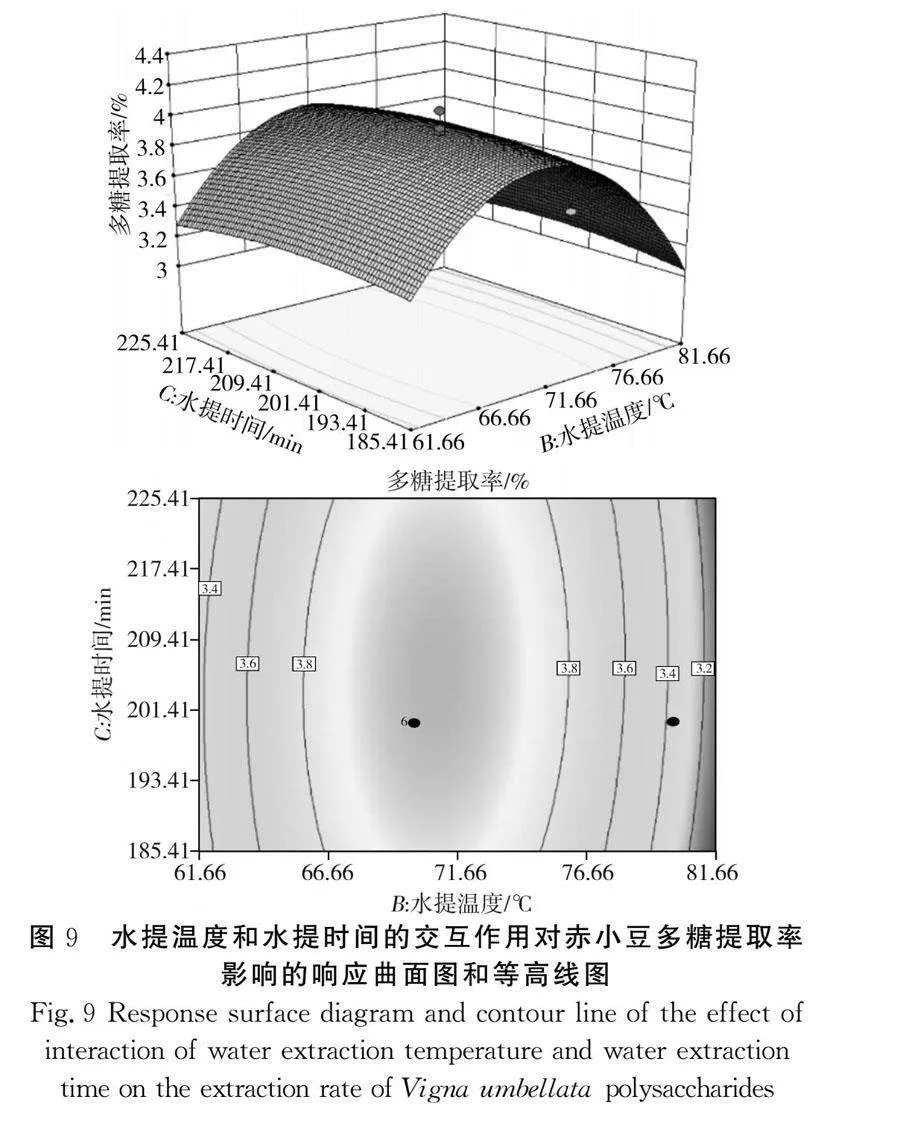
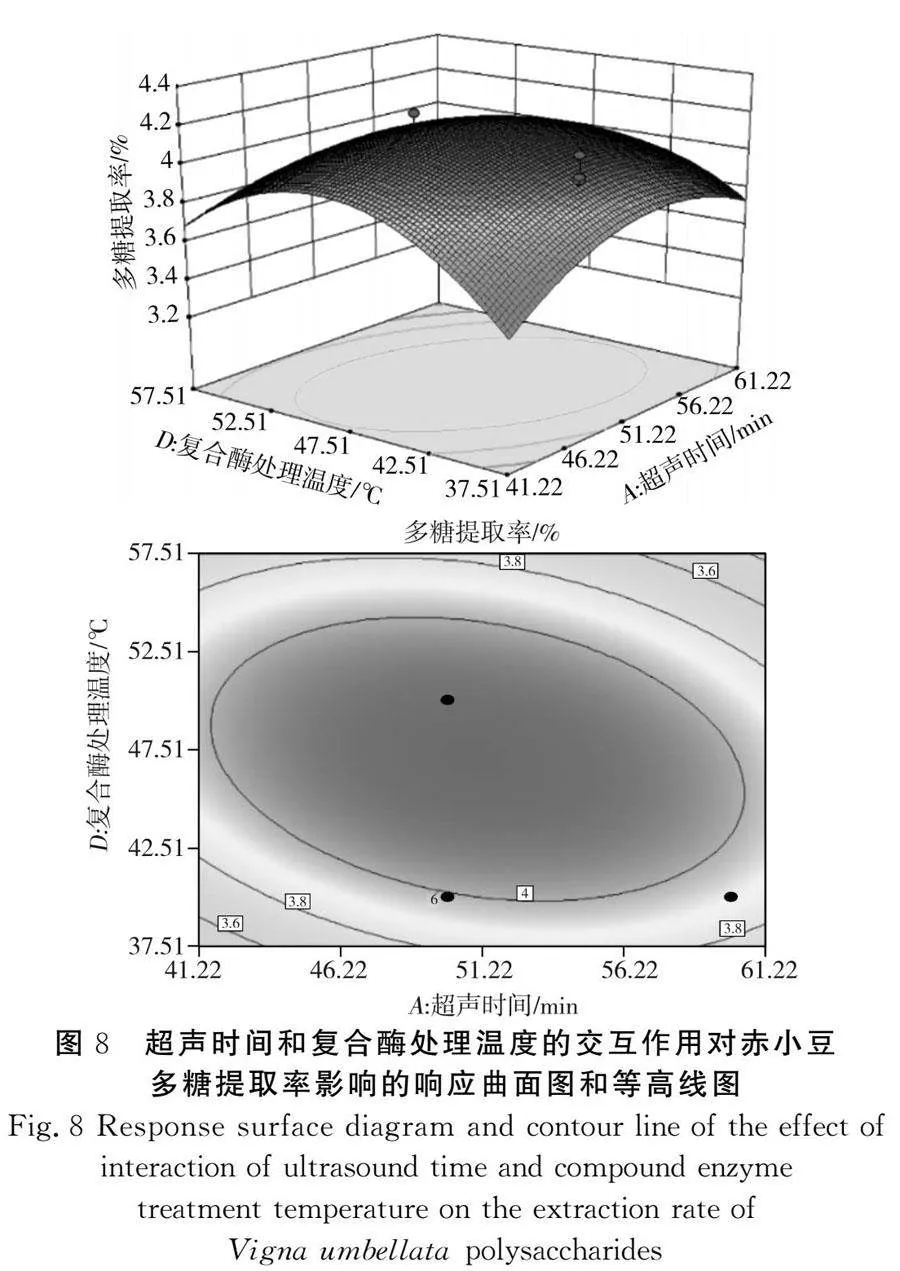
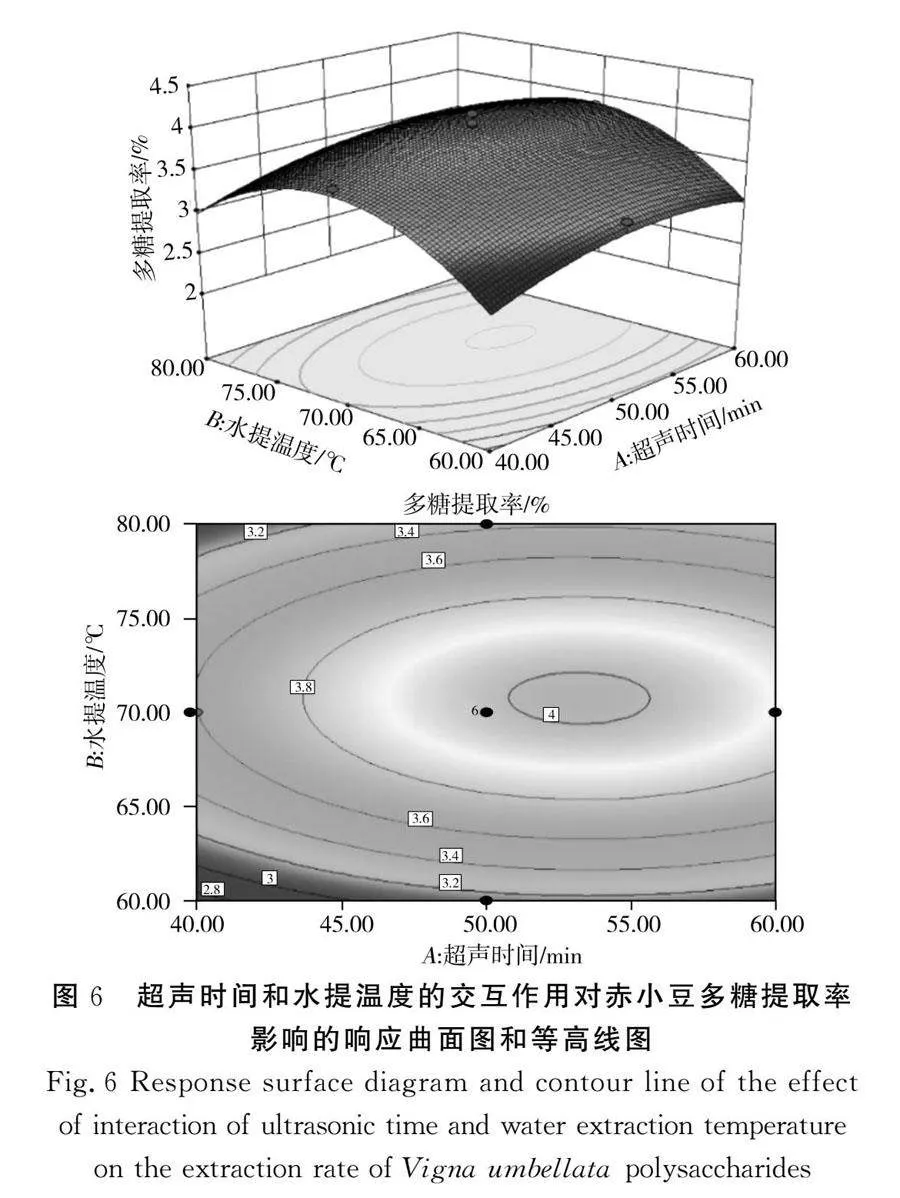
该模型的三维响应面图见图6~图11,任意两因素交互作用的三维图均呈现较陡峭的坡度,且等高线图几乎全为椭圆形,结果表明两两因素之间存在一定的交互作用,多糖提取率存在最大值。
2.4 功能特性测定结果
2.4.1 ·OH清除能力测定结果
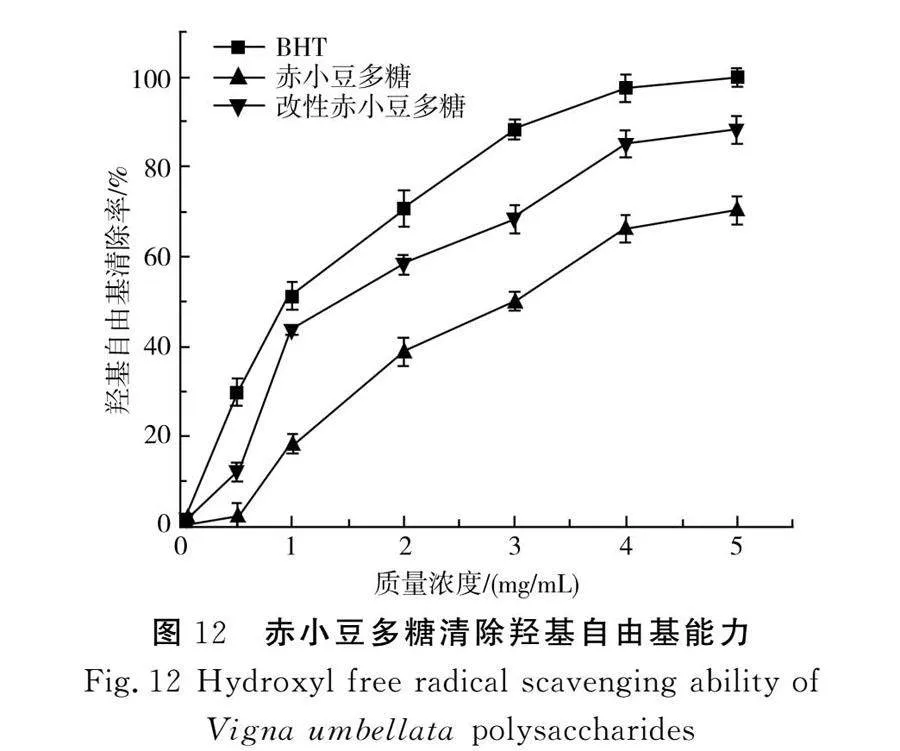
赤小豆多糖对羟基自由基的清除能力见图12。多糖降解程度越高,抗氧化能力越强[22]。将两种赤小豆多糖羟基自由基清除能力与市面上较普遍的食品天然抗氧化剂BHT进行对比。
由图12可知,当质量浓度为0~5 mg/mL时,羟基自由基清除率与多糖质量浓度成正比。当质量浓度为5 mg/mL时,改性赤小豆多糖羟基自由基清除率可达88.35%,虽低于同浓度的BHT,但高于赤小豆多糖,且比改性前的赤小豆多糖提高了18.1%。
2.4.2 DPPH·清除能力测定结果
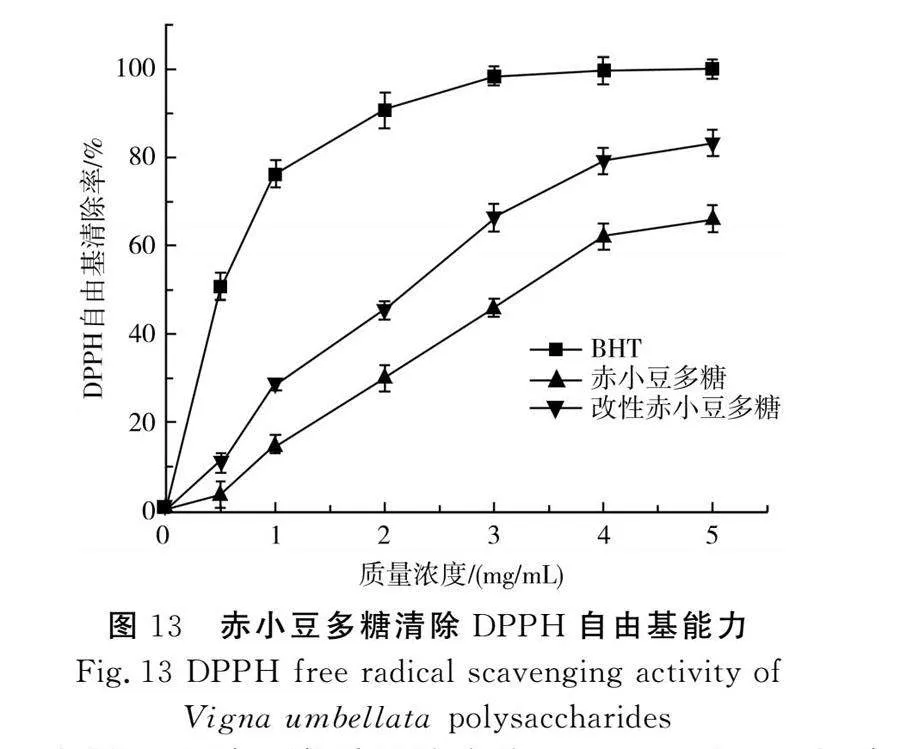
赤小豆多糖DPPH自由基的清除能力见图13。
由图13可知,当质量浓度为0~5 mg/mL时,多糖浓度与DPPH自由基清除率成正比。当质量浓度为5 mg/mL时,改性赤小豆多糖对DPPH自由基的清除率达到最高,为83.67%,虽明显低于同浓度下的BHT,但高于赤小豆多糖,且比改性前的赤小豆多糖提高了17.4%。
2.4.3 ABTS+·清除能力测定结果
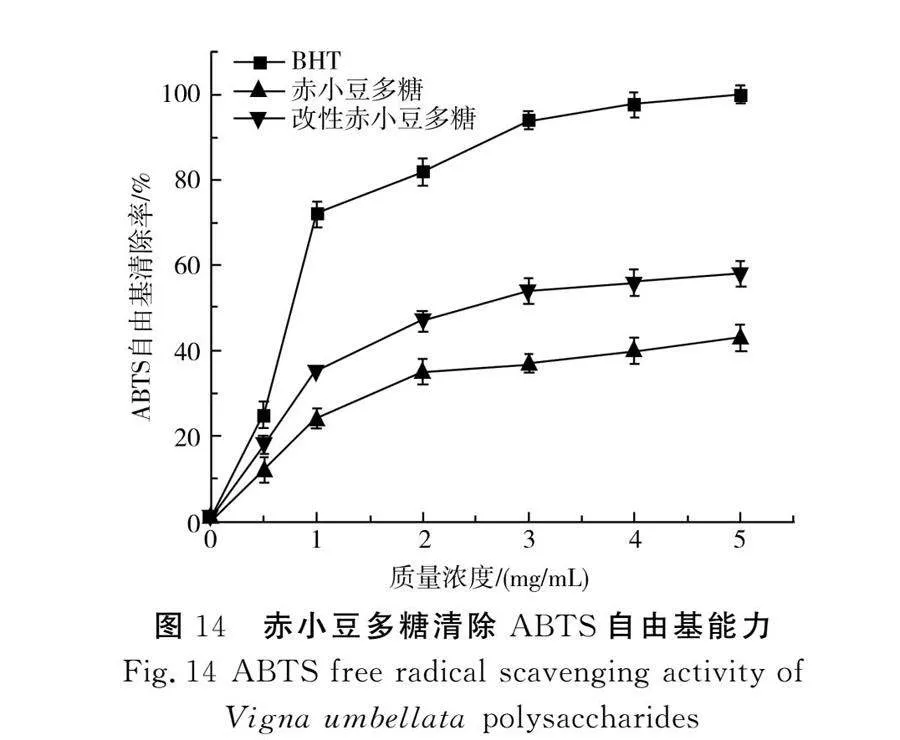
赤小豆多糖对ABTS自由基的清除能力见图14。
由图14可知,当质量浓度为0~5 mg/mL时,多糖浓度与ABTS自由基清除率成正比。当质量浓度为5 mg/mL时,改性赤小豆多糖对ABTS自由基的清除率为58.82%,虽明显低于同浓度下的BHT,但高于赤小豆多糖,且比改性前的赤小豆多糖提高了14.87%。
2.4.4 草莓腐败率测定结果
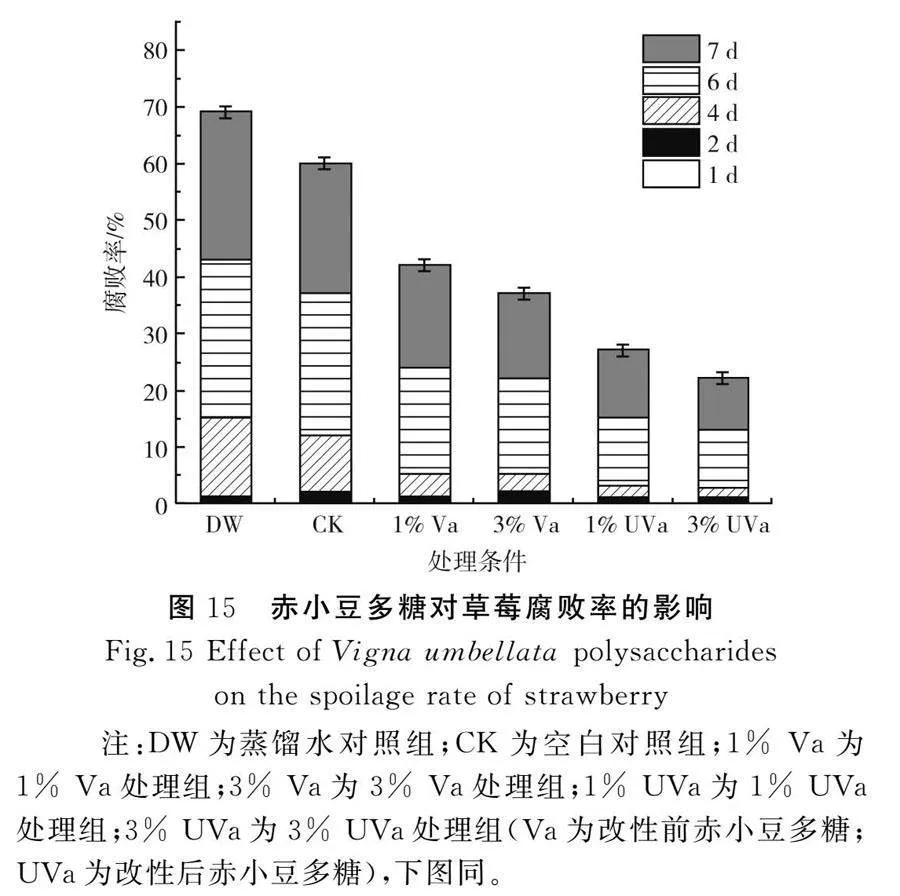
随着时间变化,赤小豆多糖对草莓腐败率的影响见图15。
由图15可知,在贮藏第6天时,4个多糖组的防腐能力明显提高,3%改性赤小豆多糖组的草莓腐败率比空白对照组降低了15.16%,比3%赤小豆多糖组降低了9.12%,多糖处理组表现出了一定的防腐能力,此时多糖涂膜已经在草莓表层形成保护层,可以隔绝外界空气和微生物侵袭草莓,并且多糖中的活性物质可进一步减少草莓腐败[23-24]。
2.4.5 草莓失重率测定结果
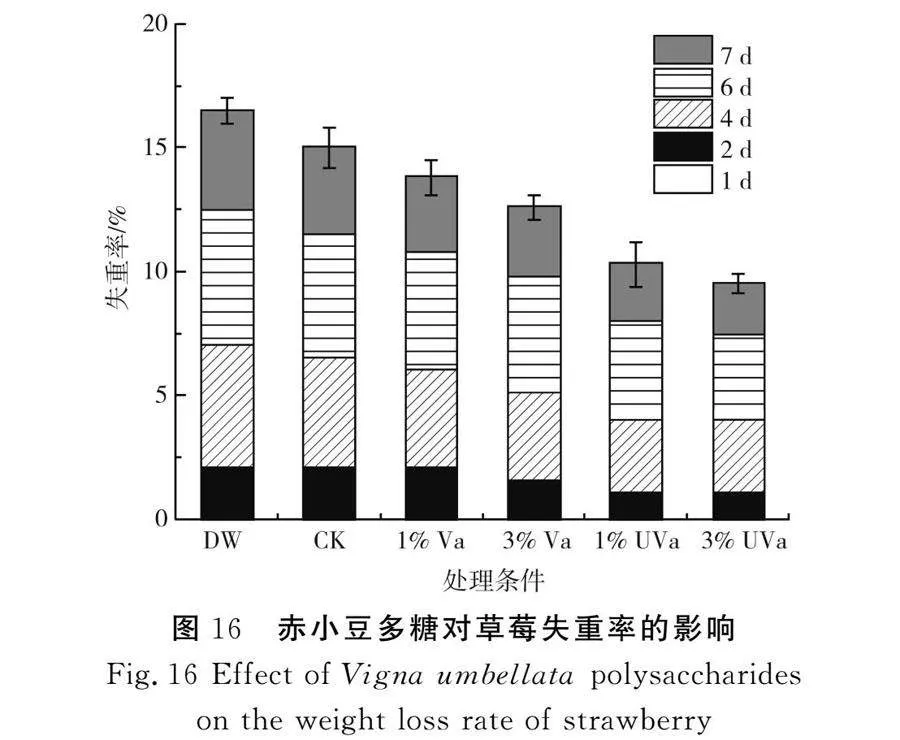
随着时间变化,赤小豆多糖对草莓失重率的影响见图16。
由图16可知,在贮藏第6天时,4个多糖组的持水能力明显提高,3%改性赤小豆多糖组的草莓失重率比空白对照组降低了2.76%,比3%赤小豆多糖组降低了1.12%,多糖处理组表现出了一定的持重能力,不同剂量改性前后的赤小豆多糖均表现出稳定且较好的持重能力,3%改性赤小豆多糖对草莓的持重效果更佳,多糖利用自身的持水性来减缓草莓表层水分流失,由此可见,改性赤小豆多糖具有一定的保鲜性能,可延长草莓的贮藏期。
2.4.6 草莓VC测定结果
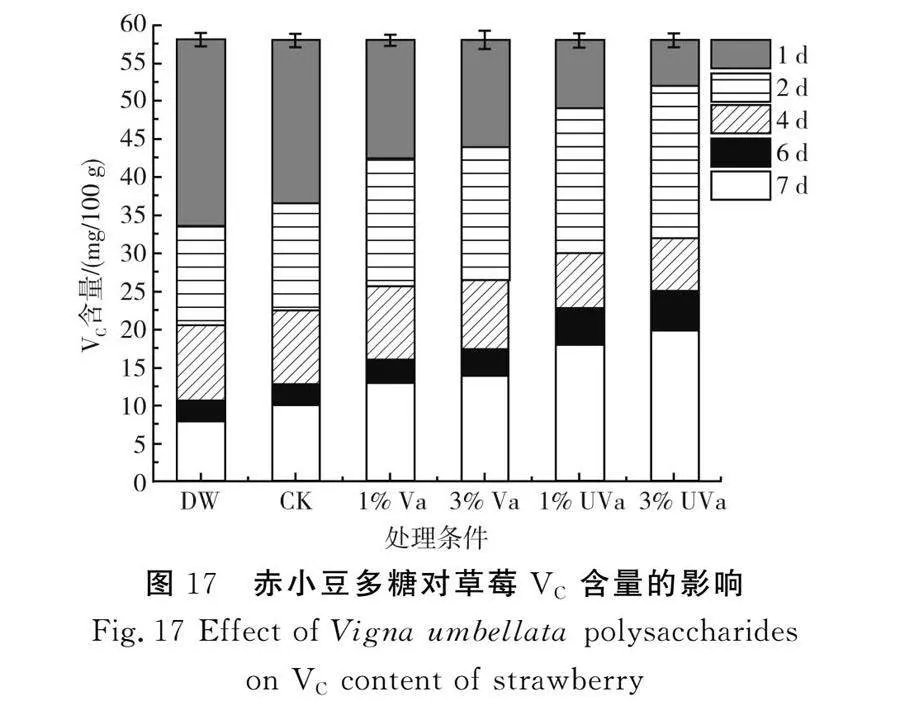
随着时间变化,赤小豆多糖对草莓VC含量的影响见图17。
由图17可知,3%改性赤小豆多糖组呈现出最佳的草莓VC保留效果。在贮藏第2天时,4个多糖组的VC保留能力明显提高,3%改性赤小豆多糖组的草莓VC含量比空白对照组增加18.42 mg/100 g,比3%赤小豆多糖组提高了8.13 mg/100 g,多糖处理组均对草莓中VC含量有不错的保留功能,3%改性赤小豆多糖对草莓VC含量的保留效果更佳。
2.4.7 草莓MDA含量测定结果
MDA是脂质的过氧化产物之一,反映草莓脂质膜氧化后的老化程度。随着时间变化,赤小豆多糖对草莓MDA含量的影响见图18。
由图18可知,在贮藏第4天时,4个多糖组的MDA抑制能力明显提高,3%改性赤小豆多糖组的草莓MDA含量比空白对照组减少了0.55 μmol/(g·FW),比3%赤小豆多糖组减少了0.28 μmol/(g·FW),多糖处理组均对草莓中MDA含量有不错的抑制能力,3%改性赤小豆多糖对草莓MDA含量的抑制效果更佳。
3 结论
本试验采用超声辅助水提醇沉法提取赤小豆多糖,复合酶法除去淀粉和纤维素杂质,Sevage法脱蛋白,得到赤小豆多糖。根据标准曲线计算得到赤小豆多糖的总糖含量为70.32%,采用单因素试验分别选取4个因素的最佳工艺参数,然后做响应面试验考察4个因素的交互作用,最终得到赤小豆多糖最优提取条件为超声时间50 min、水提温度70 ℃、水提时间200 min、复合酶处理温度47 ℃,在此条件下,赤小豆多糖的提取率达到4.33%。
将超声改性后的赤小豆多糖进一步做功能特性分析,与赤小豆多糖进行对比,改性赤小豆多糖对羟基自由基的清除率最高,为88.35%,比改性前的赤小豆多糖提高了18.1%,对DPPH自由基的清除率达到最高,为83.67%,比改性前的赤小豆多糖提高了17.4%,对ABTS自由基的清除率达到最高,为58.82%,比改性前的赤小豆多糖提高了14.87%。将改性前后赤小豆多糖配制成1%和3%溶液浸泡处理草莓,经多糖溶液处理后将草莓贮藏7 d,保鲜能力排序为3%改性赤小豆多糖组gt;1%改性赤小豆多糖组gt;3%赤小豆多糖组gt;1%赤小豆多糖组,对草莓的保鲜能力与多糖呈剂量依赖性,在相同多糖浓度下,改性赤小豆多糖的保鲜能力强于赤小豆多糖。
参考文献:
[1]杨园,孙善辉.农村专业合作社优质杂粮扩繁及产业推广研究——以安徽省灵璧县黄河故道野生赤小豆为例[J].农产品加工,2017(24):62-63.
[2]林栋,张爱民,王绍校,等.赤小豆蛋白的提取工艺优化及其功能性质[J].中国食品添加剂,2022,33(1):75-82.
[3]陈日益.健脾利湿赤小豆[J].家庭医学,2021(8):40.
[4]阙灵,杨光,李颖,等.《既是食品又是药品的物品名单》修订概况[J].中国药学杂志,2017,52(7):521-524.
[5]LI J, CHEN Z, SHI H, et al.Ultrasound-assisted extraction and properties of polysaccharide from Ginkgo biloba leaves[J].Ultrasonics Sonochemistry,2023,93:106295.
[6]尚加英,郑学玲,赵波,等.谷物非淀粉多糖特性、制备及分析方法研究进展[J].食品与发酵工业,2020,46(20):259-267.
[7]YIN X,YOU Q,JIANG Z.Optimization of enzyme assisted extraction of polysaccharides from Tricholoma matsutake by response surface methodology[J].Carbohydrate Polymers,2011,86(3):1358-1364.
[8]TANG Z, HUANG G.Extraction, structure, and activity of polysaccharide from Radix astragali[J].Biomedicine amp; Pharmacotherapy,2022,150:113015.
[9]SOROURIAN R, KHAJEHRAHIMI A E, TADAYONI M, et al.Ultrasound-assisted extraction of polysaccharides from Typha domingensis :structural characterization and functional properties[J].International Journal of Biological Macromolecules,2020,160:758-768.
[10]王庆,李丹丹,潘芸芸,等.提取方法对天麻多糖提取率及其抗氧化活性的影响[J].食品与机械,2017,33(9):146-150.
[11]杨艺,赵媛,孙纪录,等.化学修饰多糖的方法及生物活性研究进展[J].食品工业科技,2023,44(11):468-479.
[12]GOODWIN D J, PICOUT D R, ROSS-MURPHY S B, et al. Ultrasonic degradation for molecular weight reduction of pharmaceutical cellulose ethers[J].Carbohydrate Polymers,2011,83(2):843-851.
[13]CHEMAT F, ROMBAUT N, SICAIRE A, et al.Ultrasound assisted extraction of food and natural products.Mechanisms, techniques, combinations, protocols and applications.A review[J].Ultrasonics Sonochemistry,2017,34:540-560.
[14]XU Y, ZHANG X, YAN X, et al. Characterization, hypolipidemic and antioxidant activities of degraded polysaccharides from Ganoderma lucidum[J].International Journal of Biological Macromolecules,2019,135:706-716.
[15]XIONG S L, LI A, HUANG N, et al.Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicus[J].Carbohydrate Polymers,2011,86(3):1273-1280.
[16]汪道兵.老鸦瓣黄酮制备及其对草莓防腐保鲜效果的影响[D].滁州:安徽科技学院,2019.
[17]张明明.多花黄精提取物对果蔬采后生理和品质的影响[D].合肥:安徽农业大学,2013.
[18]王伟.蓝莓天然保鲜剂筛选及复合涂膜保鲜技术研究[D].长沙:湖南大学,2018.
[19]JI H, LIU C, DAI K, et al.The extraction, structure, and immunomodulation activities in vivo of polysaccharides from Salvia miltiorrhiza[J].Industrial Crops and Products,2021,173:114085.
[20]CHEN G, CHEN K, ZHANG R, et al. Polysaccharides from bamboo shoots processing by-products: new insight into extraction and characterization[J].Food Chemistry,2018,245:1113-1123.
[21]TEKINEN K K, GNER A. Chemical composition and physicochemical properties of tubera salep produced from some Orchidaceae species[J].Food Chemistry,2010,121(2):468-471.
[22]LI M, MA F, LI R, et al. Degradation of Tremella fuciformis polysaccharide by a combined ultrasound and hydrogen peroxide treatment: process parameters, structural characteristics, and antioxidant activities[J].International Journal of Biological Macromolecules,2020,160:979-990.
[23]祁小妮,马建元,夏世英,等.藏药红景天多糖基抗菌可食膜的制备[J].精细化工,2019,36(10):2034-2039.
[24]王倩婷.TP/TPCNP-普鲁兰-明胶活性包装膜的制备、性能评价及在草莓保鲜上的应用[D].合肥:合肥工业大学,2022.

