基于PCPA大鼠下丘脑蛋白互作网络分析挖掘失眠发病的分子机制
摘要:目的 采用蛋白质组学技术对PCPA失眠大鼠模型下丘脑蛋白质表达差异进行分析,探讨失眠模型大鼠在失眠过程中下丘脑的差异蛋白互作网络关系。方法 将SD大鼠随机分为空白组、模型A组、模型B组,除空白组外全都给予PCPA造模,模型A组造模成功后立即取下丘脑,空白组与模型B组饲养7 d,待PCPA药效减退后取下丘脑。运用蛋白质组学技术检测各组大鼠下丘脑蛋白差异,以差异表达量上调或下调超过1.5倍作为变化阈值,筛选差异蛋白并分析其互作用关系。结果 戊巴比妥钠翻正反射试验显示,模型A组、模型B组与空白组的大鼠睡眠潜伏期时间比较,潜睡眠时间均延长(P<0.01),睡眠持续时间均缩短(P<0.01);自发活动试验显示造模后模型A组、模型B组与空白组比较,自发举爪次数均增加(P<0.05)。根据蛋白互作关系网络分析,模型A组与空白组之间蛋白网络中有16个蛋白有较重要作用,其中Map1(T-kininogen 1)、Mfge8(Lactadherin)、P4hb(Protein disulfide-isomerase)与失眠关系较为密切。模型B组与模型A组之间蛋白网络中有12个蛋白具有重要作用,其中Apoa1(Apolipoprotein A-I)、Mfge8(Lactadherin)、Sympk(Symplekin)、Plg(Plasminogen)与失眠关系密切。结论 通过PCPA大鼠下丘脑的蛋白互作网络分析挖掘,失眠的发生发展可能与HPA轴的应激反应下神经变性保护、血管内皮细胞、内分泌调节、免疫系统平衡、学习记忆能力以及衰老具有相关性。
关键词:失眠;PCPA模型;下丘脑;蛋白质组学;蛋白互作关系;差异蛋白
中图分类号:R741 文献标志码:A 文章编号:1007-2349(2024)12-0082-06
Molecular Mechanisms of Insomnia Revealed by Hypothalamic ProteinInteraction Network Analysis in PCPA Rat Models
ZHANG Hong-shi1, QU Zi-han1, JIAO Jun-dong2, ZHANG Ye1
(1. Changchun University of Traditional Chinese Medicine, Changchun 130117, China; 2. The Affiliated Hospital of Changchun University of Traditional Chinese Medicine, Changchun 130021, China)
【Abstract】Objective: To analyze the differential protein expression in the hypothalamus of PCPA-induced insomnia rat models using proteomics, and to explore the protein interaction networks involved in the pathogenesis of insomnia. Methods: SD rats were randomly divided into blank group, Model A group, and Model B group. Except for the blank group, all groups were modeled with PCPA. In the Model A group, the hypothalamus was harvested immediately after successful modeling, while in the blank and Model B groups, the hypothalamus was harvested after 7 days, allowing PCPA effects to subside. Proteomics technology was used to detect differential protein expression in the hypothalamus of each group. Proteins with differential expression levels greater than 1.5-fold(upregulated or downregulated) were identified and analyzed for interaction relationships. Results: Sodium pentobarbital righting reflex tests showed that sleep latency was significantly prolonged(P<0.01) and sleep duration significantly shortened(P<0.01) in both Model A and Model B groups compared to the blank group. Spontaneous activity tests revealed an increased number of paw lifts in the Model A and Model B groups compared to the blank group(P<0.05). Protein interaction network analysis identified 16 key proteins in the network between the Model A and blank groups, among which Map1(T-kininogen 1), Mfge8(Lactadherin), and P4hb(Protein disulfide-isomerase) were closely related to insomnia. In the network between the Model B and Model A groups, 12 key proteins were identified, including Apoa1(Apolipoprotein A-I), Mfge8(Lactadherin), Sympk(Symplekin), and Plg(Plasminogen), which were strongly associated with insomnia. Conclusion: Protein interaction network analysis of the hypothalamus in PCPA-induced rat models suggests that the occurrence and progression of insomnia may be related to stress responses of the HPA axis, neurodegenerative protection, vascular endothelial cells, endocrine regulation, immune system balance, learning and memory abilities, and aging.
【Key words】Insomnia; PCPA Model; Hypothalamus; Proteomics; Protein Interaction Network; Differential Proteins
失眠是常见睡眠障碍之一,在世界主要国家失眠患者占总人口的5%~10%,流行病学显示失眠是增加糖尿病、冠心病、哮喘、肥胖症、焦虑症、抑郁症等患病风险的主要因素,也常常导致认知功能、记忆功能下降,给患者的生活和健康带来严重影响,甚至导致自杀倾向[1]。失眠是世界范围内的广泛性疾病,对失眠的关注和治疗每年需要投入大量资金,而目前对失眠的发病机制尚不明确。
目前对失眠发病的研究,主要从睡眠-觉醒周期出发,下丘脑是调节人体睡眠-觉醒的主要部位,下丘脑内的诸多代谢通路都对睡眠产生影响[2],目前研究较多的物质如促肾上腺皮质激素释放激素(CRH)、5-羟色胺、γ-氨基丁酸(GABA)、神经肽Y、促肾上腺皮质激素(ACTH)[3]。也有学者从免疫调节对于睡眠-觉醒机制影响角度出发进行研究,如白介素-1α、TNF-β等[4]。尽管已经阐释了部分失眠相关的分子机制,但是还有许多物质没有得到揭示,所以采用蛋白质组学的技术方法,对各组大鼠的下丘脑进行分析,找到差异蛋白,并根据互作网络分析挖掘与失眠发病有关的重要物质和通路。
1 材料与方法
1.1 材料 30只SPF级SD大鼠,体重(190±10)g,由长春亿斯公司提供。购进大鼠的合格证编号为SCXK(吉)-2018-0007,适应性喂养7 d,对大鼠进行随机分组标号,分为空白组、模型A组,模型B组,每组10只,动物处于SPF级实验室饲养,保持恒温、恒湿、自由饮水,12h光照模拟白天黑夜,实验严格符合动物保护、动物福利和伦理要求,并且经过长春中医药大学伦理委员会审批,批准编号:2020346。
DL-4-Chlorophenylalanine 98%(C9H10CINO2 199.63,CAS:7424-00-2),蛋白酶抑制剂(Merck Millipore),trypsin(Promega),磷酸化酶抑制剂(Millipore),IAM(Sigma-Aldrich),甲酸(Fluka),尿素(Sigma-Aldrich),2-D Quant(GE Healthcare),二甲苯(Sangon Biotech),DNA提取酚试剂(Solarbio),BCA试剂(碧云天),PAGE银染试剂盒(Solarbio),甲醇(ThermoFisher Scientific),甘油(Sangon Biotech),蛋白标志物(Thermo scientific),奶粉(Amresco)。
1.2 方法
1.2.1 分组和造模 将30只SD大鼠分为正常组、模型A组、模型B组,每组10只,模型A组和模型B组采取腹腔注射对氯苯丙氨酸法(4-chloro-DL-phenylalanine,PCPA)建立模型[5],将PCPA粉末研磨后,按400 mg/kg配制,并给予大鼠腹腔注射,连续注射2 d,空白组注射等量生理盐水。模型A组成模后不饲养直接取材,用以对照模型B组观察造模成功后饲养对失眠大鼠的影响。模型B组和空白组饲养7 d后取材。
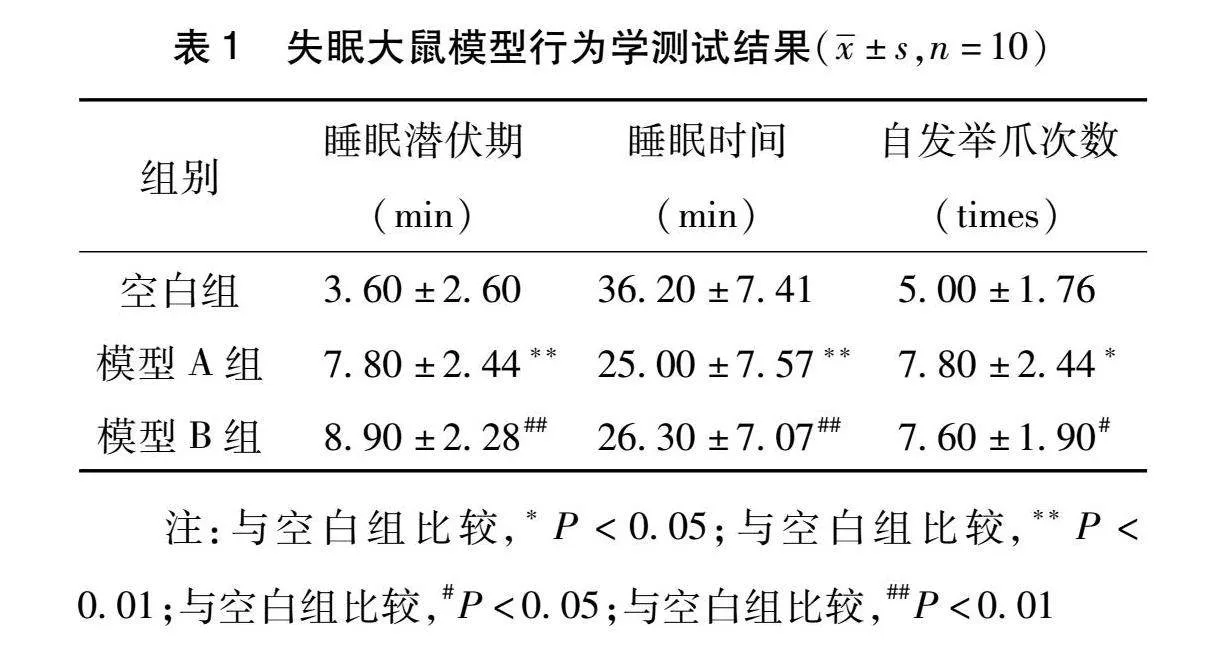
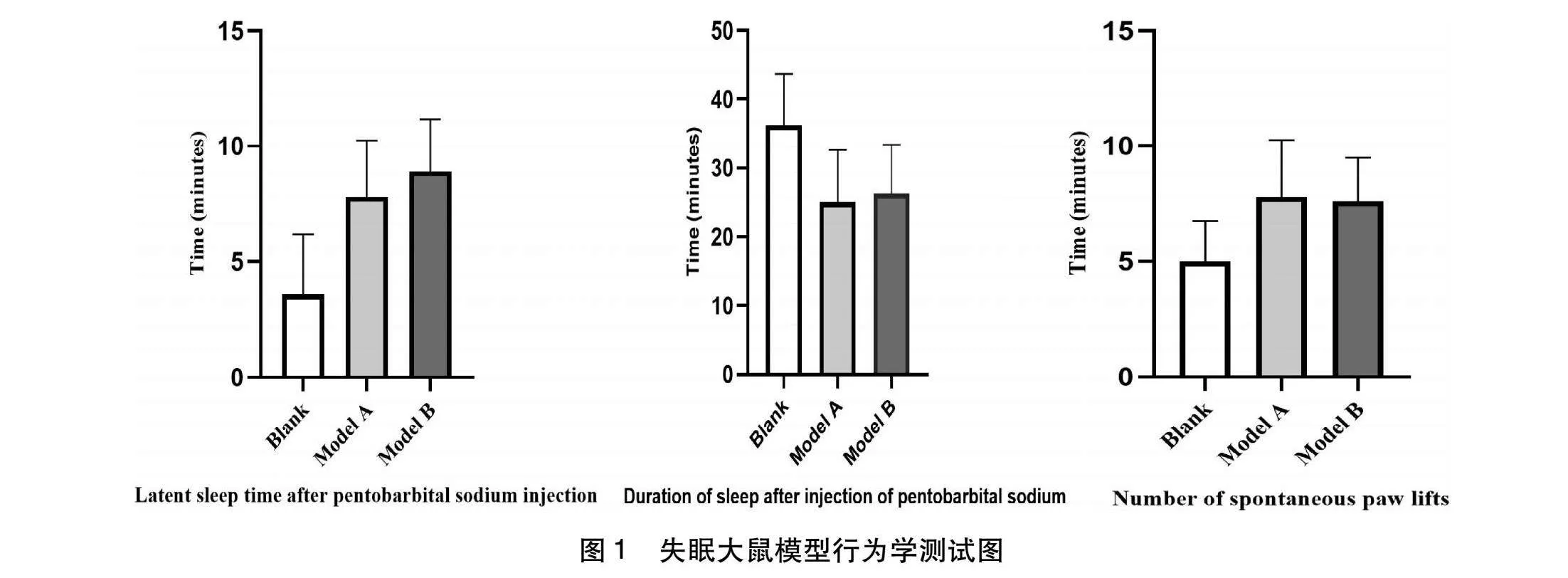
1.2.2 模型验证 戊巴比妥钠翻正反射试验:按照经验,大鼠在注射36 h后昼夜节律紊乱,昼夜皆活动不断。并在末次注射后24 h进行大鼠戊巴比妥钠翻正反射试验,以35 g/kg剂量的戊巴比妥钠注射于大鼠腹腔,提起鼠尾以大鼠不能翻身回正为标准,记录睡眠潜伏时间和睡眠持续时间[6]。
自发举爪活动试验:主要是根据行为活动程度测试大鼠神经兴奋程度,在试验前将大鼠分别置于干净的鼠笼中适应3min,然后开始记录大鼠在2min之内的前肢举爪离地次数作为活动指标。在造模后1h分别对各组测量[7]。
1.2.3 蛋白质组学检测 大鼠以异氟烷气体麻醉,确保大鼠处于无痛苦状态,以镊子尖端夹大鼠四肢无收缩反应为麻醉成功,腹腔取血离心保存,然后断头并迅速在冰上剥离下丘脑,将下丘脑组织以生理盐水冲洗干净后置于冻存管中投入液氮中速冻,转移至-80℃冰箱内保存。检测前称取适量组织样品至液氮预冷的研钵研磨,分别加入裂解缓冲液裂解后,离心10min,以BCA试剂盒对样品进行蛋白浓度测定。各样品蛋白取等量进行酶解,加入TCA后沉淀2h,离心后移除上清液,以丙酮洗涤沉淀。加入TEAB、胰蛋白酶过夜。加入二硫苏糖醇、碘乙酰胺,室温避光孵育15min。肽段经超高效液相系统分离后电离,用Orbitrap ExplorisTM 480质谱进行分析。
1.2.4 蛋白互作网络分析 将筛选出来的差异表达蛋白数据编号或蛋白序列号比对STRING(v.11.0)蛋白网络互作数据库,按照confidence score>0.7(high confidence)提取得到差异蛋白互作关系。
1.2.5 统计学方法 采用统计软件SPSS23.0对数据进行分析,数据以x±s表示,计量数据采用单因素方差分析,多重比较采用LSD检验,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 失眠大鼠模型行为学测试结果 分别采用大鼠戊巴比妥钠翻正反射试验、自发活动试验对大鼠空白组、模型A组、模型B组测试。结果显示,戊巴比妥钠翻正反射试验显示注射后,模型A组、模型B组与空白组的大鼠睡眠潜伏期时间比较,潜睡眠时间均延长,均具有显著性差异(P<0.01)。模型A组、模型B组与空白组的大鼠睡眠持续时间比较,睡眠持续时间均缩短,皆具有显著性差异(P<0.01)。自发活动试验显示造模后模型A组、模型B组与空白组比较,自发举爪次数均增加,差异具有统计学意义(P<0.05),提示模型建立成功,见表1、图1。
2.2 蛋白质组学互作网络分析结果 通过上述差异蛋白分析,当P≤0.05时,以差异表达量倍数变化超过1.5作为上调或者下调的变化阈值,比较分析显示模型B组与空白组比较360个蛋白上调,124个蛋白下降,模型B组与模型A组比较,358个蛋白上调,101个蛋白下降。对大鼠造模前后、造模后饲养前后各组下丘脑差异蛋白表达互作网络分析。
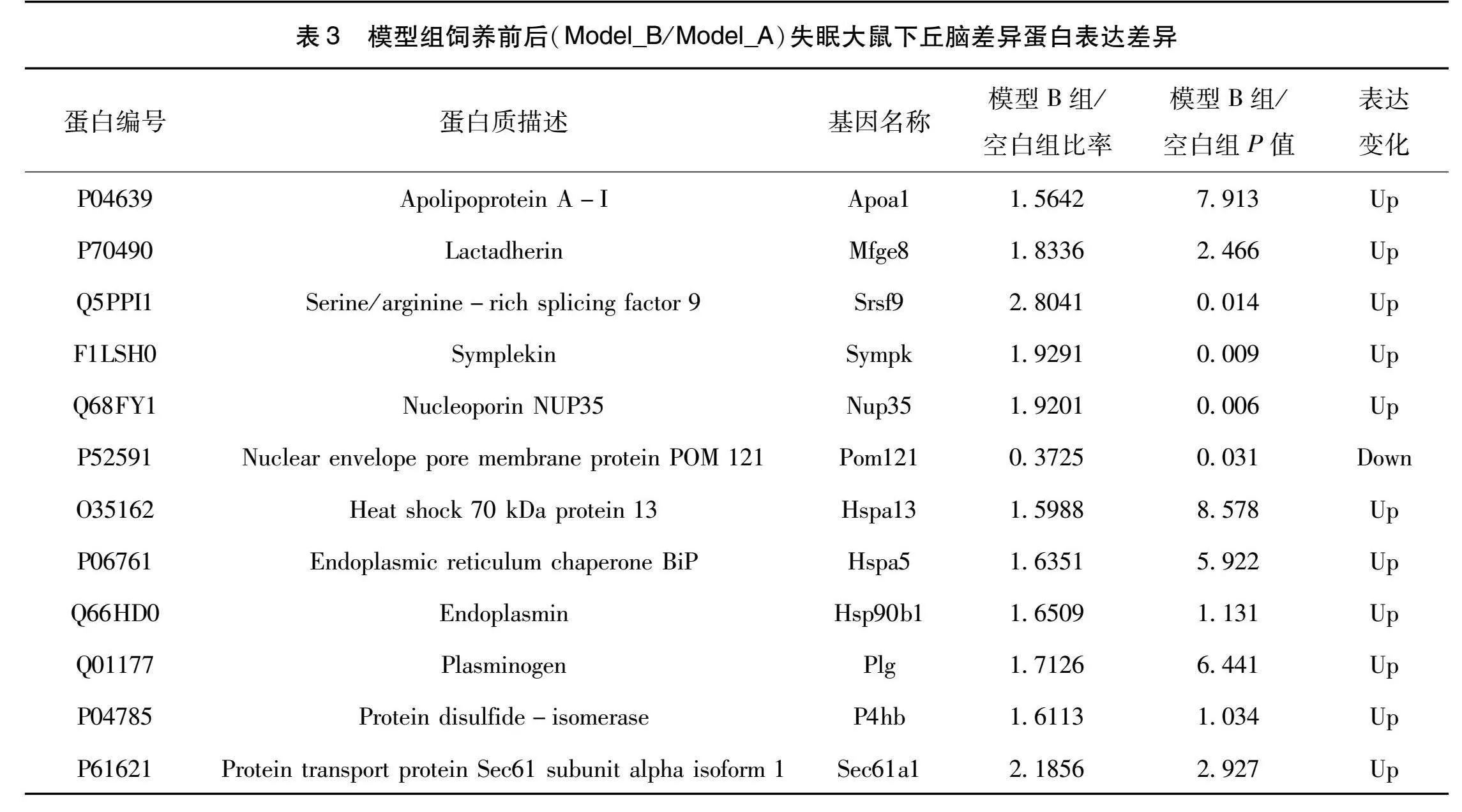
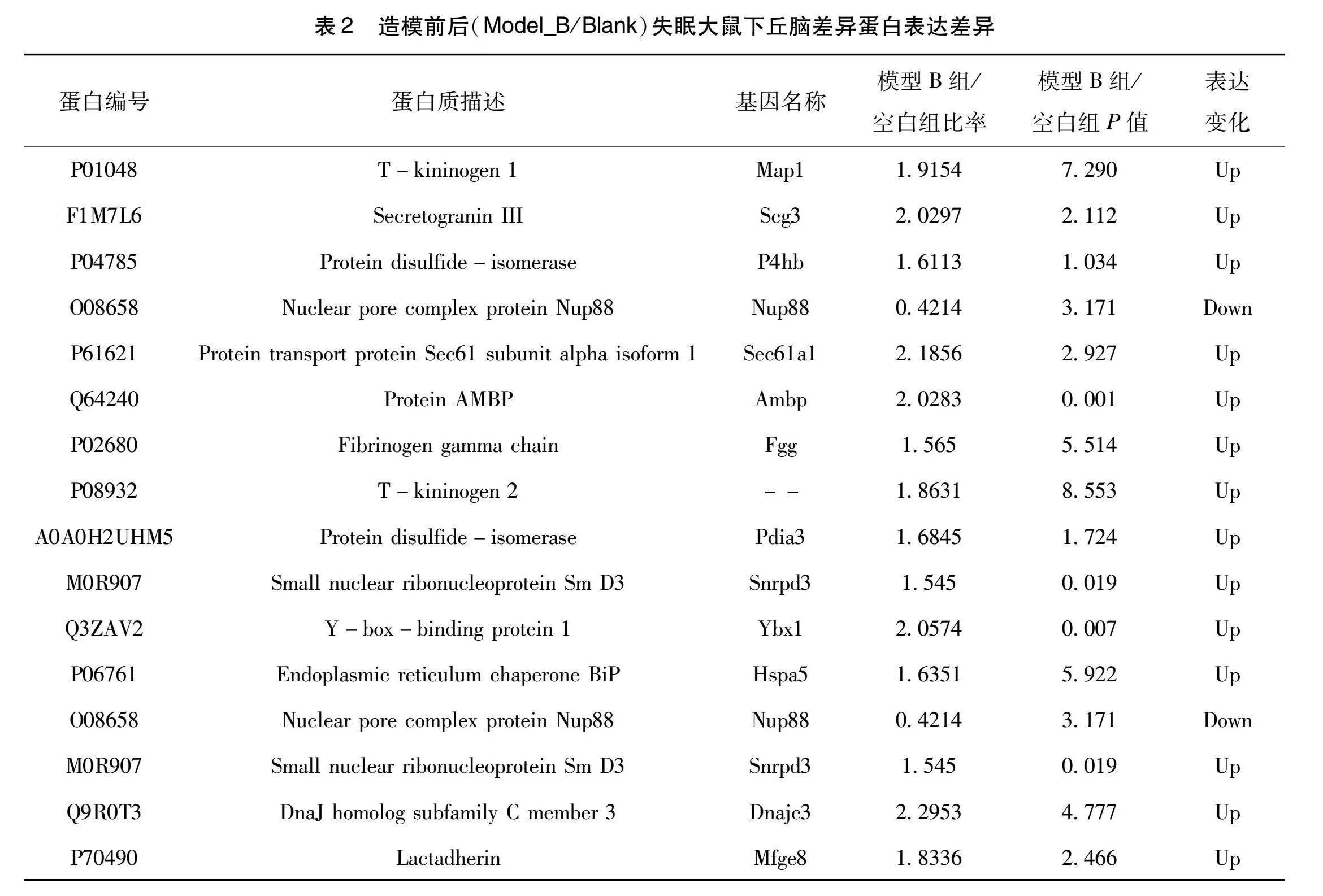
将不同比较组中根据差异倍数1.5筛选得到的差异蛋白数据库编号或蛋白序列,通过与STRING(v.11.0)蛋白网络互作数据库比对分析,其中表达差异较大且符合睡眠相关的代表性蛋白质,模型B组与空白组比较有16个蛋白差异明显。见表2。模型B组与模型A组比较有12个蛋白差异明显。见表3。在这些蛋白中Map1(T-kininogen 1)、Mfge8(Lactadherin)、P4hb(Protein disulfide-isomerase)、Apoa1(Apolipoprotein A-I)、Sympk(Symplekin )、Plg(Plasminogen )与失眠关系较为密切且变化显著,根据数据结果测定,对其蛋白表达数取平均值和标准差进行比较。
3 讨论
失眠表现为正常条件下难以入睡或睡眠质量差,临床研究表明失眠可能是增加心血管疾病、肥胖、氧化应激以及代谢综合征风险的重要因素[8]。本研究采用腹腔注射对氯苯丙氨酸法建立失眠模型,并利用定量蛋白组学技术,检测了PCPA失眠模型大鼠与正常大鼠下丘脑的差异蛋白质的变化,对差异蛋白进行蛋白互作网络分析,从而对失眠发病的分子机制进一步阐述失眠的发病机制。
研究结果显示,模型B组与空白组比较360个蛋白上调,124个蛋白下降,模型B组与模型A组比较,358个蛋白上调,101个蛋白下降。模型A组与空白组之间蛋白网络中有16个蛋白有较重要作用,其中Map1(T-kininogen 1)、P4hb(Protein disulfide-isomerase)、Mfge8(Lactadherin)与失眠关系较为密切。模型B组与模型A组之间蛋白网络中有12个蛋白具有重要作用,其中Apoa1(Apolipoprotein A-I)、Sympk(Symplekin)、Mfge8(Lactadherin)、Plg(Plasminogen)与失眠关系较为密切。
Map1(T-kininogen 1)是一种与衰老相关的基因,同时也与炎症反应有关[9]。一般动物死亡前,不论年龄大小,血清中T-kininogen 1皆有所增加,在相关研究中发现,雄性大鼠血清中T-kininogen 1的增加呈指数曲线,而在雌性中增加曲线呈线性拟合,并且无论性别如何,饮食的限制都会延缓T-kininogen 1的增加,所以进一步分析T-kininogen 1可能与脾细胞在糖脂作用下的增值呈现负相关,从而得出血清中T-kininogen 1增加是衰老的一个有效标志物,并且可能随着年龄的增长,与淋巴细胞增殖减缓有关[10]。近年来有相关研究对睡眠剥夺大鼠的血清做蛋白组学分析,T-kininogen 1有较高表达,而对照组则没有免疫识别,认为T-kininogen 1是睡眠剥夺潜在的血清标志物之一。
P4hb(Protein disulfide-isomerase)是二硫键异构酶,又简称PDI,主要功能是充当巯基-二硫键交换反应的催化剂,能够进蛋白二硫键的生成,具有分子伴侣活性,能抑制错误的折叠蛋白聚集,在神经变性疾病中能够起到保护神经的作用,如帕金森症、肌萎缩侧索硬化症、阿尔兹海默症、多聚谷氨酰胺疾病等,能够在不同程度上抑制错误折叠蛋白的聚集,但是PDI能被过量的一氧化氮亚硝基化,造成其蛋白质构象改变和功能障碍,从而影响神经元的连通性和可塑性,触发神经元的凋亡通路[11]。
Mfge8(Lactadherin)是一种乳酸粘附蛋白,也称乳脂肪球表皮生长因子,是一种具有多种免疫功能的糖蛋白,研究表明Lactadherin缺乏的小鼠会有免疫疾病症状,如脾增大、血清内抗DNA及抗核蛋白抗体显著增多,所以Lactadherin对于机体维持免疫系统平衡具有重要意义。它在血管及其周围表达,并在成年小鼠血管内皮生长因子(Vascular endothelial growth factor,VEGF)依赖的新生血管中发挥关键作用[12]。也有研究发现乳糖粘附蛋白能够改变新生血管的VEGF依赖的Akt磷酸化。在缺乏VEGF的情况下,乳酸粘附素可诱导体外内皮细胞中Akt磷酸化,并显著改善体内缺血后血管新生,乳酸粘附蛋白在VEGF依赖的新生血管中起着至关重要的作用[13]。
Apoa1(Apolipoprotein A-I)是载脂蛋白,是高密度脂蛋白的主要功能蛋白,其含量多少与心血管疾病风险呈现负相关,Apolipoprotein A-I缺乏是导致动脉粥样硬化加重的原因之一[14]。
Sympk(Symplekin),Simplekin是双驻留蛋白,这些蛋白可能发生在细胞核和斑块中,能在紧密连接、粘附连接或桥粒中发挥作用,这种蛋白存在于核浆中,在那些形成紧密连接的细胞中,部分会有选择性地被纳入到闭塞带的斑块结构中[15]。
Plg(Plasminogen)是纤溶酶原,在脑组织和脊髓内以及大多数器官中都有表达,其活性形式与炎症相关的疾病具有广泛联系,能够去除血管内纤维蛋白沉积,目前对其溶栓作用进行研究较多,也有研究表明组织型纤溶酶原调控了神经元的存活、突触的可塑性以及学习记忆等过程[16]。该研究基于蛋白质组学技术分析失眠与健康大鼠下丘脑之间的差异蛋白质,通过蛋白互作网络分析挖掘探究失眠发病的相关分子机制,一定程度上能够弥补人体实验无法对下丘脑蛋白分析的现实,填补失眠发病后下丘脑蛋白质组学变化的空白,对失眠的研究具有重要意义,但是尽管诸多物质被发现与失眠发生机制密切相关,但仍需大量的科研实验进行验证。
综上所述,通过PCPA大鼠下丘脑的蛋白互作网络分析挖掘,失眠的发生发展可能与HPA轴的应激反应下神经变性保护、血管内皮细胞、内分泌调节、免疫系统平衡、学习记忆能力以及衰老具有相关性。
参考文献:
[1]郝晓娟.分析失眠患者应用加味酸枣仁汤治疗的效果观察[J].医药界,2020(20):125-125.
[2]王琪,李延,李勇,等.化痰祛瘀汤对失眠大鼠模型的治疗作用及机制[J].世界中医药,2020,4(14):2063-2067.
[3]季向东,王群松,朱文娴.针刺治疗失眠临床疗效及对5-HT含量的影响[J].上海针灸杂志,2015,3(10):961-963.
[4]王海红,张超,郑向伟,等.补肾安神汤联合艾司唑仑片治疗肝肾阴虚型顽固性失眠临床研究[J].实用心脑肺血管病杂志,2017(S1):204-207.
[5]全世建,林杏娥,刘妮.PCPA大鼠失眠模型的证候属性研究[J].中华中医药学刊,2006,24(3):450-451.
[6]赖芸,肖海,黄真.荞麦多糖对小鼠睡眠功能和自发活动的影响[J].赣南医学院学报,2009(1):5-6.
[7]史红,吕燕萍,钱伯初.鼠、猪与猴自发活动试验方法学研究进展[J].中国临床药理学与治疗学,2006,11(3):246-250.
[8]刘玲,方琴.失眠对心血管疾病患者的影响[J].中国医药指南,2011,09(35):261-262.
[9]Walter R,Murasko D M,F Sierra.T-Kininogen is a biomarker of senescence in rats[J].Mechanisms of Ageing & Development,1998,106(1-2):129.
[10]Bina,Joe,Anitha,et al.Mass-Spectrometric Identification of T-Kininogen I/Thiostatin as an Acute-Phase Inflammatory Protein Suppressed by Curcumin and Capsaicin[J].PLoS ONE,2014,9(10):107565.
[11]kumura M,Noi K,Inaba K.Visualization of structural dynamics of protein disulfide isomerase enzymes in catalysis of oxidative folding and reductive unfolding[J].Current Opinion in Structural Biology,2021,66:49-57.
[12]Hu T,Shi J,Jiao X,et al.Measurement of annexin V uptake and lactadherin labeling for the quantification of apoptosis in adherent Tca8113 and ACC-2 cells[J].Brazilian Journal of Medical & Biological Research,2008,41(9):750-757.
[13]Silvestre J S,C Théry,Hamard G,et al.Lactadherin promotes VEGF-dependent neovascularization[J].nature medicine,2005,11(5):499-506.
[14]Zanoni P,Eckardstein A V.Inborn errors of apolipoprotein A-I metabolism:implications for disease,research and development[J].Current Opinion in Lipidology,2020,31(2):1-3.
[15]Zhang C,Mao H L,Cao Y.Nuclear accumulation of symplekin promotes cellular proliferation and dedifferentiation in an ERK1/2-dependent manner[J].Scientific Reports,2017,7(1):3769.
[16]Baker S K,Strickland S.A critical role for plasminogen in inflammation[J].Journal of Experimental Medicine,2020,217(4):1-5.
(收稿日期:2024-07-24)

