支气管肺发育不良早产患儿肠道外营养差异与肠道菌群变化

[摘要]目的探究支气管肺发育不良(BPD)早产患儿早期肠外营养差异及肠道菌群变化。方法选取2022年1月至2023年6月期间于临汾市妇幼保健院诊治的67例BPD早产患儿(记为BPD组)及71例无BPD早产患儿(无BPD组)为研究对象,均给予早期肠外营养支持治疗,比较两组氨基酸、葡萄糖、脂质摄入开始时间、初始摄入量及出生后7d摄入总量等,观察两组生后第1、7、14、21、28d肠道菌群变化。结果与无BPD组比较,BPD组葡萄糖、脂质摄入开始时间明显延长,氨基酸、葡萄糖、脂质初始摄入量及出生后7d摄入总量较低,出生后7d热卡摄入总量较低、液体摄入总量较高,差异均有统计学意义(t值介于2.651~39.015之间,P<0.05)。两组早产患儿大肠埃希菌、肠球菌于生后第1、7、14、21d持续升高,于第28d下降;乳酸杆菌、双歧杆菌于生后第1、7、14、21d持续下降,于第28d升高,组间比较差异有统计学意义(t值介于2.234~21.337之间,P<0.05)。随BPD早产患儿病情程度加重,出生7d氨基酸摄入总量、葡萄糖摄入总量、脂质摄入总量、液体摄入总量、热卡摄入总量均逐渐下降,差异有统计学意义(F值介于11.085~21.031之间,P<0.05);轻度、中度、重度BPD早产患儿出生7d大肠埃希菌、肠球菌均逐渐升高,乳酸杆菌和双歧杆菌均逐渐下降,差异有统计学意义(F值介于7.321~18.003之间,P<0.05)。结论BPD早产患儿肠外营养开始较晚、营养量较低、肠道菌群紊乱,早期给予早产患儿肠外营养支持和肠道菌群调理对BPD防治有重要指导意义。
[关键词]早产患儿;支气管肺发育不良;早期肠外营养;肠道菌群
Doi:10.3969/j.issn.1673-5293.2024.12.008
[中图分类号]R174.1[文献标识码]A" "[文章编号]1673-5293(2024)12-0053-06
[Abstract] Objective To investigate the differences in parenteral nutrition and changes in gut microbiota in premature infants with bronchopulmonary dysplasia (BPD). Methods A total of 67 premature infants with BPD (BPD group) and 71 premature infants without BPD (nonBPD group) who were admitted to Linfen Maternal and Child Health Hospital from January 2022 to June 2023 were selected as the research subjects.All subjects were given early parenteral nutrition support.The initial intake time,initial intakes,and total intake of amino acids,glucose,and lipid during the first 7 days after birth were compared between the two groups.Changes in gut microbiota of the two groups were observed on postnatal days 1,7,14,21 and 28. Results Compared with the nonBPD group,the initial time of glucose and lipid intake in the BPD group was significantly prolonged.The initial intakes of amino acids,glucose and lipids,and total intake during the first 7 days after birth in the BPD group were lower.The total calore intake and total fluid intake during this period were higher in the BPD group (t values ranged from 2.651 to 39.015,P<0.05).Escherichia coli and Enterococci in both groups increased consistently on day 1,day 7,day 14 and day 21 after birth,and decreased on day 28;Lactobacilli and Bifidobacteria decreased consistently on day 1,day 7,day 14 and day 21 after birth,and increased on day 28.The differences between groups were statistically significant (t values ranged from 2.234 to 21.337,P<0.05).As the severity of BPD increased in premature infants,the total intake of amino acids,glucose,lipids,fluids and calories during the first 7 days after birth gradually decreased,the differences were statistically significant (F values ranged from 11.085 to 21.031,P<0.05).During the first 7 days after birth,Escherichia coli and Enterococci in premature infants with mild,moderate and severe BPD gradually increased,while Lactobacilli and Bifidobacteria gradually decreased,the differences were statistically significant (F values ranged from 7.321 to 18.003,P<0.05). Conclusion In premature infants with BPD,parenteral nutrition is initiated later,with lower nutrient levels and disrupted gut microbiota.Early parenteral nutrition support and gut microbiota regulation are important for prevention and treatment of BPD in premature infants.
[Key words] premature infant;bronchopulmonary dysplasia;early parenteral nutrition;gut microbiota
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是新生儿尤其早产患儿中常见的慢性肺部疾病,多因长期吸入高浓度氧引发肺部炎症及纤维化,是导致早产患儿后遗症及死亡的重要原因[12]。早期研究数据显示,BPD在胎龄<37周、存活时间≥28d早产患儿中发病率约为1.26%,另一项队列研究则指出胎龄≤31周早产患儿BPD发生率高达29.20%,而早产患儿肺发育不全、肺损伤和损伤后的修复是导致BPD发生的重要原因[34]。目前BPD尚无有效治疗方法,早期预测BPD发生风险,做到早预防、早发现及早治疗,对患儿预后的改善有重要临床意义。BPD高风险早产患儿出生后由于应激及液体量的限制等,存在不同程度的营养不良,而早产患儿的营养状况直接影响其肺部发育、肺组织损伤后的修复效果[5]。此外,有学者认为炎症反应在BPD发生和进展中发挥重要作用,而肠道菌群或通过影响肺内炎症反应和免疫反应而参与BPD的发生[6]。尽管目前关于早产患儿支气管肺发育不良与早期肠外营养或肠道菌群变化关系的研究时有报道,但尚缺乏系统性研究和统一定论。本次回顾性收集本院收治的BPD患儿及无BPD早产患儿临床资料,通过比较两者不同时间早期肠外营养及肠道菌群变化,明确早产患儿BPD与早期肠外营养及肠道菌群变化的关系,旨在为早产患儿BPD病机研究和治疗方案提供新思路。
1资料与方法
1.1一般资料
选取2022年1月至2023年6月期间于临汾市妇幼保健院诊治的67例BPD早产患儿(记为BPD组)及71例无BPD早产患儿(无BPD组)为研究对象。本院研究期间共有新生儿3 965人次,其中早产患儿或低体重儿974人次,BPD患儿67例,BPD发生率为1.69%(67/3 965)。诊断标准:①参照《早产儿支气管肺发育不良临床管理专家共识》有关BPD的诊断标准确诊[7],具体标准:新生儿持续用氧(fraction of inspired oxygen,FiO2>21%)至少28d;肺部放射学异常表现;②BPD分度标准:应用BPD分级标准评估BPD患儿病情严重程度[8],其中校正胎龄36周或出院时无需吸氧为轻度;校正胎龄36周或出院时需吸氧,并且血氧饱和度低于30%为中度;校正胎龄36周或出院时需吸氧,并且血氧饱和度≥30%或机械通气为重度。纳入标准;①胎龄<37周,住院时间≥28d;②出生后24h内转入新生儿监护室;③临床诊治资料完整。排除标准:①合并先天性肺部疾病;②胸廓发育不良;③重症肺炎所致肺不张和局灶性肺实变;④母体有遗传代谢性疾病或内分泌疾病;⑤合并染色体异常;⑥先天性心脏病或先天性多发畸形;⑦出生28d内接受母乳喂养或使用益生菌;⑧出生后经积极抢救后死亡。本研究BPD组男婴39例、女婴28例;无BPD组男婴41例、女婴30例。本研究符合赫尔辛基宣言,所有研究对象的监护人均知情同意自愿参与研究。
1.2研究方法
早期肠外营养:记录生后第1周氨基酸、葡萄糖、脂质、液体摄入情况,并计算热卡摄入量及热氮比(非蛋白热能与氮的比值)、糖脂比(糖与脂肪提供的热量比值)。
粪便标本采集:于生后第1、7、14、21、28天,采集新鲜粪便4g,置于一次性无菌容器内送检,所有粪便标本均即刻送检,标本运输过程中需确保其安全,防止溢出,避免交叉污染。磷酸盐缓冲液混匀后常规离心(14 000r/min,r=10cm)15min后收集上清液,再次离心分离,采用DNA提取试剂盒(康为世纪生物科技有限公司,CW2094S50)收集DNA,采用16S rDNA高通测序检测两组治疗前后肠道菌群分布。
1.3观察指标
本研究观察指标:两组早产患儿基本信息比较;两组早产患儿早期肠外营养情况;两组早产患儿肠道菌群变化;不同程度BPD早产患儿出生7d肠外营养情况比较;不同程度BPD早产患儿出生7d肠道菌群变化。
1.4统计学方法
采用SPSS 24.0统计学软件分析处理研究数据。计数资料采用例数(n)和百分比(%)描述,组间采用χ2检验进行比较;计量资料以均数±标准差(x-±s)表示,采用独立样本t检验或单因素方差分析组间差异,多组间两两比较采用LSDt检验。以P<0.05为差异有统计学意义。
2结果
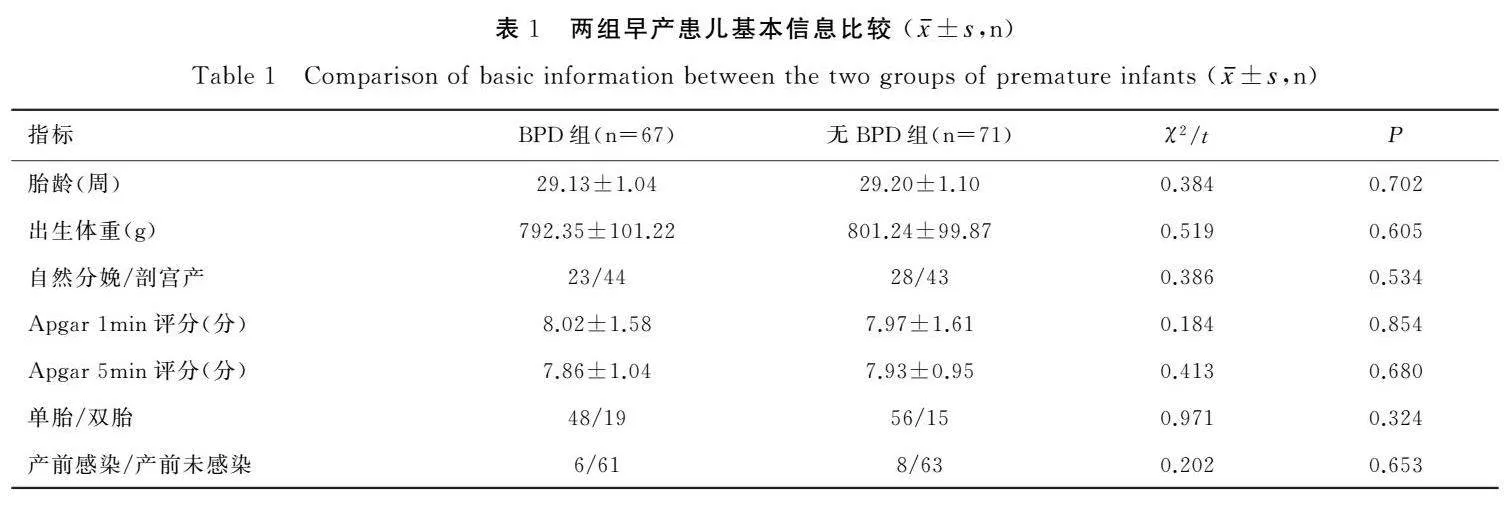
2.1两组早产患儿基本信息比较
BPD组及无BPD组一般资料比较差异无统计学意义(P>0.05),见表1。
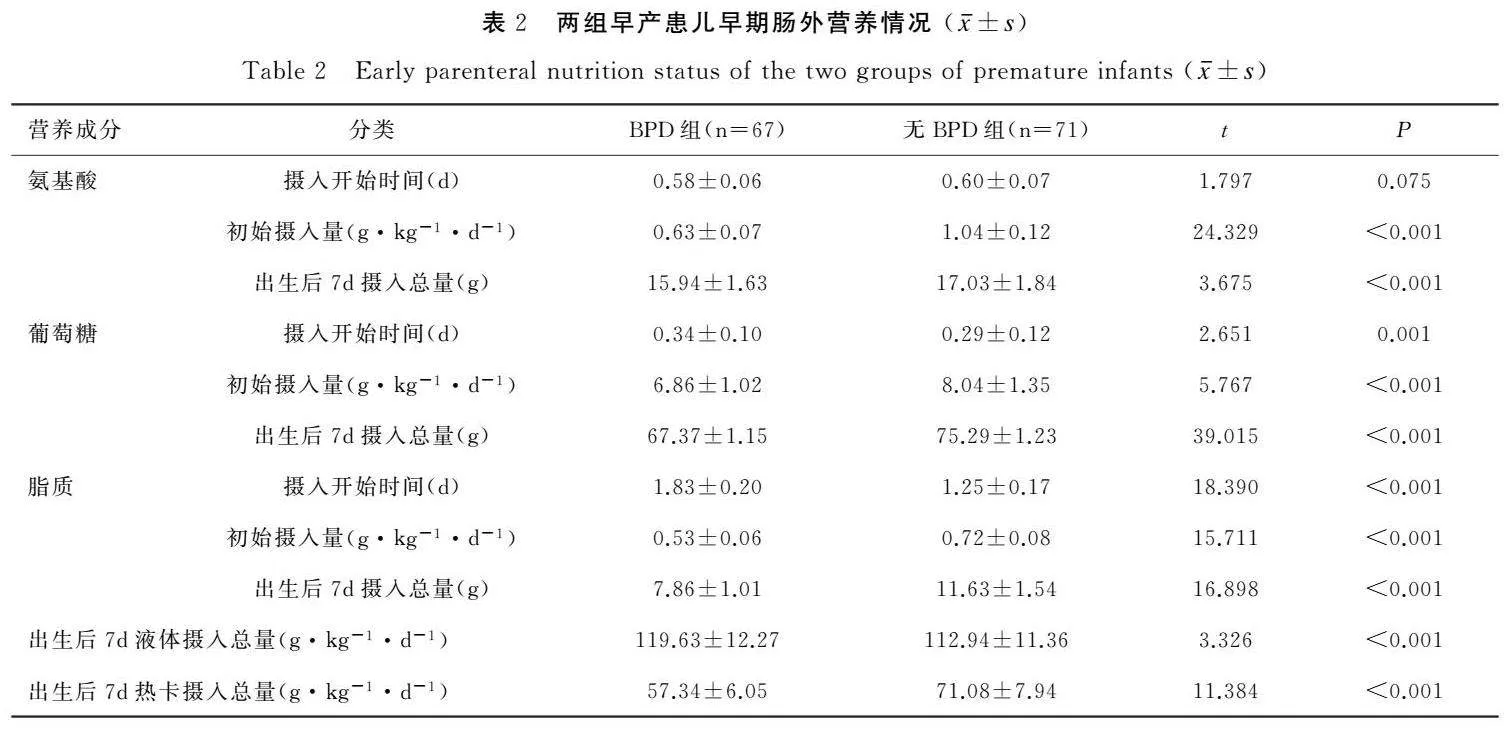
2.2两组早产患儿早期肠外营养情况
与无BPD组比较,BPD组葡萄糖、脂质摄入开始时间明显延长,氨基酸、葡萄糖、脂质初始摄入量及出生后7d摄入总量较低,出生后7d热卡摄入总量较低、液体摄入总量较高,差异均有统计学意义(t值介于2.651~39.015之间,P<0.05),见表2。
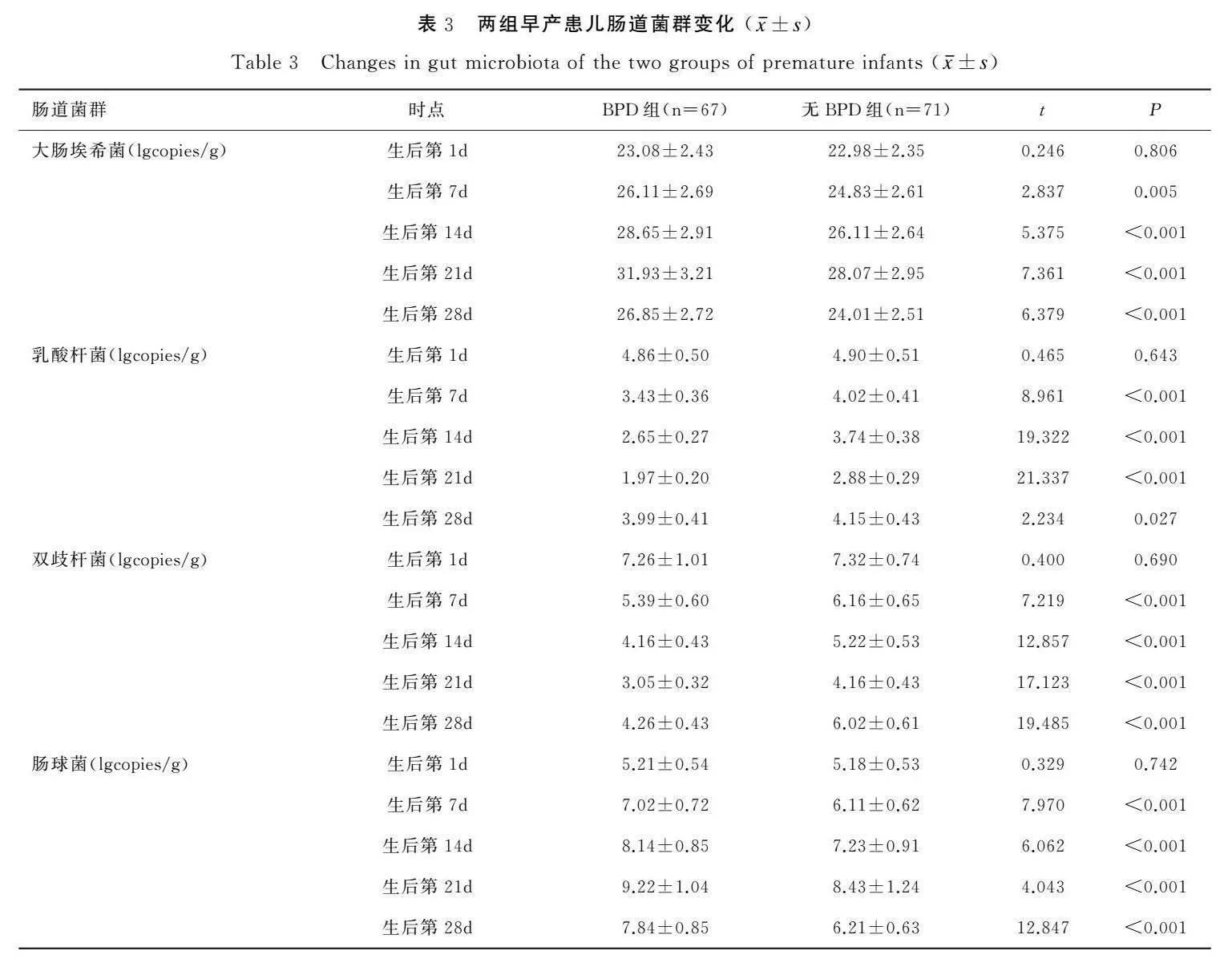
2.3两组早产患儿肠道菌群变化
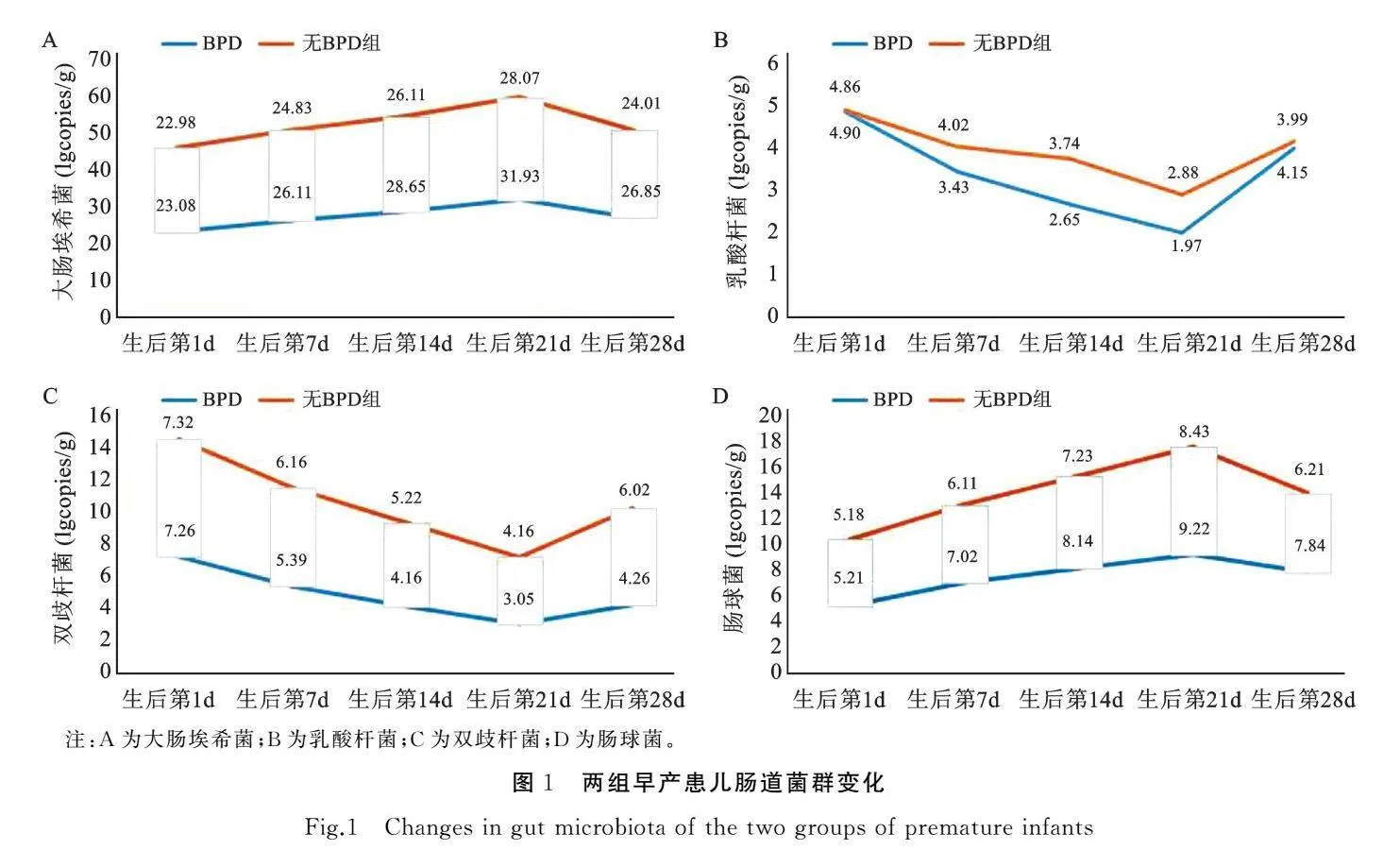
两组早产患儿大肠埃希菌、肠球菌于生后第1、7、14、21d持续升高,于第28d下降;乳酸杆菌、双歧杆菌于生后第1、7、14、21d持续下降,于第28d升高,组间比较差异有统计学意义(t值介于2.234~21.337之间,P<0.05),见表3和图1。
2.4不同程度BPD早产患儿出生7d肠外营养情况比较
随BPD早产患儿病情程度加重,出生7d氨基酸摄入总量、葡萄糖摄入总量、脂质摄入总量、液体摄入总量、热卡摄入总量均逐渐下降,差异有统计学意义(F值介于11.085~21.031之间,P<0.05),见表4。
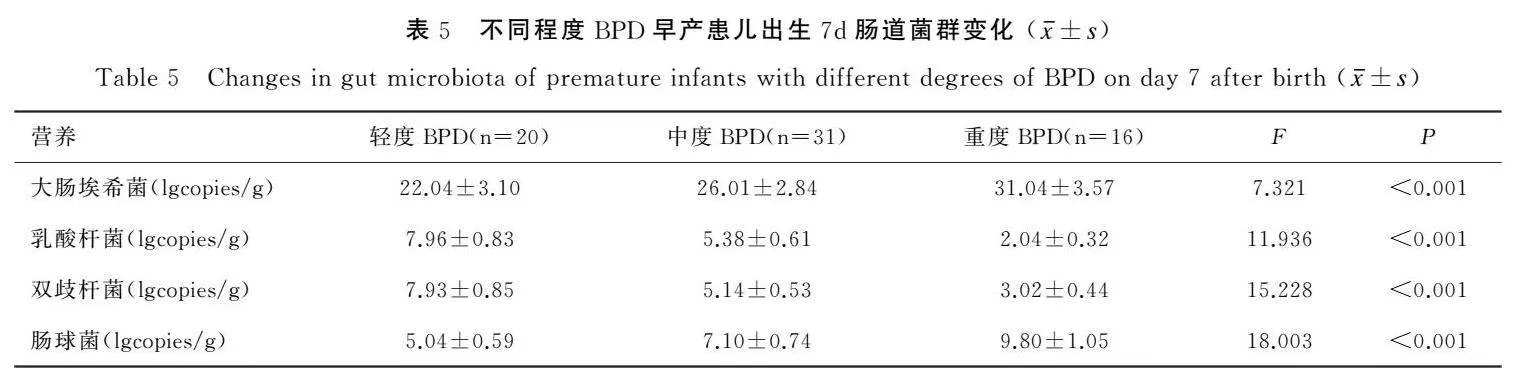
2.5不同程度BPD早产患儿出生7d肠道菌群变化
轻度、中度、重度BPD早产患儿出生7d大肠埃希菌、肠球菌均逐渐升高,乳酸杆菌和双歧杆菌均逐渐下降,差异均有统计学意义(F值介于7.321~18.003之间,P<0.05),见表5。
3讨论
3.1 BPD早产患儿早期肠外营养情况分析
已有报道指出,营养不良会增加早产患儿BPD风险[9]。徐儒政等[10]报道提示早期肠外营养摄入可能与BPD发生有关。动物实验研究也证实营养不良会加剧高氧所致的肺泡损伤,同时对肺实质的重塑造成影响,不利于肺的发育成熟[11]。本结果显示,早产BPD患儿肠道外营养开始较晚、营养量较低。同时本结果还显示,随BPD患儿病情程度加重,氨基酸摄入总量、葡萄糖摄入总量、脂质摄入总量、热卡摄入总量随之明显减少,提示早期肠外营养摄入不足是BPD患儿病情加重的关键原因。由此提示早期为早产患儿提供氨基酸、葡萄糖和脂质等肠外营养物质,对满足患儿营养需求和降低早产患儿出生后BPD发生和进展风险有重要意义。前期报道也证实,合理的营养支持对降低BPD发生率和改善BPD严重程度、促进患儿肺部发育和改善神经系统预后至关重要[1213]。
3.2 BPD早产患儿肠道菌群变化及其与肠外营养的关系
动物实验证实,肠道共生菌群的失调可能参与新生儿肺损伤的发生[14]。而本研究发现,与无BPD组比,BPD组早产患儿生后第7、14、21、28d大肠埃希菌、肠球菌明显较高,乳酸杆菌、双歧杆菌明显较低,随患儿出生时间延长和病情加重,肠道优势菌群明显减少、劣势菌群明显增高。早产患儿因胃肠道发育不成熟、出生后完全暴露于医院环境下,较难获得理想的肠菌定植结果,易出现肠道微生态的失调[15]。双歧杆菌属于一类厌氧革兰氏阴性杆菌,可消耗肠腔内的氧气,降低氧化还原电位,为专性厌氧菌的定植提供有利条件,因而菌量较高时可抑制或减轻患儿肺部炎症,降低BPD发生率[16]。乳酸杆菌属于厚壁菌门,可产生乳酸和细菌素等抗菌物质,与致病菌竞争营养,在增强肠道屏障功能的同时可结合肠道黏附位点,有效抑制致病菌的产生,保护肠道[17]。而本研究显示早产BPD患儿存在明显的肠道菌群失调,是因为肠道及肺直接与体外环境连接,肠道内菌群的异常变动与多种疾病过程紧密相关,早产患儿肺微生物区以单一微生物定植、过度生长、微生物组多样性减少为主要特征[18]。同时,早产BPD患儿原发病较重、体重较低,加之肠道菌群并未完全发育成熟,肠道外营养开始较晚、营养量较低,易出现肠道菌群紊乱。此外,肺与大肠有胚胎学同源性、共同黏膜免疫系统、具有分泌功能等现代生物学基础,肠道菌群既可调节胃肠道功能,也影响呼吸系统健康与疾病,形成“肠肺轴”;“肠肺轴”理论认为肠道微生物群与肺内稳态间存在明显的潜在关联[19]。
综上,本研究结果初步证实早期肠外营养和肠道菌群变化是早产患儿BPD发生和进展的重要影响因素,尽早为早产患儿开展肠外营养支持和肠道菌群监测,对BPD早期风险识别和防治有重要的临床意义。
[参考文献]
[1]Jiang J,Mao Y,Wu J,et al.Relationship between hematological parameters and bronchopulmonary dysplasia in premature infants[J].J Int Med Res,2023,51(7):3033.
[2]鲁元元,方欣,赵小林,等.新生儿支气管肺发育不良高危因素的研究进展[J].中国妇幼健康研究,2020,31(12):17391743.
[3]Gilfillan M,Bhandari V.Pulmonary phenotypes of bronchopulmonary dysplasia in the preterm infant[J].Semin Perinatol,2023,47(6):151153.
[4]高敏,张亚丽,刘梅,等.胎龄32周以下的支气管肺发育不良早产儿预后不良的危险因素[J].安徽医学,2023,44(4):445448.
[5]Lu X,Gao Y,Liu C,et al.Effect of breast milk on the frequency of bronchopulmonary dysplasia in very low birth weight premature infants:a metaanalysis[J].Breastfeed Med,2023,18(9):636644.
[6]Willis K A,Silverberg M,Martin I,et al.The fungal intestinal microbiota predict the development of bronchopulmonary dysplasia in very low birthweight newborns[J].medRxiv,2023,38(29):121123.
[7]中华医学会儿科学分会新生儿学组,中华儿科杂志编辑委员会.早产儿支气管肺发育不良临床管理专家共识[J].中华儿科杂志,2020,5(24):358365.
[8]李睿雯,史源.支气管肺发育不良诊断标准的研究进展[J].临床儿科杂志,2021,39(4):308312.
[9]Nadeau L,Forest J C,Masson M,et al.Biochemical markers in the assessment of proteincalorie malnutrition in premature neonates[J].Clin Chem,2023,32(7):12691273.
[10]徐儒政,孙斌,赵乃琤.早期肠外营养与早产儿支气管肺发育不良发生的关系[J].中国当代儿科杂志,2023,25(4):362367.
[11]尧惠慈,卢红艳,朱玥,等.双调蛋白对支气管肺发育不良模型小鼠肺泡分化的影响[J].中国病理生理杂志,2023,39(1):110116.
[12]Lin H,Bai G,Ge J,et al.Nutritional support during the first week for infants with bronchopulmonary dysplasia and respiratory distress:a multicenter cohort study in China[J].BMC Pediatr,2024,24(1):235238.
[13]Heras A,Chambers R,Solomon Z,et al.Nutritionbased implications and therapeutics in the development and recovery of bronchopulmonary dysplasia[J].Semin Perinatol,2023,47(6):5759.
[14]吴遥.肠道菌群失调对流感病毒感染小鼠急性肺损伤的影响[J].现代预防医学,2018,45(4):694699.
[15]Salgao M K,Natalia P P,Thaís M T,et al.Probiotic infant cereal improves childrens gut microbiota:insights using the simulator of human intestinal microbial ecosystem (SHIME)[J].Food Res Int,2021,143(1):121123.
[16]范佳英.早产儿肠道菌群变化与支气管肺发育不良症的相关研究[D].苏州:苏州大学,2020.
[17]Shen X,Yang Z,Wang Q,et al.Lactobacillus plantarum L168 improves hyperoxiainduced pulmonary inflammation and hypoalveolarization in a rat model of bronchopulmonary dysplasia[J].NPJ Biofilms Microbiomes,2024,10(1):2932.
[18]黄佩怡,敖当,蔡娜莉.早产儿生命早期肠道菌群的建立及其相关疾病研究进展[J].中国微生态学杂志,2022,34(3):360363.
[19]包晟川,闫曙光,陈婷,等.肺肠合治法治疗肺系疾病的研究进展[J].中国实验方剂学杂志,2022,28(8):116122.
[专业责任编辑:刘敬]
[中文编辑:郭乐倩;英文编辑:刘昕田]
[收稿日期]2023-09-26
[作者简介]张雪(1989—),女,主治医师,主要从事早产儿营养方面研究。
[通讯作者]柳丽娜,副主任医师。

