新血栓风险评估模型对恶性肿瘤患者静脉血栓形成的预测价值




[摘 要] 目的:构建一种新的血栓风险评估模型,评估其对恶性肿瘤患者并发静脉血栓栓塞(VTE) 的预测能力,为早期预测具有VTE高风险的恶性肿瘤患者提供依据。方法:纳入128例未接受过治疗的恶性肿瘤患者,将其中40 例在确诊恶性肿瘤2 个月内被诊断为VTE 的患者作为VTE 组,88 例未出现VTE 者作为非VTE 组。比较和分析各组患者的临床危险因素和实验室检测指标,分析患者血栓事件的类型,根据受试者工作特征(ROC) 曲线分析凝血酶-抗凝血酶复合物(TAT)、α2-纤溶酶原激活剂-纤溶酶原激活剂抑制剂复合物(PIC)、D-二聚体(D-dimer) 和纤维蛋白(原) 降解产物(FDP) 在恶性肿瘤并发VTE 中的诊断价值。采用多变量Logistic 回归分析法分析临床危险因素和生物标志物与恶性肿瘤并发VTE 的相关性。构建由TAT≥0. 70 μg·L-1、低分化和心血管危险因素组成的新血栓风险评估模型。根据模型的显著性、拟合优异度、校准曲线和C 值评估模型对恶性肿瘤并发VTE 事件的预测概率。采用模型的C 值和决策曲线分析(DCA) 比较新血栓风险评估模型、COMPASS-CAT 风险评分(CRS) 和Khorana 风险评分(KRS) 评估恶性肿瘤患者并发VTE 的临床应用价值。结果:VTE 组患者血浆 TAT (Plt;0. 001)、PIC (Plt;0. 001)、D-dimer (Plt;0. 05) 和FDP (Plt;0. 01) 水平均高于非VTE 组;与无心血管危险因素、低分化和淋巴转移的患者比较,有心血管危险因素(Plt;0. 001)、低分化(Plt;0. 001) 和淋巴转移(Plt;0. 05) 的恶性肿瘤患者更容易发生VTE。VTE 事件中,大部分(65%) VTE 类型为单独深静脉血栓栓塞(DVT)。ROC 曲线分析,TAT 和PIC 的曲线下面积(AUC 值)、敏感度和特异度均高于D-dimer 和FDP。TAT≥0. 70 μg·L-1(Plt;0. 05)、低分化(Plt;0. 01) 和心血管危险因素(Plt;0. 01) 是恶性肿瘤患者发生VTE 的独立危险因素。构建了由TAT≥0. 70 μg·L-1、低分化和心血管危险因素组成的新血栓风险评估模型。新的风险评估模型有较高的拟合优度(P=0. 805) 和良好的内部验证(χ2=75. 266, Plt;0. 001)。采用ROC 曲线分析新血栓风险预测模型、CRS 和KRS 的C 值分别为0. 908、0. 676 和0. 541,使用DCA 曲线分析新血栓风险评估模型、CRS 和KRS 的临床预测价值,与CRS 和KRS 比较,构建的新血栓风险评估模型具有更高的净获益率。结论:TAT和PIC早期预测VTE高风险的恶性肿瘤患者较D-dimer具有更高的诊断效能。对于本研究纳入的恶性肿瘤患者,由TAT≥0. 70 μg·L-1、低分化和心血管危险因素构建的新血栓风险评估模型诊断效能和临床预测价值均优于CRS 和KRS。
[关键词] 恶性肿瘤; 静脉血栓栓塞; 生物标志物; 风险因素; 风险评估模型
[中图分类号] R730. 6 [文献标志码] A
恶性肿瘤可导致机体高凝状态和静脉血栓栓塞(venous thromboembolism, VTE) 形成[1]。VTE包括深静脉血栓栓塞(deep vein thromboembolism,DVT)、肺栓塞(pulmonary embolism, PE) 和上肢静脉血栓(upper limb venous thrombosis,ULVT),是恶性肿瘤患者的主要并发症之一和死亡的主要原因[2-5]。大规模流行病学调查[6] 结果显示:与同年龄段普通人群比较,在无诱因的VTE 患者中隐匿性恶性肿瘤的检出率更高。与无恶性肿瘤的普通人比较,恶性肿瘤患者发生VTE 的风险升高4~13 倍[7]。有心血管危险因素、处于肿瘤晚期、低分化状态、接受手术、化疗、放疗和中心静脉置管治疗的恶性肿瘤患者容易发生VTE[8-15]。因此,需要对恶性肿瘤患者发生VTE 风险采取个体化评估, 并预测出高风险患者进行药物干预[16]。目前有一些基于大型前瞻性或观察性研究的风险评估模型,用于早期识别具有较高VTE 风险的恶性肿 瘤 患 者。COMPASS-CAT 评 分(COMPASSCATrisk score, CRS) 和Khorana 评分(Khoranarisk score, KRS) 在临床应用中有一定的诊断价值, 但是不能敏感地反映患者全身高凝状态[15,17-18]。迄今为止,对于未进行抗癌治疗的普通实体恶性肿瘤患者来说,尚缺乏一个有效的血栓风险评估工具来满足临床需求。本研究构建并验证一个新的血栓风险评估模型, 用于早期预测具有VTE 高风险的恶性肿瘤患者,并评估新血栓分析评估模型在识别具有VTE 高风险的恶性肿瘤患者中的诊断效能和临床预测价值,并与CRS 和KRS进行比较。
1 资料与方法
1. 1 研 究 对 象 一 般 资 料 纳入 2022 年 3 月—2023 年6 月吉林大学第二医院收治的首次经组织病理学或细胞学证实为恶性肿瘤的成年患者,术前均未接受过放化疗及其他治疗, 所有恶性肿瘤分期均按照肿瘤最新版TNM 分期执行。排除标准:① 3 个月内接受预防性抗凝治疗; ② 纳入时发生VTE 或存在既往VTE 病史; ③ 急性感染性疾病;④自身免疫性疾病;⑤慢性器官衰竭的患者;⑥同时存在其他原发性肿瘤;⑦妊娠。共纳入恶性肿瘤患者128 例,并对患者进行为期2 个月的观察,主要终点为发生客观证实的VTE。通过彩色多普勒超声诊断恶性肿瘤患者DVT 和ULVT,采用计算机断层扫描肺动脉造影诊断PE[16]。纳入128 例未接受过治疗的恶性肿瘤患者, 将其中40 例在确诊恶性肿瘤2 个月内被诊断为VTE 的患者作为VTE 组,88 例未出现VTE 的患者作为非VTE 组。本研究方案经吉林大学第二医院伦理委员会批准。
1. 2 患者临床资料 在患者刚入院且未进行临床治疗(包括手术、放疗、化疗和中心静脉置管等)时收集患者一般资料,包括年龄、性别、身高、体质量、恶性肿瘤类型(包括肺癌、结直肠癌和卵巢癌)、分化程度、淋巴转移、远处转移和心血管危险因素并计算CRS 及KRS 得分。记录患者入院期间的治疗方式,包括肺癌的肺叶切除术、肺叶切除术+淋巴结清扫、全肺切除+含铂双药化疗(单周期化疗),结直肠癌的局部切除手术、Miles+Xelox手术、Miles+Folfox6 手术、Hartmann+Folfox6 手术, 卵巢癌的肿瘤减灭术和肿瘤减灭术+ 紫杉醇(单周期化疗) +卡铂(单周期化疗),以及治疗前后患者四肢血管彩色多普勒超声和肺部计算机断层扫描肺动脉造影,并判断是否并发VTE 和VTE 事件的类型,包括单独DVT、单独PE、DVT 和PE、单独ULVT 及DVT 和ULVT[15,19]。
1. 3 实验室指标检测 采集所有患者首次入院次日清晨空腹血2. 7 mL 于抗枸橼酸钠盐管中,3 000 r·min-1 离心10 min,标记好后置入-80 ℃冰箱保存。需要测定时取出血液样本室温平衡后,采用高灵敏度的酶联免疫吸附试验试剂盒检测凝血酶- 抗凝血酶复合物(thrombin-antithrombincomplex,TAT)(批号MB-0914A) 和α2-纤溶酶原激活剂- 纤溶酶原激活剂抑制剂复合物(α2-plasmin inhibitor-plasmin complex,PIC)(批号MB-00407A), 血浆TAT 和PIC 分别与预先包被的抗体和加入的辣根过氧化物酶(horseradishperoxidase,HRP) 标记的检测抗体发生抗原-抗体反应,形成含HRP 的复合物,HRP 催化加入的底物为有色物质, 根据底物呈色深浅引起吸光度(A) 值的变化,绘制标准曲线,以A 值代表TAT和PIC 浓度,试剂盒由江苏酶标生物科技有限公司提供。按照ELISA 试剂盒说明书操作,计算TAT和PIC 的浓度。采用全自动凝血分析仪(HISCI-800,Sysmex) 以免疫比浊法检测患者血浆中D-二聚体(D-dimer) 和纤维蛋白(原) 降解产物(fibrindegradation products,FDP) 水平,血浆中D-dimer和FDP 与试剂中的单克隆抗体致敏的乳胶颗粒发生抗原-抗体反应,血浆凝集后浊度升高,通过测定浊度的变化,按照仪器操作说明书计算D-dimer和FDP 水平,所用试剂为Sysmex 原装试剂。
1. 4 统计学分析 采用 SPSS 26. 0统计软件进行统计学分析。患者年龄、体质量指数(body massindex, BMI) 和实验室检测指标均进行正态性检验及方差齐性检验, 患者年龄和BMI 服从正态分布, 以x±s 表示, 组间比较采用t 检验; 血清中TAT、PIC、D-dimer 和FDP 水平服从非正态分布,以M (P25,P75) 表示,组间比较采用两独立样本Mann-Whitney U 检验; 患者的恶性肿瘤类型、低分化、淋巴转移、远处转移、心血管危险因素、不同类型恶性肿瘤的治疗方法和VTE 事件的类型以百分率表示, 组间比较采用χ2 检验。采用Logistic逻辑回归进行自变量与因变量之间的相关性分析,采用方差膨胀因子(variance inflation factor,VIF)及Spearman 相关系数(r) 进行变量间的共线性和相关性分析。采用受试者工作特征(receiveroperating characteristic, ROC) 曲线获得模型的曲线下面积(area under curve,AUC) 的区分度,比较变量的AUC、最佳截断值、灵敏度和特异度。采用Logistic 回归分析确定与恶性肿瘤并发VTE 相关的独立危险因素,将危险因素进行组合,绘制新血栓风险评估模型的列线图和校准曲线并进行决策曲线分析(decision curve analysis,DCA)。采用区分度和校准度对模型进行评价,区分度以C 值表示(C≥0. 7 代表有模型具有参考价值), 校准度采用校准曲线检验并评价。采用Bootstrap 法重复抽样1 000 次,对模型进行内部验证。采用DCA 曲线评估感兴趣模型的临床预测价值[20]。以Plt;0. 05 为差异有统计学意义。
2 结 果
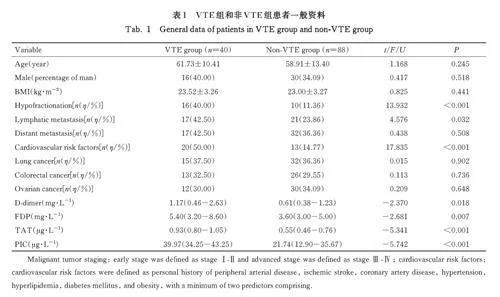
2. 1 VTE组和非 VTE组患者一般资料 VTE组和非VTE 组患者年龄、性别、BMI、恶性肿瘤类型(包括肺癌、结直肠癌和卵巢癌) 及远处转移者百分率比较差异无统计学意义(Pgt;0. 05)。VTE组患者血浆TAT (Plt;0. 001)、PIC (Plt;0. 001)、D-dimer (Plt;0. 05) 和FDP (Plt;0. 01) 水平均高于非VTE 组;分别与无心血管危险因素、无低分化和无淋巴转移的患者比较, 有心血管危险因素(Plt;0. 001)、低分化(Plt;0. 001) 和有淋巴转移(Plt;0. 05) 的恶性肿瘤患者发生VTE 者百分率升高。见表1。
由于不同类型的恶性肿瘤具有不同的特点和发展方式,因此针对不同类型恶性肿瘤的治疗方式也会有所不同。为了排除治疗因素的影响,本研究对不同类型恶性肿瘤相应的治疗方式进行了比较,结果显示:VTE 组和非VTE 组肺癌患者的治疗方式比较差异无统计学意义(Pgt;0. 05); VTE 组和非VTE 组结直肠癌患者治疗方式(局部切除手术、Miles + Xelox 手 术、Miles + Folfox6 手 术 及Hartmann+ Folfox6 手术) 比较差异无统计学意义(Pgt;0. 05); VTE 组和非VTE 组卵巢癌患者治疗方式[肿瘤减灭术、肿瘤减灭术+紫杉醇(单周期化疗) +卡铂(单周期化疗)] 比较差异无统计学意义(Pgt;0. 05)。见表2。
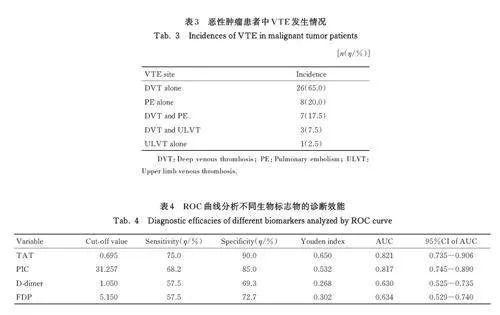
2. 2 恶性肿瘤患者中 VTE发生情况 随访期间,128 例恶性肿瘤患者中有40 例(31. 25%) 患者发生VTE,VTE 组患者中大部分(65%) 血栓事件为单独DVT。见表3。
2. 3 ROC 曲 线 分 析 生 物 标 志 物 的 诊 断 效 能 TAT 和PIC 的AUC 值、敏感性和特异性均高于D-dimer 和FDP。见表4 和图1。
2. 4 恶性肿瘤患者发生 VTE 的独立危险因素 D-dimer 的VIF 为26. 923,FDP 的VIF 为27. 027,均大于10, 表明二者之间存在共线性问题, 可能导致在回归模型中出现不稳定的估计结果,因此本研究排除了上述不符合标准的指标,包括D-dimer和FDP,见表5。对危险因素进行相关性分析,未发现各个危险因素之间存在明显相关性(rlt;0. 700,Pgt;0. 05),见表6。将TAT 和PIC 作为协变量,是否发生VTE 事件作为因变量,进行多因素Logistic 回归分析,结果显示:TAT≥0. 70 μg·L-1(Plt;0. 05)、低分化(Plt;0. 01) 和心血管危险因素(Plt;0. 01) 是恶性肿瘤患者发生VTE 的独立危险因素, 淋巴转移和PIC≥31. 26 μg·L-1 并非VTE 事件的独立危险因素(Pgt;0. 05),见表7。
2. 5 新的血栓风险评估模型的构建和内部验证 导入数据绘出列线图, 图中每个预测因子在“点”轴上被分配一个分数。所有变量得分总和被分配到“总分”轴,总积分与恶性肿瘤相关VTE的预测概率相对应,见图2。新的血栓风险预测模型系数的Omnibus检验结果显示:模型具有良好的内部验证(χ2=75. 266,Plt;0. 001)。Hosmer-Lemeshow检验表明:新的血栓风险预测模型具有较高的拟合优度(P=0. 805)。新血栓风险预测模型判别能力的C 值为0. 908 (95%CI:0. 862~0. 954)。校准图显示校准曲线与理想曲线之间具有良好的一致性,表明模型预测的VTE 发病率与实际发病率具有良好的一致性,见图3。
2. 6 新血栓风险评估模型与 CRS 和 KRS 的比较 新血栓风险预测模型、CRS 和KRS 的C 值分别为0. 908、0. 676 和0. 541,验证了新血栓风险评估模型具有更高的诊断效能。采用DCA 曲线分析新血栓风险评估模型、CRS 和KRS 的临床预测价值结果显示:DCA 曲线可以将模型在不同阈值下的临床获益可视化, 新血栓风险评估模型比CRS 和KRS 具有更高的净获益率。见图4。
3 讨 论
血栓是一种与凝血系统、纤溶系统和内皮系统相关的多因素持续性共同作用导致的疾病[18,21- 22]。一些全球性凝血试验,如凝血酶原时间、活化部分凝血活酶时间和凝血酶时间,主要反映血栓形成过程中凝血因子的消耗、凝血状态激活及继发纤溶亢进,但其诊断价值有限,并且主要是在血栓形成后进行被动检测和后期筛查, 对血栓前状态并不敏感[23-25]。D-dimer 是使用最广泛的评估VTE 的生物标志物,其特点是高灵敏度和低特异度。因此,检测对凝血或纤溶变化高特异性的因子对早期识别VTE 事件至关重要。本研究中,与传统凝血指标D-dimer 和FDP 比较, TAT 在恶性肿瘤血栓前状态时特异性升高,更不容易受炎症、腹水及抗凝剂等其他因素的干扰, 与恶性肿瘤的血栓形成更加相关[25]。
TAT 和PIC 可以从不同角度阐明恶性肿瘤患者VTE 的发病机制。TAT 是体内的凝血酶原激活成凝血酶后,快速与抗凝血酶共价结合生成的稳定复合物。随着凝血机制的激活,TAT 水平同时升高,被认为是反映凝血酶形成的敏感标志物,可以反映血栓尚未形成前的凝血活动[26]。目前已经在各种凝血系统异常的疾病中发现TAT 水平升高,如弥漫性血管内凝血、脑梗死和脑卒中[27-30]。研究[31- 32]显示:TAT 是传统凝血指标D-dimer 和FDP的“上游指标”,并证实TAT 在反映凝血系统激活中更敏感。PIC 是体内无纤维蛋白时, 纤溶酶与α2-抗纤溶酶以1∶1 比例形成的稳定复合物,是纤溶与抗纤溶系统相互作用的产物[26]。在反映纤溶系统的激活中, 血浆PIC 水平升高比D-dimer 和FDP 更敏感, 可以灵敏地反映出微小的凝血状态的改变, 有助于预测恶性肿瘤患者的VTE [25,32]。在本研究中,与非VTE 组比较,VTE 组患者血浆中TAT 和PIC 水平均升高, 与ZHOU 等[25] 报道的结果一致。本研究结果显示: TAT 和PIC 的AUC 值、敏感度和特异性均优于D-dimer 和FDP,在多因素分析中,D-dimer 和FDP 因存在多重共线性而被剔除。
本研究构建的风险评估模型由TAT≥0. 70 μg·L-1、低分化和心血管危险因素组成。采用R 软件将3 个指标构建列线图。模型系数的Omnibus 检验结果表明:新血栓风险评估模型有意义。模型拟合度的Hosmer 和Lemeshow 检验结果显示:提取了足够的信息用于数据分析,新血栓风险评估模型表现出较高的拟合度。与CRS 和KRS比较, 新血栓风险评估模型显示出更高的诊断效能。因此, 新的风险评估模型对于识别有高危VTE 的恶性肿瘤患者具有重要临床价值,为了证实本研究的结果,还需要对模型进行进一步的验证。
根据2019 年美国临床肿瘤学会指南[33],对于有血栓风险的住院癌症患者和癌症手术患者推荐使用肠外抗凝药预防血栓,以降低VTE 发生率。不同的血栓风险评分模型已进行了多项临床试验,并取得了良好的效果,但其对住院的恶性肿瘤患者发生VTE 的诊断标准尚未统一[34]。因此构建有较高诊断效能的血栓风险评估模型有助于减少临床需要使用抗凝药物治疗的患者数量和预防恶性肿瘤患者VTE 的发生。
本研究存在一定的局限性,数据只能应用于与本研究人群相似的肿瘤部位和分期的患者,且未连续招募患者。此外,由于恶性肿瘤患者发生VTE的临床不易获得性,本研究的样本量较小,无法对恶性肿瘤不同发生部位进行区分,排除不同部位导致的实验室指标和评分的异质性。
今后将在如下方面进一步改进: ① 扩大样本量。本研究包括128 例患者,扩大样本量可以提高被评估对象整体水平的稳定性和预测准确性;②进行多中心研究。目前模型基于单个医院的数据,多中心研究可能会有助于评估该模型在不同人群和不同环境中的适应性;③实践应用。对医生和患者进行教育,理解并使用该模型,评分的灵敏度并不如实验室指标,最好在恶性肿瘤患者治疗过程中进行动态评分和检测相关指标进行评价。
综上所述,TAT 和PIC 在早期识别VTE 高风险的恶性肿瘤患者中较D-dimer 具有更高的诊断效能。对于本研究纳入的恶性肿瘤患者,由TAT≥0. 70 μg·L-1、低分化和心血管危险因素构建的新血栓风险评估模型诊断效能及临床预测价值均优于CRS 和KRS。该新血栓风险评估模型能定期检测VTE 高危的恶性肿瘤患者,指导临床治疗并改善其预后,具有较高的临床价值。
利益冲突声明:所有作者声明不存在利益冲突。
利益冲突声明:李红红和于娜参与数据收集及统计分析及论文撰写,史鸣昊和孙莹参与文献检索及数据整理,李峣、沈忠军和刘晓一参与数据分析及样本采集, 赵丽艳参与研究设计、论文撰写指导和论文审校。
[参考文献]
[1] LEVINE M. Treatment of thrombotic disorders in
cancer patients[J]. Haemostasis, 1997, 27(Suppl 1):
38-43.
[2] MOIK F, CHAN W E, WIEDEMANN S, et al.
Incidence, risk factors, and outcomes of venous and
arterial thromboembolism in immune checkpoint inhibitor
therapy[J]. Blood, 2021, 137(12): 1669-1678.
[3] KHORANA A A, KUDERER N M , MCCRAE K,
et al. Cancer associated thrombosis and mortality in
patients with cancer stratified by khorana score risk
levels[J]. Cancer Med, 2020, 9(21): 8062-8073.
[4] ABDULLA A, DAVIS W M, RATNAWEERA N,
et al. A meta-analysis of case fatality rates of recurrent
venous thromboembolism and major bleeding in patients
with cancer[J]. Thromb Haemost, 2020, 120(4):
702-713.
[5] LYMAN G H, CULAKOVA E, PONIEWIERSKI M S,
et al. Morbidity, mortality and costs associated with
venous thromboembolism in hospitalized patients with
cancer[J]. Thromb Res, 2018, 164(Suppl 1): S112-S118.
[6] HUSSEINZADEH H, CARRIER M. Occult cancer
detection in patients with hemostatic disorder and venous
thromboembolism[J]. Thromb Res, 2018, 163: 242-245.
[7] GRILZ E , POSCH F , NOPP S , et al. Relative risk
of arterial and venous thromboembolism in persons
with cancer vs. persons without cancer-a nationwide
analysis[J]. Eur Heart J, 2021, 42(23): 2299-2307.
[8] DEBBIE JIANG M D, ALFRED IAN LEE M D.
Thrombotic risk from chemotherapy and other cancer
therapies[J]. Cancer Treat Res, 2019, 179: 87-101.
[9] MOIK F, AY C, PABINGER I. Risk prediction for
cancer-associated thrombosis in ambulatory patients with
cancer: past, present and future[J]. Thromb Res,
2020, 191(Suppl 1): S3-S11.
[10]LI M, GUO Q, HU W M. Incidence, risk factors, and
outcomes of venous thromboembolism after oncologic
surgery: a systematic review and meta-analysis [J].
Thromb Res, 2019, 173: 48-56.
[11]PASTORI D, CORMACI V M, MARUCCI S, et al.
A comprehensive review of risk factors for venous
thromboembolism: from epidemiology to
pathophysiology[J]. Int J Mol Sci, 2023, 24(4): 3169.
[12]TAXBRO K, HAMMARSKJÖLD F, THELIN B, et al.
Clinical impact of peripherally inserted central catheters
vs implanted port catheters in patients with cancer: an
open-label, randomised, two-centre trial [J]. Br J
Anaesth, 2019, 122(6): 734-741.
[13]CHEW H K, WUN T, HARVEY D, et al. Incidence
of venous thromboembolism and its effect on survival
among patients with common cancers[J]. Arch Intern
Med, 2006, 166(4): 458-464.
[14]KAKKAR A K, WILLIAMSON R C.
Thromboprophylaxis in malignant disease[J]. Br J Surg,
1995, 82(6): 724-725.
[15]SPYROPOULOS A C, ELDREDGE J B, ANAND L N,
et al. External validation of a venous thromboembolic
risk score for cancer outpatients with solid tumors: the
COMPASS-CAT venous thromboembolism risk
assessment mode[l J]. 2020, 25(7): e1083-e1090.
[16]FALANGA A, AY C, DI NISIO M, et al. Venous
thromboembolism in cancer patients: ESMO Clinical
Practice Guideline[J]. Ann Oncol, 2023, 34(5): 452-467.
[17]ABDEL-RAZEQ H, SHARAF B, AL-JAGHBEER M J,
et al. COMPASS-CAT versus Khorana risk assessment
model for predicting venous thromboembolic events in
patients with non-small cell lung cancer on active
treatment with chemotherapy and/or immunotherapy,
the CK-RAM study[J]. J Thromb Thrombolysis, 2023,
56(3): 447-453.
[18]GEROTZIAFAS G T, TAHER A, ABDEL-RAZEQ H,
et al. A predictive score for thrombosis associated with
breast, colorectal, lung, or ovarian cancer: the
prospective COMPASS-cancer-associated thrombosis
study[J]. Oncologist, 2017, 22(10): 1222-1231.
[19]WANG Y F, MA F, LIU B L, et al. Risk prediction of
venous thromboembolism in non-small cell lung cancer
patients based on COMPASS-CAT risk assessment
mode[l J]. Chin J Oncol, 2020, 42(4): 340-345.
[20]DETTERBECK F C, CHANSKY K, GROOME P,
et al. The IASLC lung cancer staging project:
methodology and validation used in the development of
proposals for revision of the stage classification of
NSCLC in the forthcoming (eighth) edition of the TNM
classification of lung cancer[J]. J Thorac Oncol, 2016,
11(9): 1433-1446.
[21]YANG L, CHEONG N, WANG D Y, et al.
Generation of monoclonal antibodies against Blo t
3 using DNA immunization with in vivo
electroporation[J]. Clin Exp Allergy, 2003, 33(5):
663-668.
[22]MEI H, JIANG Y, LUO L L, et al. Evaluation the
combined diagnostic value of TAT, PIC, tPAIC, and
sTM in disseminated intravascular coagulation: a multicenter
prospective observational study[J]. Thromb Res,
2019, 173: 20-26.
[23]KINASEWITZ G T, ZEIN J G, LEE G L, et al.
Prognostic value of a simple evolving disseminated
intravascular coagulation score in patients with severe
sepsis[J]. Crit Care Med, 2005, 33(10): 2214-2221.
[24]DHAINAUT J F, SHORR A F, MACIAS W L, et al.
Dynamic evolution of coagulopathy in the first day of
severe sepsis: relationship with mortality and organ
failure[J]. Crit Care Med, 2005, 33(2): 341-348.
[25]ZHOU K, ZHANG J, ZHENG Z R, et al. Diagnostic
and prognostic value of TAT, PIC, TM, and t-PAIC in
malignant tumor patients with venous thrombosis[J].
Clin Appl Thromb Hemost, 2020, 26:
1076029620971041.
[26]ZHAO X X, YANG S Y, LEI R N, et al. Clinical
study on the feasibility of new thrombus markers in
predicting massive cerebral infarction[J]. Front Neurol,
2023, 13: 942887.
[27]LUNDBECH M, KRAG A E, CHRISTENSEN T D,
et al. Thrombin generation, thrombin-antithrombin
complex, and prothrombin fragment F1+2 as
biomarkers for hypercoagulability in cancer patients[J].
Thromb Res, 2020, 186: 80-85.
[28]LING L Q, HUANG X B, LIU C N, et al. Monitoring
coagulation-fibrinolysis activation prompted timely
diagnosis of hemophagocytic lymphohistiocytosis-related
disseminated intravascular coagulation[J]. Thromb J,
2021, 19(1): 82.
[29]YAMADA S, ASAKURA H. Management of
disseminated intravascular coagulation associated with
aortic aneurysm and vascular malformations[J]. Int J
Hematol, 2021, 113(1): 15-23.
[30]SONG P P, XIE J Q, LI W, et al. Effect of plasma
thrombin-antithrombin complex on ischemic stroke: a
systematic review and meta-analysis [J]. Syst Rev,
2023, 12(1): 17.
[31]CUI C J, GAO J, LI J, et al. Value of TAT and PIC
with D-dimer for cancer patients with metastasis[J]. Int
J Lab Hematol, 2020, 42(4): 387-393.
[32]LIU Y E, MA J T, SHI Q Y, et al. Quantitatively
monitoring acute ischemic stroke patients post
recombinant tissue plasminogen activator treatment[J].
Health Sci Rep, 2021, 4(1): e218.
[33]KEY N S, KHORANA A A, KUDERER N M, et al.
Venous thromboembolism prophylaxis and treatment in
patients with cancer: ASCO clinical practice guideline
update[J]. J Clin Oncol, 2020, 38(5): 496-520.
[34]GALMICHE A, RAK J, ROUMENINA L T, et al.
Coagulome and the tumor microenvironment: an
actionable interplay[J]. Trends Cancer, 2022, 8(5):
369-383.

